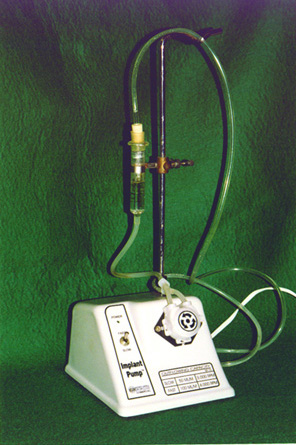
Figura
1. Dispositivo montado para os testes de dissolução,
acoplado
à bomba peristáltica.
ESTUDO "IN VITRO" DO EFEITO DA ADIÇÃO DE LAURIL DIETILENOGLICOL ÉTER SULFATO DE SÓDIO NAS SOLUÇÕES DE HIPOCLORITO DE SÓDIO SOBRE SUAS PROPRIEDADES FÍSICO-QUÍMICAS ANTERIORES E POSTERIORES À DISSOLUÇÃO DO TECIDO PULPAR BOVINO.
Dissertação
de mestrado apresentada em Ribeirão Preto no dia 06 de agosto de
1999
Banca
Examinadora:
Prof.
Dr. Jesus Djalma Pécora, Prof. Dr. Carlos Estrela, Prof.
Dr. Geraldo Maia Campos
BARBIN,
E.L. Estudo "in vitro" do efeito da adição de lauril
dietilenoglicol
éter sulfato de sódio nas soluções de
hipoclorito
de sódio sobre suas
propriedades físico-químicas anteriores e posteriores
à
dissolução do tecido pulpar bovino. Ribeirão
Preto,
1999, 108p. Dissertação (Mestrado) -
Faculdade de Odontologia de Ribeirão Preto, Universidade de
São
Paulo.
|
Versão
(PDF) para impressão ou leitura "off line" |
Estudou-se, in vitro, a dissolução do tecido pulpar bovino, promovida pela solução de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento com e sem lauril dietilenoglicol éter sulfato de sódio, e analisaram-se também o potencial hidrogeniônico, a tensão superficial, a condutividade iônica e o teor de cloro, antes e depois da utilização dessas soluções.
Secionava-se um fragmento da porção central da polpa de incisivos centrais inferiores de bovinos, e sua massa era anotada. Para a realização do teste de dissolução, confeccionou-se um dispositivo conectado a uma bomba peristáltica, que promovia a agitação da solução. Colocava-se um fragmento pulpar no interior desse dispositivo e ligava-se a bomba peristáltica. O tempo de dissolução total foi medido com um cronômetro. Usando o tempo de dissolução do fragmento de polpa e a massa deste, calculava-se a velocidade de dissolução do tecido pulpar.
Concluiu-se que: a) A velocidade de dissolução dos fragmentos de polpa bovina é diretamente proporcional à concentração da solução de hipoclorito de sódio e maior sem tensoativo. b) A redução do pH, entre o início e o final do processo de dissolução pulpar, é inversamente proporcional à concentração da solução de hipoclorito de sódio, com ou sem tensoativo. c) A redução da condutividade iônica, entre o início e o final do processo de dissolução pulpar, ocorreu da mesma forma nas diferentes concentrações da solução de hipoclorito de sódio, com ou sem tensoativo. d) A variação da tensão superficial, entre o início e o final do processo de dissolução pulpar, é diretamente proporcional à concentração da solução de hipoclorito de sódio e maior nas soluções sem tensoativo. As soluções sem tensoativo apresentaram redução da tensão superficial, e as com tensoativo, elevação. e) Os menores teores de cloro remanescente ocorreram com a solução de hipoclorito de sódio a 0,5 por cento, e os maiores, com o grupo formado pelas soluções a 1,0 - 2,5 e 5,0 por cento. As soluções de hipoclorito de sódio com tensoativo apresentaram os menores teores de cloro remanescente após o processo de dissolução.
The dissolution of bovine pulp tissue by 0.5, 1.0, 2.5 and 5% sodium hypochlorite with and without lauryl-diethylene-glycol-ether sodium sulfate was studied, in vitro. The pH, surface tension, ionic conductivity and chlorine level were also analyzed before and after use of these solutions.
A fragment from the central portion of bovine mandibular central incisors was sectioned and its mass was recorded. The pulp fragment was placed in a hydraulic apparatus with a peristaltic pump for agitation of the solution. The time for total dissolution of the pulp segment was recorded with a chronometer. Using the pulp mass and the dissolution time, the velocity of pulp dissolution was calculated.
It is concluded that: a) The velocity of dissolution of the bovine pulp fragments is directly proportional to the concentration of the sodium hypochlorite solution and is greater without the surfactant. b) The decrease in pH, from the beginning to the end of pulp dissolution, is inversely proportional to the concentration of the sodium hypochlorite solution and is greater with or without the surfactant. c) The decrease in ionic conductivity, from the beginning to the end of pulp dissolution, is similar with the different concentrations of the sodium hypochlorite solution, with and without the surfactant. d) The variation of surface tension, from the beginning to the end of pulp dissolution, is directly proportional to the concentration of the sodium hypochlorite solution and is greater in the solutions without surfactant. Solutions without surfactant presented a decrease in surface tension and those with surfactant an increase. e) The smallest levels of residual chlorine occurred with the 0.5% sodium hypochlorite solution, and the greatest with the group formed by 1.0, 2.5 and 5.0% sodium hypochlorite solutions. The sodium hypochlorite solutions with surfactant presented the lowest levels of residual chlorine after the dissolution process.
Já no final do século XIX, a necessidade de se obter a limpeza, anti-sepsia e a conformação do canal radicular para sua ulterior obturação apresentava-se evidente para os profissionais e pesquisadores que se dedicavam à terapêutica endodôntica (KIRK, 1893; CALLAHAN, 1894). Era, então, indispensável a utilização de instrumentos (limas, alargadores e brocas) bem como de soluções químicas para alcançar tais metas.
Fôra compreendido que o êxito do tratamento endodôntico repousava na completa realização das seguintes metas: preparo biomecânico adequado, anti-sepsia rigorosa e obturação hermética dos canais radiculares (MATCHOU, 1980).
A metodologia atual estabelece que a biomecânica, fase que se constitui na ação de instrumentos e soluções químicas no interior do canal radicular, é uma das etapas de máxima importância no tratamento endodôntico e tem sido minuciosamente estudada por muitos pesquisadores dentre os quais podem citar-se: CALLAHAM (1894), GROSSMAN (1943), STEWART (1955), INGLE & ZELDOW (1958), GROSSMAN (1960), NICHOLLS (1962), SCHILDER (1974), WEINE (1976), PAIVA & ANTONIAZZI (1988), DE DEUS (1992) e LEONARDO & LEAL (1998).
A anatomia interna dos dentes humanos é bastante complexa e variável de dente para dente bem como de paciente para paciente. Assim, um dente não apresenta um canal único ou vários canais radiculares, mas sim, um complexo sistema de canais radiculares onde podem estar presentes canais laterais, colaterais, recorrentes, secundários, acessórios, reticulares, intercanaliculares e, ainda, múltiplas aberturas foraminais. Esse complexo sistema de canais radiculares, como também a massa dentinária (canalículos dentinários), não pode receber o instrumento endodôntico (limas, brocas, e alargadores) a não ser no canal principal.
Para agir e limpar todo o complexo sistema de canais radiculares, além do canal principal, faz-se necessária a ação de soluções químicas, que penetrem em todo o sistema endodôntico, realizando a dissolução e a ação antimicrobiana.
Assim, a biomecânica dos canais radiculares constitui-se de uma fase mecânica e de uma fase química aplicadas simultaneamente. Desse modo, pode-se afirmar com segurança que as soluções auxiliares da biomecânica exercem duas ações simultâneas, ou seja: a) uma ação física, pela movimentação hidráulica (irrigação e aspiração), que remove do interior dos canais radiculares detritos que estejam dissolvidos ou em suspensão; e b) ação química propriamente dita, pois essas soluções devem possuir propriedades antimicrobiana e solvente de tecido vivo ou necrótico.
Enquanto a fase mecânica atua preparando, conformando e alargando o canal radicular principal, a fase química age sobre os componentes presentes no interior do sistema de canais radiculares, realizando: a) a dissolução de tecidos orgânicos vivos ou necrosados, b) a dissolução de substâncias inorgânicas, c) a anti-sepsia do canal radicular e d) a suspensão de substâncias composta por moléculas apolares. É evidente que a ação química também atua de forma complementar à ação física, uma vez que detritos dissolvidos ou em suspensão em um fluido são mais fáceis de serem removidos do interior do sistema de canais radiculares por aspiração. Portanto, as soluções auxiliares devem apresentar propriedades físico-químicas que as qualifiquem para essa atividade.
Ao longo da história da Endodontia, inúmeras soluções químicas auxiliares da instrumentação têm sido defendidas e empregadas. Muitas delas não são mais utilizadas, ficando apenas registradas na literatura especializada, e outras ainda continuam em uso.
Dentre as soluções auxiliares utilizadas atualmente, as soluções de hipoclorito de sódio, em diferentes concentrações, são as mais usadas e mundialmente aceitas pelas suas propriedades de clarificação, dissolução de tecido orgânico, saponificação, transformação de aminoácidos em cloraminas ou em sais de aminoácidos, desodorização e ação antimicrobiana.
Segundo PUCCI (1945), a introdução de uma solução de hipoclorito de sódio no arsenal terapêutico data de 1792, com o nome de água de Javelle. Em 1820, o químico francês La Barraque introduziu o hipoclorito de sódio a 2,5 por cento, que ficou conhecido com o nome de licor de La Barraque.
DAKIN (1915) durante a primeira grande guerra mundial, realizou um estudo com as soluções de hipoclorito de sódio e ressaltou seu valor anti-séptico, salientando porém a sua capacidade de irritar tecidos vivos, em virtude de sua alta concentração de hidroxilas. Assim, propôs uma solução de hipoclorito de sódio a 0,5 por cento, com potencial hidrogeniônico próximo do neutro. A redução do potencial hidrogeniônico foi realizada com a adição do ácido bórico. Essa solução ficou conhecida como solução de Dakin, em sua homenagem. BARRETT (1917) salientou o valor terapêutico da solução de Dakin na Odontologia, divulgando sua utilização.
Os trabalhos de WALKER (1936), GROSSMAN & MEIMAN (1941) e GROSSMAN (1943), que estudavam as soluções auxiliares da instrumentação endodôntica, confirmaram o valor da utilização solução de hipoclorito de sódio a 5,0 por cento de cloro ativo. Essa solução, denominada Soda Clorada, Soda Clorada Duplamente Concentrada, ou Solução de Grossman, passou a ser amplamente difundida como solução irrigante de canais radiculares.
Para observar a ação do hipoclorito de sódio sobre a limpeza, anti-sepsia, dissolução tecidual e o aumento de permeabilidade dentinária, dentro do endoductodôncio, bem como sua biocompatibilidade, inúmeros trabalhos foram realizados e dentre eles podem citar-se: MARSHALL (1960), STEWART et al. (1969), SHIH et al. (1970), SENIA et al. (1971), ROBAZZA (1973), NERY et al. (1982), MARTIN & SPRING (1975), McCOMB & SMITH (1976), TREPAGNER et al. (1977), HAND et al. (1978), CUNNINGHAM & BALEKJIAN (1980), WENNBERG (1980), CUNNINGHAN & JOSEPH (1980), ABOU-RASS & PICCININO (1982), MOORER & WESSELING (1982), PÉCORA (1985), FOGEL & PASHLEY (1990), CHEUNG & STOCK (1993), SAVIOLI et al. (1993), BARBOSA et al. (1994), PEREZ et al. (1996) e PÉCORA et al. (1999).
Assim, o hipoclorito de sódio, em diferentes concentrações, tem sua aplicação em Endodontia aceita internacionalmente. Observam-se, porém, poucas investigações quanto à capacidade do hipoclorito de sódio em dissolver tecido pulpar e, em especial, faltam informações sobre as condições físico-químicas dessa solução após os processos de dissolução pulpar. Outro aspecto importante, e também pouco estudado, é a adição de substâncias químicas às soluções de hipoclorito de sódio, que poderiam melhorar seu desempenho, tais como, por exemplo, os tensoativos.
As soluções de hipoclorito de sódio apresentam tensões superficiais em torno de 70 dinas por cm (PÉCORA et al., 1991; NAUMOVICH, 1963, MILANO et al., 1963 e SPANÓ, 1999). Esses valores de tensão superficial são semelhantes aos da água destilada e deionizada. A alta tensão superficial dificulta a penetração dessas soluções no sistema de canais radiculares LEONARDO (1968).
STRINDBERG (1956) e PAIVA (1959), com o intuito de obter maior limpeza dos canais radiculares, preconizaram o uso de diversos tipos de tensoativos sintéticos, também chamados de detergentes e surfactantes, os quais se subdividem em grupos classificados por características químicas. São eles: a) tensoativos aniônicos, que apresentam grande capacidade de limpeza; b) tensoativos catiônicos, com propriedades antimicrobianas e biocompatíveis e c) tensoativos moleculares ou anfóteros que, quando em pH básico ou alcalino, atuam como aniônicos e, em pH ácido, como catiônicos.
As moléculas dos detergentes (tensoativos sintéticos) como também as dos sabões (tensoativos não-sintéticos) possuem a propriedade anfipática. A anfipatia é a propriedade que as moléculas de tensoativos possuem de apresentar uma extremidade polar e outra apolar.
Os tensoativos, quando adicionados a uma solução, sofrem dissociação iônica, resultando em cátions e ânions. Nos tensoativos aniônicos, é o ânion que possui a propriedade anfipática, nos catiônicos, os cátions. A ação anfipática dos tensoativos moleculares é dependente do pH do meio que, quando em pH básico ou alcalino, atuam como aniônicos e, em pH ácido, como catiônicos.
Os tensoativos, devido à propriedade anfipática de suas moléculas, executam movimentos brownianos em solução aquosa e sofrem adsorsão, ou seja, distribuem-se pela superfície de um líqüido, reduzindo dessa maneira a tensão superficial. A redução dessa propriedade físico-química promove o aumento da capacidade de umectação dessas soluções, ou seja, aumento da superfície de contato entre um líqüido e um sólido (PÉCORA et al., 1988 e GUERISOLI et al. 1999).
Dentre os diferentes grupos de tensoativos sintéticos, os aniônicos são amplamente utilizados em Endodontia, devido à grande capacidade de limpeza, principalmente o lauril dietilenoglicol éter sulfato de sódio (PAIVA, 1959 e LAGE & FONSECA, 1980).
O lauril dietilenoglicol éter sulfato de sódio possui uma capacidade de umectação semelhante à dos tensoativos moleculares Miranol e Dehyton AB30, e maior que às dos tensoativos catiônicos Cloreto de Cetilpiridino, Cetavlon e Dehyquart A (PÉCORA, 1988).
O lauril dietilenoglicol éter sulfato de sódio quando adicionado às soluções de hipoclorito de sódio, nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, reduz a tensão superficial e aumenta a capacidade de umectação dessas soluções (GUERISOLI, em publicação).
A redução da tensão superficial aumenta a capacidade de um líqüido em penetrar nas anfractuosidades, ou seja, nas reentrâncias das paredes dentinárias do canal radicular, massa dentinária (canalículos dentinários) e canais laterais, colaterais, recorrentes, secundários, acessórios, reticulares, intercanaliculares e aberturas foraminais em delta apical.
O acréscimo de tensoativo, seja ele sintético ou natural, nas soluções aquosas aumenta a capacidade de emulsificação de substâncias compostas por moléculas apolares devido à capacidade anfipática dos tensoativos.
Assim, o hipoclorito de sódio, em diferentes concentrações, tem sua aplicação comprovada na Endodontia do século XX. Observam-se, porém, poucas investigações a respeito da capacidade do hipoclorito de sódio em dissolver o tecido pulpar vivo e/ou necrosado, e a correlação dessa propriedade com fatores físico-químicos tal como, por exemplo, a redução da tensão superficial.
Na tentativa de obter uma solução irrigante ideal, um grande número de pesquisadores tem proposto e estudado, desde o século passado, as mais diversas soluções auxiliares da instrumentação.
Assim, KIRK (1893) difundiu o uso do dióxido de sódio para a irrigação dos canais radiculares. Essa solução não só limpava o canal radicular como clarificava a dentina, por ser um potente agente oxidante.
SCHREIER (1893) preconizava a aplicação do sódio e potássio metálicos para a limpeza e desinfecção dos canais radiculares. Essas substâncias, ao entrarem em contato com a umidade do canal radicular, formavam o hidróxido de sódio e o hidróxido de potássio, respectivamente.
CALLAHAN (1894) propôs a utilização do ácido sulfúrico a 40 por cento para a irrigação dos canais radiculares. Essa solução era neutralizada, a seguir, com uma solução de bicarbonato de sódio.
HARLAN (1900) propôs a papaína como solução irrigante dos canais radiculares baseado na evidência de que essa substância possui a propriedade de ser solvente de matéria orgânica. No entanto, essa proposta não teve muitos adeptos e mereceria ser melhor estudada.
BARRETT (1917) difundiu o uso da solução de Dakin para a irrigação de canais radiculares e relatou a eficiência dessa solução como anti-séptico.
TAYLOR & AUSTIN (1918) mostraram a ação solvente da solução de Dakin sobre tecido necrosado e observaram ainda que essa solução é pouco irritante aos tecidos vitais.
COOLIDGE (1929) já concluía que o ato de limagem, irrigação e aspiração são artifícios mecânicos que retiram parte dos restos pulpares, raspas de dentina, tecidos necróticos e microrganismos. No entanto, necessita de auxílio químico, para melhorar a limpeza e a desinfecção do canal radicular.
A solução de hipoclorito de sódio tem sido empregada desde muito tempo na instrumentação dos canais radiculares, mas sua grande divulgação ocorreu em 1936, quando WALKER publicou um artigo sobre a capacidade de limpeza promovida pelo hipoclorito de sódio a 5 por cento na desinfecção de canais necrosados.
WALKER (1936) propôs o uso de uma solução de hipoclorito de sódio a 5,0 por cento (soda clorada) para a instrumentação dos canais radiculares de dentes despolpados. Em seu trabalho, esclareceu que essa solução fora utilizada após a indicação feita pelo Dr. Blass, da Universidade de Nova Iorque. Quanto à parte experimental, o autor deu ênfase à complexidade da terapêutica endodôntica ao explicar que esse procedimento é especializado e assim exige uma atenção especial para todos os detalhes, como por exemplo a esterilização dos instrumentos, a manipulação dos canais radiculares e a proteção do paciente e do operador, pois o canal radicular infectado aloja microrganismos de ação contaminante.
Com base no trabalho de WALKER (1936), GROSSMAN & MEIMAN (1941) investigaram a ação de diversas soluções irrigantes sobre a capacidade de dissolução de tecido orgânico, e concluíram que o hipoclorito de sódio a 5 por cento (soda clorada) era o mais efetivo.
GROSSMAN (1943), com base nos trabalhos de WALKER (1936) e GROSSMAN & MEIMAN (1941), preconizou uma técnica de irrigação de canais radiculares que utilizava o uso alternado do hipoclorito de sódio a 5 por cento com o peróxido de hidrogênio a 3 por cento. A reação química entre essas duas soluções dá como resultado final a formação de água, cloreto de sódio e oxigênio nascente. A reação é efervescente e favorece a eliminação dos resíduos do interior do canal radicular.
STRINDBERG (1956) propôs o uso do cloreto cetilpiridino em solução aquosa, na concentração de 0,1 por cento, para a irrigação dos canais radiculares. Essa solução ficou conhecida como Biosept. O cloreto cetilpiridino é um tensoativo catiônico.
PAIVA (1959) preconizou o uso de um tensoativo aniônico, o lauril dietilenoglicol éter sulfato de sódio como solução irrigante de canais radiculares.
FILGUEIRAS et al. (1962) introduziu o tensoativo catiônico cloreto de benzalcônio (Zefirol - Alcil dimetil benzil amônio), na concentração de 0,1 por cento, para a irrigação dos canais radiculares.
VARELLA & PAIVA (1969) divulgaram como solução irrigante de canais radiculares uma associação constituída de uma solução de lauril dietilenoglicol éter sulfato de sódio com uma solução anti-séptica à base de nitrofurazona, o Furacin.
SENIA et al. (1971) observaram que o hipoclorito de sódio a 5 por cento era eficiente na limpeza do canal radicular, exceto nos 3 milímetros apicais. Esses autores citaram três fatores responsáveis pelos seus achados: pouca superfície de contato, pouco volume de solução e pouca circulação do líqüido no local.
TREPAGNIER et al. (1977) estudaram, in vitro, os efeitos das várias concentrações e tempo de reação da solução de hipoclorito de sódio a 5,0 por cento como solvente de tecido, utilizando a mensuração do conteúdo de hidroxiprolina para verificar a eficiência da solução. Concluíram que o hipoclorito de sódio a 5,0 por cento é um potente solvente de tecido, e que a diluição dessa solução com água, em partes iguais, não afeta apreciavelmente sua ação solvente.
HAND et al. (1978) verificaram que soluções de hipoclorito de sódio com concentrações menores que a de 5 por cento tinham a capacidade de dissolução de tecido necrótico reduzida, salientando ainda que quanto maior a área de superfície de contato entre o tecido e a solução de hipoclorito de sódio, melhor é a dissolução.
ROSENFELD et al. (1978) dissolveram polpa dental com hipoclorito de sódio a 5 e 2,5 por cento e concluíram que a solução atua muito efetivamente em polpa fora da câmara pulpar e que a solução tinha pouca efetividade para dissolver polpa que estava confinada no canal radicular.
THÉ (1979) dissolveu tecido necrosado em hipoclorito de sódio e verificou que o tempo de contato, o volume e a concentração da solução eram fatores importantes na dissolução tecidual.
THÉ
et al. (1980) estudaram as reações do tecido conjuntivo
subcutâneo
de Guinea pigs expostos à solução salina
fisiológica
estéril, ao hipoclorito de sódio, nas
concentrações
de 0,9 - 2,1
- 4,1 e 8,4 por cento, e ao formocresol (fórmula de Buckley),
com
o objetivo de determinar qual concentração de hipoclorito
de sódio deveria ser utilizada em procedimentos clínicos.
Os autores concluíram que a determinação da
concentração
clínica ideal do hipoclorito de sódio não deve ser
determinada pelo tipo e intensidade de resposta inflamatória do
tecido conjuntivo, mas sim pela ação solvente desses
hipocloritos,
bem como pelo seu efeito antimicrobiano.
MACHTOU (1980) relatou que o sucesso da terapia endodôntica repousa sobre a tríade preparo biomecânico, controle da infecção e obturação dos canais radiculares. Esse autor salientou que se deve eliminar todos os resíduos e microrganismos do interior dos canais radiculares, e relatou que a ação da solução irrigante depende de dois fatores: o contato entre a solução e os resíduos, e o seu tempo de ação.
CUNNINGHAN & BALEKJIAN (1980) estudaram a dissolução de colágeno pela ação do hipoclorito de sódio e constataram que o hipoclorito de sódio a 2,6 por cento a 37ºC era tão efetivo quanto o hipoclorito de sódio a 5 por cento à temperatura ambiente. A elevação da temperatura potencializava a ação solvente de tecido.
KOSKINEN et al. (1980 a e b) verificaram que o hipoclorito de sódio dissolvia a pré-dentina das paredes do canal radicular e, estudando a dissolução do tecido pulpar bovino promovida pelo hipoclorito de sódio, observaram a eficácia da concentração a 5 e 2,5 por cento na dissolução. Porém, salientaram que a solução de hipoclorito de sódio a 0,5 por cento não era eficiente. Esses autores observaram que 3 mililitros de hipoclorito de sódio eram uma quantidade excessiva para dissolver 100 miligramas de tecido.
ABOU-RASS & OGLESBY (1981) verificaram que o aumento da temperatura da solução de hipoclorito de sódio promove aumento de sua capacidade de dissolução.
GORDON et al. (1981) estudaram o efeito solvente de soluções de hipoclorito de sódio nas concentrações de 1, 3 e 5 por cento sobre o tecido pulpar bovino vivo e necrosado. Os autores observaram que, quanto maior a concentração da solução de hipoclorito de sódio, tanto menor seria o tempo de solvência dos tecidos vivos como também dos necróticos.
MOORER & WESSELINK (1982) estudaram o fluxo líqüido, o pH e a área de contato, na capacidade de dissolução da solução de hipoclorito de sódio. Observaram que o princípio ativo do hipoclorito de sódio dependia da quantidade de moléculas de ácido hipocloroso (HOCl) não dissociadas. Esse ácido é responsável pela forte cloraminação e oxidação de matérias orgânicas, tais como tecido e microrganismos. O ácido hipocloroso (HOCl) é consumido na interação com matéria orgânica.
NAKAMURA et al. (1985) estudaram a ação solvente do hipoclorito de sódio a 2, 5 e 10 por cento sobre o colágeno do tendão, a polpa de dentes e a gengiva de bovinos, nas temperaturas de 4, 22 e 37°C. Esses autores concluíram que o hipoclorito de sódio a 10 por cento, à temperatura de 37°C, foi o mais eficiente em dissolver todos os tecidos estudados; os hipocloritos de sódio a 2 e 5 por cento não mostraram diferenças estatisticamente significantes a 4, 22 e 37°C; e que a ação de dissolução do hipoclorito de sódio sobre o colágeno do tendão bovino foi mais forte do que sobre a gengiva bovina.
HASSELGREN et al. (1988) avaliaram, in vitro, os efeitos do hidróxido de cálcio e do hipoclorito de sódio, separadamente ou associados, na dissolução de tecido muscular necrosado. Observaram que o hidróxido de cálcio é capaz de dissolver tecido orgânico e que o efeito de dissolução tecidual do hipoclorito de sódio é grandemente aumentado com o pré-tratamento com hidróxido de cálcio.
PÉCORA et al. (1988) estudaram a capacidade de umectação dos seguintes tensoativos: lauril dietilenoglicol éter sulfato de sódio, lauril sulfato de sódio, cloreto de cetilpiridino, Cetavlon, Dehyquart A, Dehyton AB 30 e Miranol, concluindo que o lauril dietilenoglicol éter sulfato de sódio apresentava uma razoável capacidade de umectação, sendo inferior somente ao Lauril sulfato de sódio.
MORGAN et al. (1991) analisaram o efeito do hidróxido de cálcio, utilizado isoladamente ou em combinação com o hipoclorito de sódio a 2,6 por cento, sobre a dissolução do tecido pulpar bovino, com período de atuação de 32 minutos. Os autores relataram que não houve diferença significante entre o hidróxido de cálcio utilizado em combinação com o hipoclorito de sódio e o hipoclorito de sódio isolado, e que esses dois grupos foram significantemente mais efetivos em dissolver tecido pulpar bovino do que as soluções de hidróxido de cálcio. A solução salina não apresenta a propriedade de dissolução tecidual.
MILANO et al. (1991) analisaram alguns aspectos do uso do hipoclorito de sódio em Endodontia. Um dos aspectos analisados por eles foi o tempo médio em que uma polpa é dissolvida pela solução de hipoclorito de sódio em diferentes concentrações. Os autores concluíram que as soluções de hipoclorito de sódio apresentam capacidade de dissolução do tecido pulpar na razão direta de suas concentrações.
ANDERSEN et al. (1992) estudaram a solubilidade do tecido pulpar humano em hidróxido de cálcio e hipoclorito de sódio, a uma temperatura constante de 37°C, concluindo que o uso combinado do hipoclorito de sódio e de um curativo provisório com hidróxido de cálcio apresentava bom potencial para a remoção do tecido pulpar.
JOHNSON & REMEIKIS (1993) relataram que as propriedades solventes e antimicrobianas do hipoclorito de sódio são devidas aos seguintes fatores: a) capacidade do hipoclorito de sódio em oxidar e hidrolisar proteínas celulares; b) liberar gás cloro e c) capacidade osmótica de retirar fluidos celulares.
YANG et al. (1995), utilizando fragmentos de polpa bovina, testaram a capacidade de dissolução do hidróxido de cálcio em solução aquosa e misturado à solução de hipoclorito de sódio a 2,5 por cento, em ambiente aeróbio e anaeróbio. Salientaram que as soluções estudadas dissolveram o tecido pulpar em ambos os ambientes.
SÓ et al. (1997) avaliaram a habilidade de dissolução tecidual de soluções de hipoclorito de sódio de diferentes fabricantes, concluindo que a capacidade de dissolução tecidual é diretamente proporcional à concentração da solução de hipoclorito de sódio, e que o hipoclorito de sódio a 0,5 por cento apresenta limitada capacidade de dissolução tecidual.
TÜRKÜN & GENGIZ (1997) estudaram os efeitos do hipoclorito de sódio e do hidróxido de cálcio, isolados ou combinados, com ou sem a utilização de ultra-som, sobre a dissolução tecidual e sobre a limpeza do canal radicular. Os autores concluíram que o pré-tratamento com hidróxido de cálcio, seguido pela utilização do hipoclorito de sódio a 0,5 por cento juntamente com o ultra-som, foi tão eficaz quanto o hipoclorito de sódio a 5,0 por cento na dissolução tecidual e limpeza do canal radicular.
GUERISOLI et al. (1998) investigaram a ação das soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento sobre a estrutura dentinária mineralizada e desmineralizada, pelo tempo de uma hora. Esses autores constataram que a dentina mineralizada apresenta perda de massa tecidual de modo estatisticamente semelhante para todas as concentrações das soluções estudadas. Porém, a dentina desmineralizada (colágeno) sofria perda de massa de modo diretamente proporcional à concentração da solução, ou seja, quanto maior a concentração da solução de hipoclorito de sódio, tanto maior a perda de massa da dentina desmineralizada.
WADACHI et al. (1998) estudaram a dissolução do tecido mole das paredes do canal radicular promovida pelo hidróxido de cálcio, pelo hipoclorito de sódio e pela associação hidróxido de cálcio/hipoclorito de sódio, à luz da microscopia eletrônica de varredura. Concluíram que o hipoclorito de sódio, usado isoladamente, apresentou menos resíduos do que a associação hidróxido de cálcio/hipoclorito de sódio, e do qual o hidróxido de cálcio sozinho.
SPANÓ (1999) estudou a dissolução do tecido pulpar bovino promovida pela solução de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, e analisou também o pH, a tensão superficial, a condutividade iônica e o teor de cloro, no início e no final do processo de dissolução pulpar, constatando: a) relação diretamente proporcional entre a velocidade de dissolução pulpar e a concentração da solução utilizada; b) redução do pH de modo inversamente proporcional à concentração testada; c) redução da condutividade iônica semelhante em todos os casos; d) redução da tensão superficial de modo diretamente proporcional à concentração testada; e e) relação diretamente proporcional entre a concentração de cloro inicial e a concentração de cloro remanescente.
GUERISOLI et al. (em publicação) avaliaram as propriedades físico-químicas (densidade, tensão superficial, pH, viscosidade e capacidade de umectação) das soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, puras ou associadas ao tensoativo aniônico lauril dietilenoglicol éter sulfato de sódio a 0,1 por cento. Verificaram-se que a adição de tensoativo alterou significantemente a tensão superficial, a viscosidade e a capacidade de umectação das soluções, mas não teve efeito sobre a densidade e o pH.
PÉCORA et al. (em andamento) avaliaram a capacidade de limpeza dos canais radiculares das soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento com e sem a adição de lauril dietilenoglico éter sulfato de sódio a 0,1 por cento pelo método morfométrico em microscopia óptica de cortes histológicos corados com hematoxilina-eosina. Eles concluíram que a capacidade de limpeza dos canais radiculares das soluções de hipoclorito de sódio é diretamente proporcional à sua concentração e que a adição do tensoativo não aumenta nem diminui essa capacidade.
A retrospectiva da literatura elucida que a ação de dissolução tecidual promovida pela solução de hipoclorito de sódio é devida ao ácido hipocloroso (HOCl) não dissociado e aos íons hipoclorito (OCl-), os quais atuam sobre as proteínas, realizando a hidrólise e a cloraminação (MOORER & WESSELINK, 1982), e depende também de vários outros fatores, tais como: concentração, temperatura, potencial hidrogeniônico, volume, tempo de contato, superfície de contato e estado da polpa (McCOMB & SMITH, 1976; HAND et al., 1978; TREPAGNIER et al., 1977; SVEC & HARRISON, 1981; CUNNINGHAN & BALEKJIAN, 1980; ABOU-RASS & OGLESBY, 1981; GORDON et al., 1981 e MOORER & WESSELINK, 1982).
Assim, o hipoclorito de sódio, em diferentes concentrações, tem sua aplicação, em Endodontia, aceita internacionalmente devido às suas diversas propriedades favoráveis no tratamento endodôntico: ação antimicrobiana, dissolução de tecido vivo ou necrosado, desodorização e neutralização de substâncias tóxicas. Observam-se, porém, poucas investigações quanto à capacidade das diferentes concentrações do hipoclorito de sódio em dissolver o tecido pulpar, não havendo, em especial, informações sobre as condições físico-químicas dessas soluções após os processos de dissolução pulpar. Outro aspecto importante, e também pouco estudado, é o efeito da redução da tensão superficial das soluções de hipoclorito de sódio, em diferentes concentrações, sobre a capacidade de dissolução do tecido pulpar.
O objetivo do presente trabalho é estudar in vitro o efeito da adição de 0,1 por cento de lauril dietilenoglicol éter sulfato de sódio às soluções de hipoclorito de sódio, nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, sobre a velocidade de dissolução da polpa bovina, e investigar as seguintes propriedades físico-químicas anteriores e posteriores a esse processo:
b) a condutividade iônica;
c) a tensão superficial; e
d) o teor de cloro.
Preparo das soluções de hipoclorito de sódio
As soluções de hipoclorito de sódio, nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, foram aviadas no Laboratório de Pesquisa em Endodontia, a partir de uma solução de hipoclorito de sódio concentrada (12 por cento). O teor de cloro de cada solução foi avaliado por titulometria (iodometria).
Após a titulação, as soluções de hipoclorito de sódio foram armazenadas em recipientes de vidro âmbar, com capacidade para um litro, fechados hermeticamente com batoque e tampa rosqueável. Aviaram-se dois litros de solução para cada concentração diferente de hipoclorito de sódio sendo que, em um deles, era acrescido 0,1 por cento do tensoativo aniônico lauril dietilenoglicol éter sulfato de sódio a 28 por cento (Henkel). Dessa forma, para cada concentração diferente de hipoclorito de sódio, havia um litro sem tensoativo e outro com tensoativo.
Todas as soluções aviadas foram conservados em refrigerador (9 graus centígrados) até o momento de uso. No momento de utilização, as soluções eram colocadas fora do refrigerador até que atingissem a temperatura ambiente de 22 ± 2°C.
Obtiveram-se 20 polpas frescas de incisivos centrais inferiores de bovinos adultos abatidos em frigorífico.
Imediatamente após o abate, a mandíbula bovina era coletada e, no próprio frigorífico, eram realizadas as exodontias, após o que, os dentes eram armazenados em soro fisiológico resfriado e transportados para o Laboratório de Pesquisa em Endodontia.
No Laboratório, preparavam-se canaletas transversais na região cervical dos dentes incisivos centrais inferiores, por meio de uma peça de mão de alta rotação, sob refrigeração. A seguir, os dentes eram presos em uma morsa pela sua porção radicular e, por meio de um martelo cirúrgico, aplicava-se uma pancada na porção coronária do dente. As canaletas tinham a função de determinar um plano de clivagem no dente de modo que a fratura promovesse um corte transversal ao longo eixo do dente, na região cervical.
Por tração manual, separava-se a porção coronária da porção radicular do dente, de modo a expor a polpa coronária.
Com um instrumento endodôntico K File da marca Maillefer, de procedência suíça, número 10, realizava-se o descolamento da polpa dental das paredes dentinárias.
Novamente, por tracionamento manual, retirava-se a polpa do canal radicular.
Procedia-se ao embalamento das polpas bovinas em filme plástico, da marca Magipak, e elas, a seguir, eram congeladas.
Para a realização dos testes, as polpas eram removidas de -9°C para a temperatura ambiente, e permaneciam nessa temperatura por 90 minutos, necessários para o seu descongelamento.
Da porção central de cada polpa bovina, retirava-se, mediante cortes transversais ao longo eixo, realizados com bisturi, um fragmento com 10 milímetros de comprimento, desprezando-se as extremidades, para padronização da superfície externa de cada fragmento pulpar.
Previamente à realização do teste de dissolução, o fragmento a ser utilizado era pesado em balança da marca MLW, de procedência alemã.
Medição da velocidade de dissolução do tecido pulpar
Todos os processos de dissolução pulpar foram realizados em condições ambientais de umidade relativa do ar de 65 ± 5 por cento e temperatura de 22 ± 2 graus centígrados.
Para testar a velocidade de dissolução da polpa bovina, adaptou-se a extremidade de encaixe da agulha de uma seringa Luer Look a uma mangueira de uretane. A seguir, essa mangueira era conectada à entrada de uma bomba peristáltica da marca Implant Pulp/Adiel, e a saída da bomba era colocada na outra extremidade da seringa.
Nesse sistema, colocavam-se 15 mililitros da solução a ser testada que, por intermédio da bomba peristáltica, circulava no sistema fechado com um fluxo constante de 64 mililitros por minuto.
No interior da seringa Luer, era colocada uma rede de nylon para sustentar o fragmento de polpa bovina suspensa na mesma posição, a fim de ter sua superfície totalmente banhada pela solução irrigante.
No momento da imersão do fragmento de polpa na solução a ser testada, acionava-se o cronômetro. O fragmento pulpar era mantido na solução a ser testada sob circulação constante até sua total dissolução, momento em que se travava o cronômetro. Finda a dissolução da polpa, o tempo gasto era anotado. Considerava-se como o momento da dissolução total do fragmento aquele em que a polpa não era mais visível com auxílio de uma lupa marca Ramsor, com aumento de dezesseis vezes, de procedência brasileira. A Figura 1 mostra o dispositivo montado para que fosse possível a realização do teste de dissolução.

Figura
1. Dispositivo montado para os testes de dissolução,
acoplado
à bomba peristáltica.
Testes preliminares realizados com água destilada e deionizada revelaram que essa substância não era capaz de realizar a dissolução do tecido pulpar bovino.
Para medir o pH das soluções de hipoclorito de sódio, em diferentes concentrações, com e sem tensoativo, no início e no fim dos processos de dissolução pulpar, utilizou-se um medidor de pH DMPH-2 marca Digimed de procedência brasileira.
Medição da condutividade iônica
A condutividade iônica das soluções de hipoclorito de sódio, em diferentes concentrações, com e sem tensoativo, no início e no fim dos processos de dissolução pulpar, foi medida por meio de um condutivímetro marca Analion modelo C-701 de procedência brasileira.
A tensão superficial das soluções de hipoclorito de sódio, em diferentes concentrações, com e sem tensoativo, no início e no fim dos processos de dissolução da polpa bovina, foi medida por meio de um tensiômetro marca Fisher Scientific de procedência norte-americana.
Para avaliar o teor de cloro das soluções de hipoclorito de sódio, em diferentes concentrações, com e sem tensoativo, no início e no fim do processo de dissolução pulpar, utilizou-se o método da titulometria (iodometria).
Velocidade de dissolução do tecido pulpar
Os resultados deste trabalho, em relação à variável velocidade de dissolução do tecido pulpar, consistem basicamente em dois conjuntos de dados numéricos, um deles referente às massas das polpas dentais bovinas, e o outro referente aos tempos gastos na dissolução dessas mesmas massas de tecido nas 4 soluções em estudo. Esses dados experimentais estão reunidos respectivamente nas Tabelas I e II, e são portanto mutuamente vinculados, casa a casa, nas duas Tabelas. Os 40 dados de cada uma delas, por sua vez, resultam do cruzamento de 4 soluções de hipoclorito de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas condições (com ou sem adição de tensoativo), com cinco repetições de cada uma dessas combinações, o que resulta no produto fatorial: 4 . 2 . 5 = 40 valores numéricos que compõem as Tabelas I e II.
Tabela I. Massa dos fragmentos de polpa bovina, em miligramas.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabela II. Tempo de dissolução pulpar em segundos.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A associação das Tabelas I e II, pela divisão de cada um dos dados da Tabela I pelo seu correspondente vinculado da Tabela II, forneceu os dados referentes à velocidade de dissolução dos fragmentos de polpa dental bovina nas 4 soluções de hipoclorito de sódio, com ou sem tensoativo. Os quocientes dessa divisão, como não poderia deixar de ser, são também em número de 40 e estão reunidos na Tabela III.
Tabela III. Velocidade de dissolução pulpar, em miligramas por segundo.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na realidade, os dados desta terceira Tabela são os que de fato importam, em termos de interpretação dos resultados do experimento no presente item, uma vez que a variação da massa pulpar, assim como a variação do tempo gasto na sua dissolução, considerados isoladamente, são pouco informativos e, menos ainda, conclusivos. Assim, sobre os dados da Tabela III, fizeram-se inicialmente testes estatísticos preliminares, visando a esclarecer se a distribuição dos erros experimentais seria normal, e se as variâncias entre as repetições seriam homogêneas, o que permitiria o emprego da estatística paramétrica.
Esses testes mostraram que a distribuição dos erros experimentais dos dados originais da Tabela III era não-normal, ainda que as variâncias envolvidas no teste fossem homogêneas. A não-normalidade contra-indicava a aplicação de testes paramétricos com esses dados originais. No entanto, por meio de uma transformação dos dados originais (raiz cúbica dos dados), conseguiu-se uma normalização razoável da distribuição dos erros amostrais, continuando outrossim homogêneas as variâncias envolvidas. O teste de normalidade e de homogeneidade de Cochran estão relatados no Anexo A (página *). A Tabela IV mostra os novos valores, após a transformação (raiz cúbica) dos dados.
Tabela IV. Raiz cúbica dos valores de velocidade de dissolução do tecido pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A normalização da distribuição e a homogeneidade das variâncias autorizava agora o emprego da estatística paramétrica e o modelo matemático do experimento indicava, como teste adequado, a análise de variância, para dois fatores de variação independentes.
Análise de variância
A Tabela V mostra os resultados da análise de variância para avaliação da variável velocidade de dissolução do tecido pulpar.
Tabela V. Análise de variância (raiz cúbica dos dados).
|
|
|
|
|
|
|
| Solução |
|
|
|
|
|
| Condição |
|
|
|
|
|
| Interações Solução x Condição |
|
|
|
|
|
| Resíduo |
|
|
|
||
| Variação total |
|
|
Pelo exame da Tabela V, observa-se que a análise de variância apontou: a) diferença estatística significante, ao nível de 1,0 por cento de probabilidade, para o fator de variação Solução, b) diferença estatística significante, ao nível de 1,0 por cento de probabilidade, para o fator de variação Condição e c) diferença estatística significante, ao nível de 5,0 por cento de probabilidade, para a interação Solução versus Condição.
Fator de variação Solução
A fim de esclarecer quais dentre as diferentes concentrações das soluções de hipoclorito de sódio envolvidas na análise de variância apresentariam valores de velocidade de dissolução pulpar significantemente diferentes entre si, efetuou-se um teste complementar de Tukey. A Tabela VI exibe os resultados do teste complementar de Tukey para esse fator de variação.
Tabela VI. Teste de Tukey para o fator de variação Solução (raiz cúbica dos dados).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Símbolos diferentes junto às médias representam valores estatisticamente diferentes. | ||
O teste complementar de Tukey indicou diferença estatisticamente significante ao nível de 1 por cento de probabilidade entre todas as médias comparadas referentes à velocidade de dissolução pulpar. Dessa forma, foi possível ordenar as diferentes concentrações das soluções de hipoclorito de sódio de forma crescente quanto à velocidade de dissolução pulpar: solução de hipoclorito de sódio a 0,5 - 1,0 - 2,5 e 5,0 por cento. Assim, pode-se concluir que, quanto maior a concentração da solução de hipoclorito de sódio utilizada, tanto maior a sua capacidade de dissolução do tecido pulpar.
Fator de variação Condição.
A análise de variância detectou diferença estatisticamente significante, ao nível de 1,0 por cento de probabilidade, entre as médias transformadas de velocidade de dissolução pulpar das soluções de hipoclorito de sódio com e sem tensoativo, o que indica que a velocidade de dissolução pulpar das soluções de hipoclorito de sódio é maior sem tensoativo que com essa substância, ou seja, que a média (transformada) 0,35499, referente à condição "sem tensoativo" é significantemente maior que a média (igualmente transformada) 0,32831, relativa à condição "com tensoativo". Em suma: a presença do tensoativo nas soluções de hipoclorito de sódio realmente retarda de modo estatisticamente relevante, o processo de dissolução do tecido pulpar bovino.
Interação Solução x Condição
A partir das médias transformdas dos componentes da interação Solução x Condição foi possível traçar a Figura 2, que mostra o comportamento da velocidade de dissolução do tecido pulpar bovino em função das diferentes concentrações das soluções de hipoclorito de sódio.
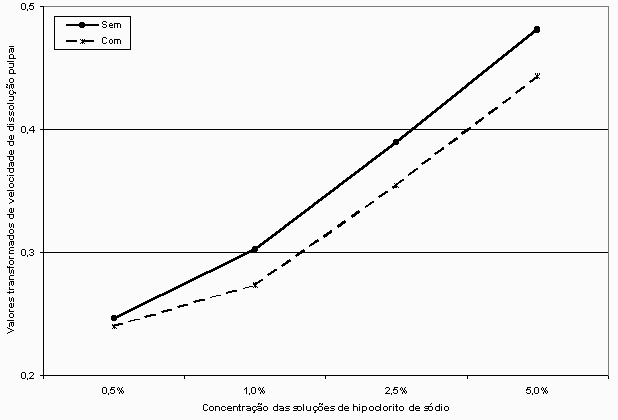
Figura
2. Variação da velocidade de dissolução do
tecido pulpar em função das concentrações
das
soluções
de hipoclorito de sódio.
A Figura 2 mostra que o comportamento da velocidade de dissolução do tecido pulpar é mais ou menos semelhante tanto com como sem tensoativo. A velocidade tende a aumentar conforme aumenta a concentração da solução de hipoclorito de sódio. Como a análise de variância acusou significância ao nível de 5 por cento de probabilidade para as interações, analisando as linhas que representam as duas condições (com e sem tensoatvio) verifica-se que há alguma difença de comportamento apenas quando se passa da concentração de 0,5 para a de 1,0 por cento. Depois disso, as retas correm paralelamente.
Testes de regressão e de correlação entre as variáveis velocidade de dissolução pulpar e concentração das soluções de hipoclorito de sódio
Para melhor estudar a relação entre as diferentes concentrações das soluções de hipoclorito de sódio e a velocidade de dissolução pulpar, realizou-se o teste de regressão e correlação. A Tabela VII a seguir mostra os resultados desse teste.
Tabela VII. Testes de regressão e de correlação (valores originais).
|
|
|
|
| Valor de a calculado |
|
(a = 0,01) |
| Valor de b calculado |
|
|
| Valor do r calculado |
|
|
| Graus de liberdade |
|
|
| Valor calculado de t |
|
|
| Probabilidade de H0 |
|
|
| X² calculado, 2 graus de liberdade |
|
|
| Probabilidade de aderência |
|
|
| Correlação |
|
|
| Curva com melhor aproximação |
|
|
| Equação da curva potencial |
|
|
O teste de regressão e correlação indicou uma correlação diretamente proporcional entre as diferentes concentrações das soluções de hipoclorito de sódio e a velocidade de dissolução pulpar, e que a curva que melhor descreve essa relação é uma curva potencial. A Figura 3 ilustra a curva potencial da velocidade de dissolução pulpar em função da concentração das soluções de hipoclorito de sódio.
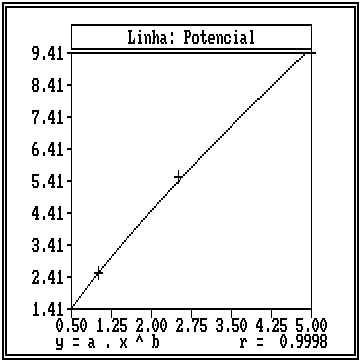
Figura
3. Curva potencial da velocidade de dissolução pulpar em
função
das
concentrações das soluções de hipoclorito
de
sódio.
Os resultados deste trabalho, em relação à variável redução porcentual do pH, consistem basicamente em dois conjuntos de dados numéricos, um deles referente aos valores de pH medidos anteriormente aos processos de dissolução do tecido pulpar, e o outro referente aos valores de pH medidos posteriormente aos mesmos processos, nas 4 soluções em estudo.
As repetições, da Tabela IX, foram feitas a partir de uma mesma solução-mãe, cujo pH foi medido e consta na Tabela VIII. Assim, cada valor da Tabela VIII é o valor inicial para as respectivas 5 repetições da Tabela IX.
Os oito
dados
da Tabela VIII, resultam do cruzamento de 4 soluções de
hipoclorito
de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas
condições
(com ou sem adição de tensoativo), com uma única
medida
de cada uma dessas combinações, o que resulta no produto
fatorial:
4 . 2 . 1
= 8 valores numéricos que compõem a Tabela VIII.
Tabela VIII. Valores de pH inicial medidos anteriormente aos processos de dissolução pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Os 40 dados da Tabela IX, por sua vez, resultam do cruzamento de 4 soluções de hipoclorito de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas condições (com ou sem adição de tensoativo), com cinco repetições de cada uma dessas combinações, o que resulta no produto fatorial: 4 . 2 . 5 = 40 valores numéricos que compõem essa Tabela.
Tabela IX. Valores de pH final medidos após o processo de dissolução pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A associação das Tabelas VIII e XI, segundo a Equação I, pela divisão de cada um dos dados da Tabela IX pelo seu correspondente vinculado da Tabela VIII, menos um, e o resultado dessa operação multiplicado por cem, forneceu os dados referentes à redução porcentual de pH nas 4 soluções de hipoclorito de sódio, com ou sem tensoativo.
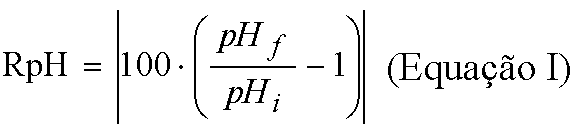
Nessa equação I, "RpH" é a redução porcentual do pH, "pHf" é o pH final da solução de hipoclorito de sódio após sua utilização no processo de dissolução pulpar, e "pHi" é o pH inicial antes da utilização dessas soluções.
As porcentagens calculadas por essa equação, como não poderia deixar de ser, são também em número de 40 e estão reunidos na Tabela X.
Tabela X. Redução porcentual do pH das soluções de hipoclorito de sódio, após a dissolução do tecido pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
No presente estudo, os valores de pH das soluções de hipoclorito de sódio, no início do processo de dissolução pulpar, são sempre maiores que os finais. Isso faz com que, na Equação I, o quociente da divisão do pH final pelo inicial seja sempre menor do que 1, de modo que, quando se subtrai 1 desse quociente, o resultado é sempre menor que zero, e portanto negativo. Esses valores negativos indicavam uma redução do pH entre o início e o final dos processos de dissolução pulpar. Por esse motivo, denominou-se a variável de redução porcentual do pH.
Na realidade, os dados da Tabela X são os que de fato importam, em termos de interpretação dos resultados do experimento no presente item, uma vez que os valores de pH inicial, assim como de pH final, considerados isoladamente, pouco informam. Assim, sobre os dados da Tabela X, fizeram-se inicialmente testes estatísticos preliminares, visando a esclarecer se a distribuição dos erros experimentais seria normal, e se as variâncias entre as repetições seriam homogêneas, o que permitiria o emprego da estatística paramétrica.
Esses testes mostraram que a distribuição dos erros experimentais dos dados originais da Tabela X era não-normal, não obstante as variâncias envolvidas no teste serem homogêneas. Também nesse caso, isso contra-indicava a aplicação de testes paramétricos com os dados originais. Por esse motivo, também aqui foi necessária a transformação dos dados originais (raiz quadrada dos dados), a fim de se conseguir uma normalização razoável da distribuição dos erros amostrais, mantendo-se homogêneas as variâncias envolvidas. A Tabela XI mostra os novos valores, após a transformação (raiz quadrada) dos dados.
Tabela XI. Dados transformados (raiz quadrada) dos valores de redução porcentual do pH.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Com a normalização da distribuição e a homogeneidade das variâncias ficava autorizado o emprego da estatística paramétrica, e o modelo matemático do experimento indicava, como teste adequado, a análise de variância, para dois fatores de variação independentes.
Análise de variância
A Tabela XII mostra os resultados da análise de variância para avaliação da variável redução do potencial de hidrogênio.
Tabela XII. Análise de variância (raiz quadrada dos dados).
|
|
|
|
|
|
|
| Solução |
|
|
|
|
|
| Condição |
|
|
|
|
|
| Interações Solução x Condição |
|
|
|
|
|
| Resíduo |
|
|
|
||
| Variação total |
|
|
Pelo exame da Tabela XII, observa-se que a análise de variância apontou: a) diferença estatística significante ao nível de 1,0 por cento de probabilidade, para o fator de variação Solução, b) diferença estatística não-significante para o fator de variação Condição e c) diferença estatística significante ao nível de 5,0 por cento de probabilidade, para a interação Solução x Condição.
Fator de variação Solução
A fim de esclarecer quais dentre as diferentes concentrações das soluções de hipoclorito de sódio envolvidas na análise de variância apresentariam valores de redução porcentual de pH significantemente diferentes entre si, efetuou-se um teste complementar de Tukey. A Tabela XIII exibe os resultados do teste complementar de Tukey para esse fator de variação.
Tabela XIII. Teste de Tukey para o fator de variação Solução (raiz quadrada dos dados).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Símbolos diferentes junto às médias representam valores estatisticamente diferentes. | ||
O teste complementar de Tukey indicou diferença estatisticamente significante ao nível de 1 por cento de probabilidade entre todas as médias comparadas referentes à redução porcentual do pH. Dessa forma, foi possível ordenar as diferentes concentrações das soluções de hipoclorito de sódio de forma crescente quanto à redução porcentual do pH: solução de hipoclorito de sódio a 0,5 - 1,0 - 2,5 e 5,0 por cento. Assim, pode-se concluir que, quanto maior a concentração da solução de hipoclorito de sódio utilizada, tanto menor a redução porcentual do pH, ao final do processo de dissolução do tecido pulpar.
Fator de variação Condição
A análise de variância acusou não-significância estatística para o fator de variação Condição (a >0,05) entre as médias transformadas de redução porcentual do pH das soluções de hipoclorito de sódio com e sem tensoativo, o que indica que a redução porcentual do pH das soluções de hipoclorito de sódio é estatisticamente semelhante tanto sem como com essa substância, ou seja, a média (transformada) 2,50971, referente à condição "sem tensoativo" é estatisticamente semelhante à média (igualmente transformada) 2,59474, relativa à condição "com tensoativo". Em suma: a presença do tensoativo nas soluções de hipoclorito de sódio realmente não altera de modo estatisticamente relevante, a redução porcentual do pH.
Interação Solução x Condição
A partir das médias transformadas dos componentes da interação Solução x Condição, foi possível traçar a Figura 4, que mostra o comportamento da redução porcentual do pH em função das diferentes concentrações das soluções de hipoclorito de sódio.
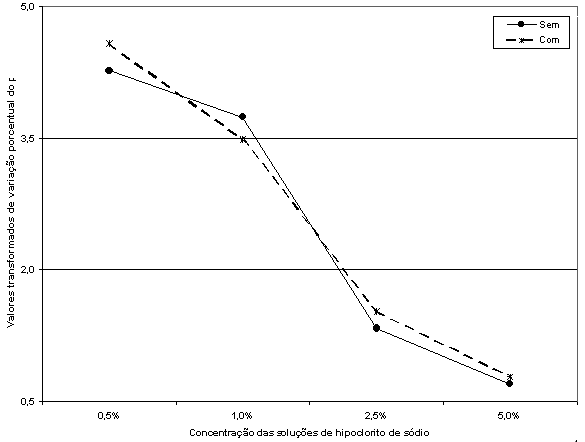
Figura
4. Variação da redução porcentual do pH em
função das concentrações das
soluções
de hipoclorito de sódio.
A Figura 4 mostra, pelo entrelaçamento descendente das duas linhas que representam as condições com e sem tensoativo, que o comportamento da redução porcentual do pH é mais ou menos semelhante tanto com como sem tensoativo. A redução porcentual do pH tende a diminuir conforme aumenta a concentração da solução de hipoclorito de sódio.
Como a análise de variância acusou diferença estatística não-significânte, analisando-se as linhas que representam as duas condições (com e sem tensoatvio), verifica-se que as linhas, embora se entrelacem, em um trajeto descendente, não são exatamente paralelas. O cruzamento, pela significância ao nível de 5 por cento de probabilidade da interação, diz que pode haver alguma diferença no comportamento dos componentes da interação, porém não nuito acentuada.
Testes de regressão e de correlação entre as variáveis redução porcentual do pH e concentração das soluções de hipoclorito de sódio
Para melhor estudar a relação entre as diferentes concentrações das soluções de hipoclorito de sódio e a redução porcentual do pH, realizou-se o teste de regressão e correlação. A tabela a seguir mostra os resultados do teste de regressão e correlação.
Tabela XIV. Testes de regressão e de correlação (valores originais).
|
|
|
|
| Valor de a calculado |
|
(a = 0,01) |
| Valor de b calculado |
|
|
| Valor do r calculado |
|
|
| Graus de liberdade |
|
|
| Valor calculado de t |
|
|
| Probabilidade de H0 |
|
|
| X² calculado, 2 graus de liberdade |
|
|
| Probabilidade de aderência |
|
|
| Correlação |
|
|
| Curva com melhor aproximação |
|
|
| Equação da curva potencial |
|
|
O teste de regressão e correlação indicou uma corelação inversamente proporcional entre as diferentes concentrações das soluções de hipoclorito de sódio e a redução porcentual do pH, e que a curva que melhor descreve essa relação é uma curva logarítmica. A Figura 5 ilustra a curva logarítmica da redução porcentual do pH em função das concentrações das soluções de hipoclorito de sódio.
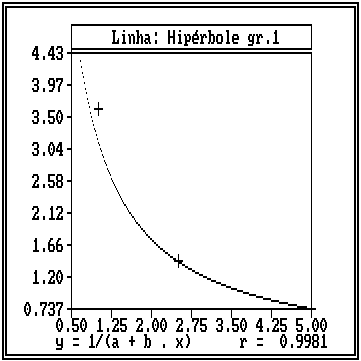
Figura
5. Curva hiperbólica do 1º grau da redução
porcentual
do pH em função da
concentração
das soluções de hipoclorito de sódio.
Pode-se observar que quanto maior a concentração da solução de hipoclorito de sódio tanto menor será a redução porcentual do pH.
Em relação à variável redução porcentual da condutividade iônica, também neste caso os resultados consistem basicamente em dois conjuntos de valores numéricos, um deles relativo aos valores de condutividade iônica medidos anteriormente aos processos de dissolução do tecido pulpar, e o outro referente aos valores de condutividade iônica medidos posteriormente aos mesmos processos, nas 4 soluções estudadas, segundo duas condições: com ou sem tensoativo.
As medidas de condutividade iônica final (Tabela XVI) foram realizadas a partir de uma mesma solução-mãe, cujo condutividade iônica foi medida e considerada inicial (Tabela XV). Dessa forma, cada valor da Tabela XV é o valor inicial para as respectivas 5 repetições da Tabela XVI, que são assim as medidas finais.
A Tabela XV agrupa oito dados que resultaram do cruzamento de 4 soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, sob duas condições: com tensoativo ou sem tensoativo, com uma única medida de cada um dos componentes dessa combinação, o que resulta no produto fatorial de 4 soluções vezes 2 condições e vezes 1 medida, resultando em 8 valores numéricos de condutividade iônica, ditos iniciais, os quais compõem a Tabela XV.
Tabela XV. Condutividade iônica quantificada anteriormente aos testes de dissolução pulpar em milisiemens.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Os 40 dados da Tabela XVI, por sua vez, resultam do cruzamento de 4 soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, sob duas condições: com tensoativo ou sem tensoativo, com cinco repetições de cada um dos componentes dessa combinação Solução X Condição, o que resulta no produto fatorial de 4 soluções vezes 2 condições vezes 5 repetiçoes resultando em 40 valores numéricos de condutividade iônica, finais, que compõem as Tabelas XVI.
Tabela XVI. Valores de condutividade iônica final das soluções de hipoclorito de sódio, após os testes de dissolução pulpar, em milisiemens.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A associação das Tabelas XV e XVI, segundo a Equação II, pela divisão de cada um dos dados da Tabela XVI pelo seu correspondente vinculado da Tabela XV, menos 1, e o resultado dessa operação multiplicado por cem, forneceu os dados de redução porcentual de condutividade iônica nas 4 soluções de hipoclorito de sódio, com ou sem tensoativo.
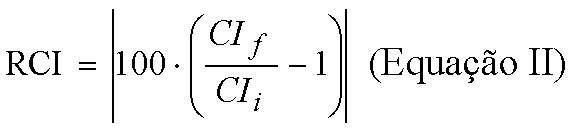
Nessa equação, "RCI" é a redução porcentual da condutividade iônica, "CIf" é a condutividade iônica final da solução de hipoclorito de sódio após a utilização nos processos de dissolução pulpar e "CIi" é a condutividade iônica inicial medida antes do uso dessa solução.
Os resultados dessa operação também são em número de 40 e estão agrupados na Tabela XVII.
Tabela XVII. Redução porcentual da condutividade iônica das soluções estudadas.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Neste trabalho, os valores de condutividade iônica das soluções de hipoclorito de sódio no início do processo de dissolução pulpar são sempre maiores que os finais. Isso faz com que na Equação II o quociente da divisão da condutividade iônica final pela inicial seja sempre menor do que 1, e quando se subtrai 1 desse quociente e se multiplica o resto por 100, o resultado é sempre menor que zero, e portanto negativo. Esses valores negativos indicavam uma redução da condutividade iônica entre o início e o final dos processos de dissolução pulpar. Por esse motivo, denominou-se a variável de redução porcentual do condutividade iônica.
Os dados da Tabela XVII são os que serão utilizados para a interpretação dos resultados deste experimento, uma vez que os valores de condutividade iônica inicial, assim como de condutividade iônica final, considerados isoladamente, pouco elucidam. Dessa forma, utilizando inicialmente os dados da Tabela XVII, realizaram-se testes estatísticos preliminares, com a finalidade de esclarecer se a distribuição dos erros experimentais seria normal, e se as variâncias entre as repetições seriam homogêneas, o que permitiria o emprego da estatística paramétrica.
Esses testes mostraram que a distribuição dos erros experimentais dos dados originais da Tabela XVII era normal e as variâncias envolvidas no experimento homogêneas.
A normalidade dos erros experimentais e a homegeneidade das variâncias autorizava o emprego da estatística paramétrica, e o modelo matemático do experimento indicava, como teste adequado, a análise de variância, para dois fatores de variação independentes.
Análise de variância
A Tabela XVIII mostra os resultados da análise de variância para avaliação da variável redução porcentual da condutividade iônica.
Tabela XVIII. Análise de variância (valores originais).
|
|
|
|
|
|
|
| Solução |
|
|
|
|
|
| Condição |
|
|
|
|
|
| Interação Solução x Condição |
|
|
|
|
|
| Resíduo |
|
|
|
||
| Variação total |
|
|
O exame da Tabela XVIII, revela não ter havido significância estatística para nenhum dos dois fatores de variação estudados, nem para a interação entre eles.
Fator de variação Solução
A análise de variância acusou não-significância estatística (a >0,05) para o fator de variação Solução entre as médias de redução porcentual da condutividade iônica das soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0 por cento, o que indica que a redução porcentual da condutividade iônica das soluções de hipoclorito de sódio é estatisticamente semelhante, não importando a concentração dessa solução, ou seja, as médias 4,3038 - 4,3497 - 4,9186 e 4,2933 referentes às concentrações de 0,5 - 1,0 -2,5 e 5,0 por cento respectivamente, quando comparadas duas a duas, não apresentam diferença estatisticamente significante entre si. Em resumo: a variação da concentração das soluções de hipoclorito de sódio não altera de modo estatisticamente significante, a redução porcentual da condutividade iônica.
Fator de variação Condição
A análise de variância acusou não-significância estatística (a >0,05) também para o fator de variação Condição entre as médias de redução porcentual da condutividade iônica das soluções de hipoclorito de sódio com e sem tensoativo, o que indica que a redução porcentual da condutividade iônica das soluções de hipoclorito de sódio é estatisticamente semelhante tanto sem como com a adição dessa substância, ou seja, a média 4,2464, referente à condição sem tensoativo é estatisticamente não-diferente da média 4,6863, relativa à condição com tensoativo. Ou seja: a presença do tensoativo nas soluções de hipoclorito de sódio não altera de modo estatisticamente importante a redução porcentual da condutividade iônica.
Interação Solução x Condição
A partir das médias dos valores de redução porcentual de condutividade iônica dos componentes da interação Solução x Condição foi possível traçar a Figura 6, que mostra o comportamento da redução porcentual da condutividade iônica em função das diferentes concentrações das soluções de hipoclorito de sódio.
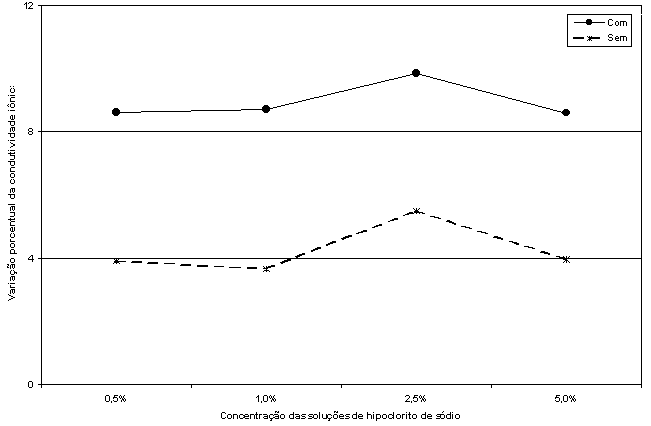
Figura
6. Variação da redução porcentual da
condutividade
iônica em função das concentrações das
soluções
de hipoclorito de sódio.
A Figura 6 mostra, que o comportamento da redução porcentual da condutividade iônia é semelhante tanto com como sem tensoativo e tende a permanecer constante, com pequenas variações, conforme aumenta a concentração da solução de hipoclorito de sódio. Como a análise de variância acusou diferença estatística não-significante para a interação Solução x Condição, analisando-se as linhas que representam essas duas condições (com e sem tensoatvio), verifica-se que essas linhas, embora se tratando de linhas quebradas, mostram um trajeto quase paralelo, ainda que em níveis ligeiramente diferentes, porém não estatisticamente desiguais. Esse paralelismo das duas linhas é que revela um comportamento semelhante das duas condições, quando se passa de uma concentração para outra da solução de hipoclorito de sódio.
Os resultados deste trabalho, em relação à variável porcentual da tensão superficial, consistem basicamente em dois conjuntos de dados numéricos, um deles referente aos valores de tensão superficial inicial, medidos anteriormente aos processos de dissolução do tecido pulpar, e o outro referente aos valores de tensão superficial final, medidos posteriormente aos mesmos processos.
As repetições, da Tabela XX, foram feitas a partir de uma mesma solução-mãe, cuja tensão superficial foi medida e consta na Tabela XIX. Assim, cada valor da Tabela XIX é o valor inicial para as respectivas 5 repetições da Tabela XX.
Os oito dados da Tabela XIX, resultam do cruzamento de 4 soluções de hipoclorito de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas condições (com ou sem adição de tensoativo), com uma única medida de cada uma dessas combinações, o que resulta no produto fatorial: 4 . 2 . 1 = 8 valores numéricos que compõem essa Tabela.
Tabela XIX.
Valores de tensão superficial inicial, em dinas por
centímetro,
das amostras testadas,
medidos
anteriormente
aos testes de dissolução pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Os 40 dados da Tabela XX, por sua vez, resultam do cruzamento de 4 soluções de hipoclorito de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas condições (com ou sem adição de tensoativo), com cinco repetições de cada uma dessas combinações, o que resulta no produto fatorial: 4 . 2 . 5 = 40 valores numéricos que compõem essa Tabela.
Tabela XX.
Valores de tensão superficial final, em dinas por
centímetro,
das amostras testadas,
medidos
imediatamente
após os testes de dissolução pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A associação das Tabelas XIX e XX, segundo a Equação III, pela divisão de cada um dos dados da Tabela XX pelo seu correspondente vinculado da Tabela XIX, menos 1, e o resultado dessa operação multiplicado por 100, forneceu os dados referentes à variação porcentual da tensão superficial nas 4 soluções de hipoclorito de sódio, com ou sem tensoativo, com cinco repetições de cada uma dessas combinações.
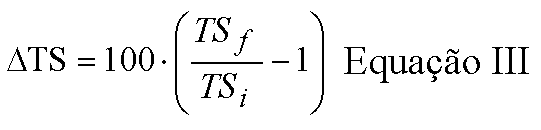
Nessa Equação III, "DTS" é a variação porcentual da tensão superficial, "TSf" é a tensão superficial final da solução de hipoclorito de sódio após o uso no processo de dissolução pulpar, e "TSi" é a tensão superficial inicial, medida antes do uso dessas soluções.
As porcentagens calculadas por essa equação, como não poderia deixar de ser, são também em número de 40 e estão reunidas na Tabela XXI.
Tabela XXI. Valores de variação porcentual de tensão superficial das amostras testadas.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
No presente item, os valores de variação porcentual da tensão superficial podem ser negativos ou positivos. Quando negativos (soluções sem tensoativo), indicam que os valores de tensão superficial no início do processo de dissolução pulpar, são maiores que os finais. Isso faz com que, na Equação III, o quociente da divisão da tensão superficial final pelo inicial seja menor do que 1, de modo que, quando se subtrai 1 desse quociente e o resultado dessa operação é multiplicado por 100, o resultado é sempre menor que zero, e portanto negativo. Esses valores negativos indicavam uma redução da tensão superficial entre o início e o final dos processos de dissolução pulpar.
Os dados positivos (soluções com tensoativo), mostram por sua vez que os valores de tensão superficial no início do processo de dissolução pulpar, são menores que os finais. Isso faz com que, na Equação III, o quociente da divisão da tensão superficial final pela inicial seja maior do que 1, de modo que, quando se subtrai 1 desse quociente, e multiplica-se por 100, o resultado dessa operação é sempre maior que zero, e portanto positivo. Esses valores positivos indicavam uma elevação da tensão superficial entre o início e o final dos processos de dissolução pulpar.
Devido ao fato de parte dos resultados obtidos por meio da Equação III apresentarem valores negativos e positivos, denominou-se a variável desse item de variação (e não redução, como no caso da condutividade iônica) porcentual da tensão superficial.
Os dados da Tabela XXI são os que apresentam relevância, em termos de interpretação dos resultados do experimento no presente item, uma vez que os valores de tensão superficial inicial, assim como de tensão superficial final, considerados isoladamente, pouco esclarecem. Assim, sobre os dados da Tabela XXI, realizaram-se testes estatísticos preliminares de normalidade e de homogeneidade de Cochram visando a esclarecer se a distribuição dos erros experimentais seria normal, e se as variâncias entre as repetições seriam homogêneas, o que permitiria o emprego da estatística paramétrica. Esses testes mostraram que a distribuição dos erros experimentais dos dados originais da Tabela XXI era normal e as variâncias envolvidas no experimento, homogêneas.
A normalidade dos erros experimentais e a homegeneidade das variâncias autorizava o emprego da estatística paramétrica, e o modelo matemático do experimento indicava, como teste adequado, a análise de variância, para dois fatores de variação independentes.
Análise de variância
A Tabela XXII mostra os resultados da análise de variância para avaliação da variável deste item: variação porcentual da tensão superficial.
Tabela XXII. Análise de variância (valores originais).
|
|
|
|
|
|
|
| Solução |
|
|
|
|
|
| Condição |
|
|
|
|
|
| Interação Solução x Condição |
|
|
|
|
|
| Resíduo |
|
|
|
||
| Variação total |
|
|
O exame da Tabela XXII, revela ter havido significância estatística ao nível de 1 por cento de probabilidade, para os dois fatores de variação estudados, como também para a interação entre eles.
Fator de variação Solução
A fim de esclarecer quais dentre as diferentes concentrações das soluções de hipoclorito de sódio envolvidas na análise de variância apresentariam valores de variação porcentual da tensão superficial significantemente diferentes entre si, efetuou-se um teste complementar de Tukey. A Tabela XXIII exibe os resultados do teste complementar de Tukey para esse fator de variação.
Tabela XXIII. Teste de Tukey para o fator de variação Solução (valores originais).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Símbolos diferentes junto às médias representam valores estatisticamente diferentes. | ||
O teste complementar de Tukey indicou diferença estatisticamente significante ao nível de 1 por cento de probabilidade entre todas as médias comparadas, referentes à variação porcentual da tensão superficial. Assim, foi possível ordenar as diferentes concentrações das soluções de hipoclorito de sódio de forma crescente quanto à variação porcentual de tensão superficial: solução de hipoclorito de sódio a 0,5 - 1,0 - 2,5 e 5,0 por cento. Dessa forma, pode-se concluir que, quanto maior a concentração da solução de hipoclorito de sódio utilizada, tanto maior a variação porcentual da tensão superficial, ao final do processo de dissolução do tecido pulpar.
Fator de variação Condição
A análise de variância detectou diferença estatisticamente significante, ao nível de 1 por cento de probabilidade, entre as médias de variação porcentual da tensão superficial das soluções de hipoclorito de sódio com e sem tensoativo, o que indica que o valor absoluto da variação porcentual da tensão superficial das soluções de hipoclorito de sódio é maior sem tensoativo que com essa substância, ou seja, que a média -29,47995, referente à condição "sem tensoativo" é significantemente maior que a média 4,28830, relativa à condição "com tensoativo".
Em suma: a presença do tensoativo nas soluções de hipoclorito de sódio reduz, de modo estatisticamente relevante, a variação porcentual da tensão superficial, sendo que na condição "sem tensoativo" a variação porcentual da tensão superficial é de redução ao final do processo de dissolução do tecido pulpar, e na condição com tensoativo, a variação porcentual da tensão superficial se dá por elevação ao final do mesmo processo.
Interação Solução x Condição
A partir das médias dos valores de variação porcentual da tensão superficial dos componentes da interação Solução x Condição foi possível traçar a Figura 7, que mostra o comportamento da variação porcentual da tensão superficial em função das concentrações das soluções de hipoclorito de sódio.
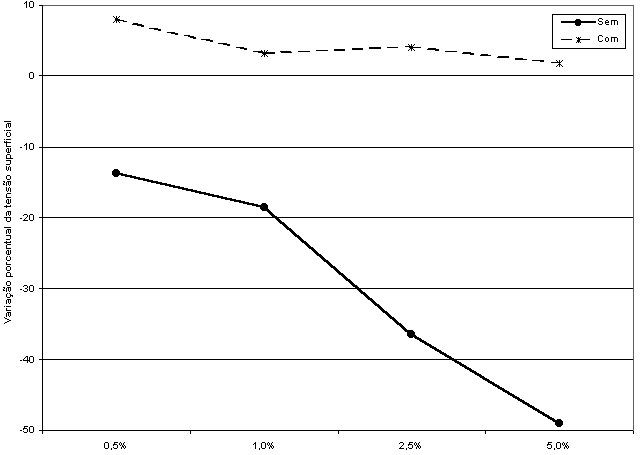
Figura
7. Curva da variação porcentual da tensão
superficial
em função das concentrações das
soluções
de
hipoclorito de sódio, nas condições com e sem
tensoativo.
O teste de Tukey para o fator de variação Condição apontou diferença estatística significante ao nível de 1,0 por cento de probabilidade entre os seus componentes com e sem tensoativo. A Figura 7 reitera esse resultado, uma vez que as curvas referentes aos dois componentes desse fator de variação apresentam-se em níveis diferentes de variação porcentual da tensão superficial, e sem sobreposição.
Com a observação do declive da curva das soluções sem tensoativo na Figura 7, constata-se uma queda no valor porcentual da tensão superficial que se torna cada vez mais negativo, à medida que se caminha da solução de hipoclorito de sódio menos concentrada para a solução de hipoclorito de sódio mais concentrada. Vê-se também um declive da curva das soluções com tensoativo, no entando, em uma intensidade menos acentuada.
Ainda analisando a Figura 7, e considerando o sistema de coordenadas cartesianas, as duas linhas representativas das condições com e sem tensoativo estariam em quadrantes diferentes. A linha com tensoativo estaria no 1º quadrante, onde tanto as concentrações como a variação porcentual da tensão superficial são positivos, ao passo que a linha sem tensoativo estaria no 4º quadrante, onde as concentrações tem valores positivos e a variação porcentual da tensão superficial valores negativos. Tal ocorrência indica uma redução da tensão superficial entre o início e o final dos processos de dissolução pulpar naqueles casos sem tensoativo e que essa redução é maior à medida que se utilizam soluções mais concentradas. Por outro lado, a variação porcentual da tensão superficial é positiva entre o início e o final do mesmo processo nos casos com tensoativo, e essa tensão se mantém mais ou menos constante ao longo das várias concentrações da solução de hipoclorito de sódio.
Testes de regressão e de correlação entre as variáveis variação porcentual da tensão superficial e concentração das soluções de hipoclorito de sódio
Para testar a existência de uma possível correlação entre a variação das concentrações das soluções de hipoclorito de sódio e a variação porcentual da tensão superficial, realizou-se o teste de regressão e correlação entre essas variáveis. A Tabela XXIV relata os resultados desse teste.
Tabela XXIV. Testes de regressão e de correlação (valores originais).
|
|
|
|
| Valor de a calculado |
|
(a = 0,01) |
| Valor de b calculado |
|
|
| Valor do r calculado |
|
|
| Graus de liberdade |
|
|
| Valor calculado de t |
|
|
| Probabilidade de H0 |
|
|
| X² calculado, 2 graus de liberdade |
|
|
| Probabilidade de aderência |
|
|
| Correlação |
|
|
| Curva com melhor aproximação |
|
|
| Equação da curva |
|
|
Os resultados do teste de regressão e correlação indicaram uma correlação direta entre a redução porcentual da tensão superficial e as concentrações das soluções de hipoclorito de sódio sendo que a curva que melhor relatava essa correlação era a curva logarítmica. A Figura 8 ilustra essa curva.
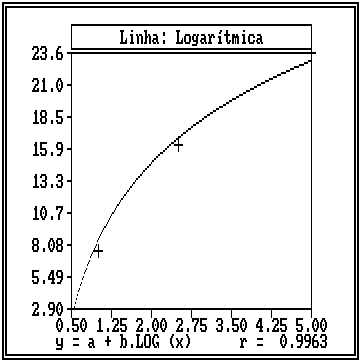
Figura
8. Curva logarítica da variação porcentual de
tensão
superficial em função das
concentrações
dassoluções de hipoclorito de sódio.
Pode-se observar, na Figura 8, que quanto maior a concentração da solução de hipoclorito de sódio tanto maior a variação porcentual da tensão superficial. Cabe explicar que os dados de variação porcentual da tensão superficial da Figura 8 estão em valores absolutos, e portanto sempre positivos, e eles descrevem uma variação de redução da tensão superficial.
Os resultados deste trabalho, em relação à variável teor de cloro remanescente, consistem basicamente em dois conjuntos de dados numéricos, um deles referente aos teores de cloro iniciais, medidos anteriormente aos processos de dissolução do tecido pulpar, e o outro referente aos teores de cloro finais, medidos posteriormente aos mesmos processos.
As repetições, da Tabela XXVI, foram feitas a partir de uma mesma solução-mãe, cujo teor de cloro foi medido e consta na Tabela XXV. Assim, cada valor da Tabela XXV é o valor inicial para as respectivas 5 repetições da Tabela XXVI.
Os oito dados da Tabela XXV, resultam do cruzamento de 4 soluções de hipoclorito de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas condições (com ou sem adição de tensoativo), com uma única medida de cada uma dessas combinações, o que resulta no produto fatorial: 4 . 2 . 1 = 8 valores numéricos que compõem essa Tabela.
Tabela XXV.
Teores de cloro iniciais, medidos anteriormente aos testes de
dissolução
pulpar,
em valores
porcentuais.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Os 40 dados da Tabela XXVI, por sua vez, resultam do cruzamento de 4 soluções de hipoclorito de sódio (a 0,5 - 1,0 - 2,5 e 5,0 por cento), em duas condições (com ou sem adição de tensoativo), com cinco repetições de cada uma dessas combinações, o que resulta no produto fatorial: 4 . 2 . 5 = 40 valores numéricos que compõem essa Tabela.
Tabela
XXVI.
Teores de cloro finais, medidos após os testes de
dissolução
pulpar,
em valores
porcentuais.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A associação das Tabelas XXV e XXVI, segundo a Equação IV, pela divisão de cada um dos dados da Tabela XXVI pelo seu correspondente vinculado da Tabela XXV e o quociente multiplicado por 100, forneceu os dados referentes ao porcentual de cloro remanescente nas 4 soluções de hipoclorito de sódio, com ou sem tensoativo. Na Equação IV, considerou-se o teor de cloro inicial das soluções testadas como sendo o teor de cloro máximo (100 por cento), sendo o porcentual de cloro remanescente uma fração desta porcentagem.
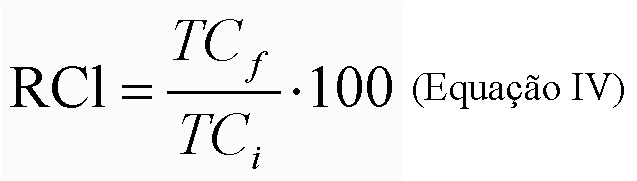
Nessa Equação IV, "RCl" é o porcentual de cloro remanescente, "TCf" é o teor de cloro final da solução de hipoclorito de sódio medido após o processo de dissolução e "TCi" é o teor d cloro inicial medido antes desse processo.
As porcentagens calculadas por essa equação, como não poderiam deixar de ser, são também em número de 40 e estão reunidas na Tabela XXVII.
Tabela
XXVII.
Percentual de cloro remanescente nas soluções de
hipoclorito
de sódio,
após
a dissolução do tecido pulpar.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na realidade, os dados da Tabela XXVII são os que de fato importam, em termos de interpretação dos resultados do experimento no presente item, uma vez que os valores de teor de cloro inicial, assim como os de teor de cloro final, considerados isoladamente, pouco informam. Assim, sobre os dados da Tabela XXVII, fizeram-se inicialmente testes estatísticos preliminares, visando a esclarecer se a distribuição dos erros experimentais seria normal, e se as variâncias entre as repetições seriam homogêneas, o que permitiria o emprego da estatística paramétrica.
Esses testes mostraram que a distribuição dos erros experimentais dos dados originais da Tabela XXVII era não-normal, não obstante as variâncias envolvidas no teste serem homogêneas. Isso contra-indicava a aplicação de testes paramétricos com os dados originais. Por esse motivo, foi necessária a transformação dos dados originais (raiz cúbica dos dados), a fim de se conseguir uma normalização razoável da distribuição dos erros amostrais, mantendo-se homogêneas as variâncias envolvidas. A Tabela XXVIII mostra os novos valores, após a transformação (raiz cúbica) dos dados.
Tabela XXVIII. Dados transformados (raiz cúbica) dos porcentuais de cloro remanescente.
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Com a normalização da distribuição e a homogeneidade das variâncias ficava autorizado o emprego da estatística paramétrica, e o modelo matemático do experimento indicava, como teste adequado, a análise de variância, para dois fatores de variação independentes.
Análise de variância
A Tabela XXIX mostra os resultados da análise de variância para a avaliação da variável porcentual de cloro remanescente.
Tabela XXIX. Análise de variância (raiz cúbica dos dados).
|
|
|
|
|
|
|
| Solução |
|
|
|
|
|
| Condição |
|
|
|
|
|
| Interação Solução x Condição |
|
|
|
|
|
| Resíduo |
|
|
|
||
| Variação total |
|
|
O exame da Tabela XXIX, revela ter havido significância estatística significante ao nível de 1 por cento de probabilidade, para os dois fatores de variação estudados, como também para a interação entre eles.
Fator de variação Solução
A fim de esclarecer quais dentre as diferentes concentrações das soluções de hipoclorito de sódio envolvidas na análise de variância apresentariam valores transformados de porcentual de cloro remanescente significantemente diferentes entre si, efetuou-se um teste complementar de Tukey. A Tabela XXX exibe os resultados do teste complementar de Tukey para esse fator de variação.
Tabela XXX. Teste de Tukey para o fator de variação Solução (raiz cúbica dos dados).
|
|
|
|
|
|
|
3,87559
|
« |
|
|
|
4,29462
|
X | |
|
|
4,38678
|
X | |
|
|
4,39644
|
X | |
| Símbolos diferentes junto às médias representam valores estatisticamente diferentes. | |||
O teste complementar de Tukey determinou diferença estatística, significante ao nível de 1 por cento de probabilidade, apenas para a solução a 0,5 por cento em relação a todas as demais. Estas, por sua vez, demonstraram-se estatisticamente não-diferentes pelo teste de Tukey. Foi possível determinar que a solução de hipoclorito de sódio a 0,5 por cento apresentou os menores valores porcentuais de cloro remanescente e as soluções de hipoclorito de sódio nas concentrações de 1,0 - 2,5 e 5,0 por cento mostraram de maneira estatisticamente semelhantes os maiores porcentuais de cloro remanescente.
Fator de variação Condição
A análise de variância detectou diferença estatisticamente significante, ao nível de 1 por cento de probabilidade, entre as médias transformadas de porcentual de cloro remanescente das soluções de hipoclorito de sódio com e sem tensoativo, o que indica que o porcentual de cloro residual das soluções de hipoclorito de sódio é maior sem tensoativo que com essa substância, ou seja, que a média (transformada) 4,27581, referente à condição "sem tensoativo" é significantemente maior que a média (igualmente transformada) 4,20091, relativa à condição "com tensoativo". Em suma: a presença do tensoativo nas soluções de hipoclorito de sódio realmente diminui de modo estatisticamente relevante, o porcentual de cloro remanescente.
Interação Solução x Condição
A partir das médias transformadas dos componentes da interação Solução x Condição foi possível traçar a Figura 9, que mostra o comportamento do porcentual de cloro remanescente em função das diferentes concentrações das soluções de hipoclorito de sódio.
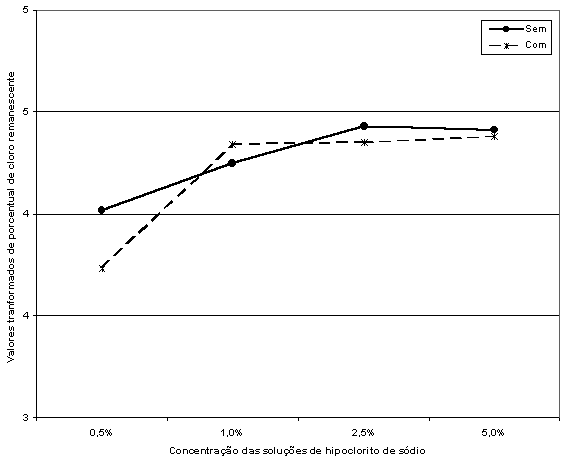
Figura
9. Curvas do porcentual de cloro remanescente em função
da
concentração das
soluções
de hipoclorito de sódio, nas condições com e sem
tensoativo.
A Figura 9 mostra que o comportamento do porcentual de cloro remanescente não é exatamente igual nas duas condições (com e sem tensoativo), razão por que a análise de variância acusou significância estatística para a interação ora comentada. Observando a linha que cescreve o comportamnteo da condição "sem tensoativo", nota-se que há um aclive suave e constante que vai da solução a 0,5 por cento até à de 2,5 por cento, atingindo um relativo "platô" quando passa de 2,5 por cento para 5,0 por cento. Na linha relativa à condição "com tensoativo", o aclive é mais abrupto e vai da solução a 0,5 por cento até à de 1,0 por cento, quando já atinge uma certa estabilidade, formando também um "platô".
Dentre as soluções auxiliares à biomecânica utilizadas atualmente na Endodontia, as soluções de hipoclorito de sódio, em diferentes concentrações, são as mais usadas e mundialmente aceitas pelas suas propriedades de clarificação, dissolução de tecido orgânico, saponificação, transformação de aminoácidos em cloraminas ou em sais de aminoácidos, desodorização e ação antimicrobiana. Dentre elas, a capacidade de dissolver tecido orgânico vivo ou necrosado é uma das mais essenciais.
Essa
ação
de dissolução de tecidos vivos ou necróticos tem
sido
relacionada a alguns fatores: a) a relação entre a
quantidade
de solução irrigante e a massa de tecido orgânico;
b) a superfície de contato; c) o tempo de ação; d)
o volume da solução; e) a temperatura da
solução;
f) a
agitação
mecânica e g) a concentração da
solução
(HAND et al., 1978; THÉ, 1979; CUNNINGHAN & BALEKJIAN, 1980;
GORDON et al., 1981 e MOORER & WESSELINK, 1982). Assim, quanto
maior
a capacidade do hipoclorito de sódio em dissolver os tecidos
orgânicos,
vivos ou necróticos, tanto mais favorável será o
seu
emprego em Endodontia.
A capacidade de dissolução tecidual das soluções de hipoclorito de sódio faz com que fragmentos pulpares em estado sólido sejam dissolvidos pela própria solução irrigante, facilitando sua remoção do interior do sistema de canais radiculares.
O retrospecto da literatura demonstrou que nenhum autor investigou as propriedades físico-químicas da solução de hipoclorito de sódio após ter esta promovido a dissolução de tecido orgânico, nem o efeito proporcionado pela adição de substâncias químicas, como os tensoativos, nas soluções de hipoclorito de sódio, sobre a capacidade de dissolução dos tecidos orgânicos vivos ou necrosados.
O hipoclorito de sódio não existe no estado de pó mas somente em solução aquosa. Estando em solução aquosa, encontra-se em um equilíbrio químico dinâmico, onde pode apresentar-se como um sal não-dissociado, dando origem a outras substâncias ou, apresentando-se também totalmente dissociado. Essa solução aquosa de hipoclorito de sódio, devido ao seu equilíbrio químico dinâmico, pode ser representada pela seguinte reação química:
NaOCl + H2O Û NaOH + HOCl Û Na+ + OH- + H+ + OCl- + HOCl (Reação I),
onde NaOCl é o sal hipoclorito de sódio, H2O é a molécula de água, NaOH é o hidróxido de sódio (base forte), HOCl é o ácido hipocloroso (um ácido fraco), Na+ é o cátion sódio, OH- é o ânion hidroxila, ou oxidrila, H+ é o cátion hidrogênio e OCl- é o ânion hipoclorito.
O ácido hipocloroso não ionizado (HOCl) encontra-se em grande quantidade na solução de hipoclorito de sódio, enquanto que o cátion hidrogênio (H+) e o ânion hipoclorito (OCl-) resultantes de sua ionização, são encontrados em pequena quantidade.
No momento em que as substâncias presentes na solução de hipoclorito de sódio entram em contato com os componentes da matéria orgânica, várias reações químicas se processam, e dentre elas podem citar-se:
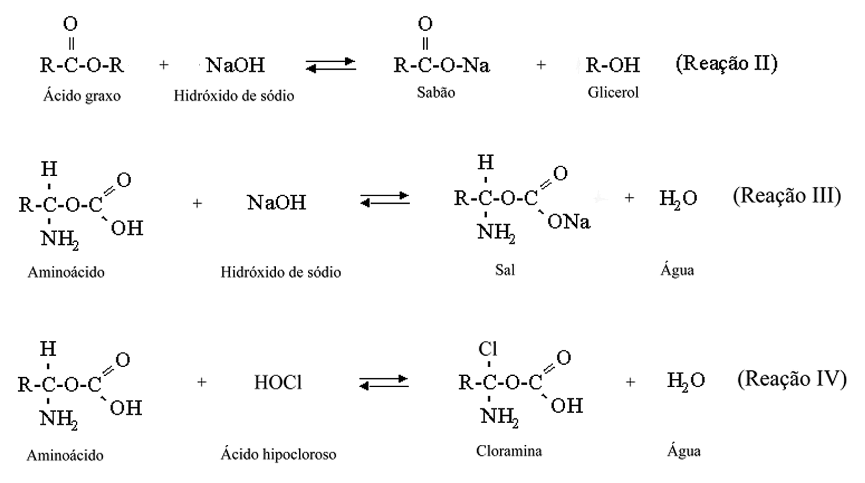
Estas reações químicas entre as substâncias presentes nas soluções de hipoclorito de sódio e os componentes dos tecidos orgânicos vivos ou necrosados, promovem a dissolução desses tecidos.
Neste trabalho, para o estudo do processo de dissolução pulpar, optou-se pela utilização do tecido pulpar bovino não-putrefato, devido ao fato de esse tecido apresentar uma grande semelhança com o tecido pulpar humano (KOSKINEN et al., 1980 b). O emprego de tecido pulpar humano seria inviável, pela dificuldade de obtenção e pelo reduzido tamanho.
Os testes de dissolução do tecido pulpar bovino, realizados neste trabalho, evidenciaram uma relação diretamente proporcional entre a concentração da solução de hipoclorito de sódio e a velocidade de dissolução pulpar, isto é, quanto maior a concentração da solução de hipoclorito de sódio, tanto mais rapidamente o tecido orgânico não-putrefato é dissolvido. Tais achados estão em conformidade com os de GROSSMAN & MEIMAN (1941), HAND et al. (1978), KOSKINEN et al. (1980 b), GORDON et al. (1981), MOORER & WESSELINK (1982), NAKAMURA et al. (1985) e SPANÓ (1999).
A relação diretamente proporcional entre a concentração da solução de hipoclorito de sódio e a velocidade de dissolução pulpar pode ser explicada pelo fato de as concentrações de hipoclorito de sódio mais elevadas conterem maiores quantidades de reagentes para o processo de dissolução pulpar. Essa hipótese é corroborada pelo fato de as concentração mais elevadas de hipoclorito de sódio com e sem tensoativo, apresentarem maior condutividade iônica.
Quando se fala em dissolução de tecido orgânico não-putrefato, promovida pelo hipoclorito de sódio, deve-se pensar que as reações II de saponificação, III de neutralização de aminoácidos e IV de formação de cloraminas ocorrem simultaneamente, todas contribuindo para a dissolução do referido tecido, o que facilita sua remoção do interior do canal radicular.
A análise do processo de dissolução pulpar, realizada neste trabalho, evidenciou também que a adição de lauril dietilenoglicol éter sulfato de sódio nas soluções de hipoclorito de sódio retarda o processo de dissolução pulpar por essa solução. Para tentar explicar por que isso ocorre, podem-se aventar as seguintes possibilidades: a) um envolvimento superficial dos fragmentos lipídicos por moléculas de tensoativo, formando uma micela, o que reduziria o contato desses fragmentos com os componentes da solução de hipoclorito de sódio, diminuindo a intensidade das reações II de saponificação, III de neutralização de aminoácidos e IV de formação de cloraminas, b) produção de bolhas de ar pelo tensoativo, que também reduziriam a superfície de contato entre a solução de hipoclorito de sódio e o tecido pulpar não-putrefato, c) um excesso de tensoativo na solução de hipoclorito de sódio, que desviaria o equilíbrio químico dinâmico da reação de saponificação para o reagente (hidróxido de sódio e ácidos graxos) quando do processo de dissolução pulpar e d) uma reação química entre a solução de hipoclorito de sódio e o lauril dietilenoglicol éter sulfato de sódio poderia estar ocorrendo, reduzindo a capacidade dessas soluções em promover a dissolução do tecido pulpar, e portanto diminuindo a velocidade de dissolução.
Para a complementação da análise do processo de dissolução pulpar, estudaram-se as seguintes propriedades físico-químicas: pH, condutividade iônica, tensão superficial e teor de cloro, na tentativa de entender como elas poderiam influir nesse processo de dissolução.
O estudo do pH no processo de dissolução do tecido pulpar não-putrefato foi necessário, uma vez que os íons hidroxila advindos da dissociação do hidróxido de sódio participam das reações de saponificação e de neutralização dos aminoácidos. Assim, medindo-se o pH no início e no final dos processos de dissolução do tecido pulpar, poder-se-ia analisar a intensidade de ocorrência das reações II de saponificação e III de neutralização dos aminoácidos.
O pH das soluções de hipoclorito de sódio, antes do processo de dissolução pulpar, apresentava-se acima de 12 para todas as soluções, tanto sem como com tensoativo. Tais achados estão de acordo com aqueles encontrados por MARCHESAN et al. (1998), GAMBARINI et al. (1998), SPANÓ (1999) e GUERISOLI et al. (em publicação). Esses elevados potenciais hidrogeniônicos devem-se à forte alcalinidade do hidróxido de sódio, que é uma base forte, tornando o meio repleto de hidroxilas.
O estudo do pH no início e no final dos processos de dissolução do tecido pulpar indicou um decréscimo dos valores de pH. Esse fato deve-se à interação do hidróxido de sódio (NaOH) com a matéria orgânica, segundo as reações II de saponificação e III de neutralização de ácidos graxos.
Na reação II ocorre a transformação dos ácidos graxos (óleos e gorduras) presentes na matéria orgânica em sais de ácidos graxos (sabão) e glicerol. Os íons hidroxila (OH-), presentes no meio e responsáveis pelo elevado pH, reagiram na formação de glicerol (álcool) proporcionando a diminuição da concentração desse íon no meio. Desse modo, a solução resultante tornou-se menos alcalina. Já na reação III, ocorre a neutralização dos aminoácidos formando sal e água o que também diminui o pH da solução resultante. Assim, as reações II e III são responsáveis pela retirada de hidroxilas do meio, o que promove a redução do pH do líqüido residual.
Os achados deste trabalho evidenciaram uma relação inversamente proporcional entre a concentração da solução de hipoclorito de sódio e a redução porcentual do pH entre o início e o final do processo de dissolução pulpar. Isto pode ser expresso de outra maneira, ou seja, que quanto maior for a concentração inicial de uma solução de hipoclorito de sódio, tanto menor será a redução porcentual do pH dessas soluções entre o início e o final do processo de dissolução pulpar.
Uma solução mais concentrada de hipoclorito de sódio apresenta maior capacidade de manter elevada a concentração de hidroxilas no meio, durante o processo de dissolução pulpar. Cabe salientar que uma solução com pH 7 não tem a metade da concetração de hidroxilas que uma solução com pH 14. Na realidade, a concentração de hidroxililas de uma solução com pH 7 é um milhão de vezes menor que a de uma solução com pH 14. Isso se deve ao fato de o pH ser uma função logarítmica (na base 10) do inverso da concentração de íons hidrogênio, onde a variação de uma unidade de pH representa uma variação de dez vezes na concentração de íons hidrogênio. Lembrando que a concentração de íons hidroxila é o inverso da concentração de íons hidrogênio, uma solução com pH maior que 7 (solução básica ou alcalina) possui uma concentração menor de íons hidrogênio e maior de íons hidroxila.
A presença de tensoativo nas soluções de hipoclorito de sódio não alterou o grau de redução porcentual do pH. Tal achado mostra que a presença do lauril dietilenoglicol éter sulfato de sódio provavelmente não afeta os processos que promovem a eliminação de hidroxilas que fazem com que o pH diminua entre o início e o final dos processos de dissolução pulpar.
Fica evidente que ao fim dos processos de dissolução pulpar os íons hidroxila são consumidos. No entanto, os resultados dos testes de tensão superficial e de teor de cloro revelam indícios de que, dependendo da concentração da solução ou da condição (com ou sem tensoativo), a intensidade das reações II de saponificação, III de neutralização de aminoáciso e IV de produção de cloraminas pode variar alternando a predominância das mesmas.
O estudo da condutividade iônica no processo de dissolução do tecido pulpar foi necessário em virtude de esse teste quantificar indiretamente a quantidade de íons em solução, pois a presença desses íons torna a solução um eletrólito capaz de conduzir eletricidade.Uma vez que a reação III (formação de cloraminas) remove íons da solução, medindo a condutividade iônica no início e no final dos processos de dissolução do tecido pulpar, poder-se-ia analisar a maior ou menor ocorrência dessa reação.
As medidas de condutividade iônica, anteriores aos processos de dissolução pulpar, mostraram que, quanto maior a concentração da solução de hipoclorito de sódio com e sem tensoativo, tanto maior é a condutividade iônica. Isso se deve ao fato de que, quanto maior a concentração de uma solução, tanto maior a oferta de íons. Esse relato está de acordo com SPANÓ (1999).
Após a utilização da solução de hipoclorito de sódio nos processos de dissolução pulpar, todas as soluções apresentaram reduções porcentuais da condutividade iônica. Essa redução da condutividade iônica pode ser explicada pelo fato de que, quando o hipoclorito de sódio reage com a matéria orgânica, produzem-se compostos moleculares e assim os íons são retirados do meio.
A redução porcentual da condutividade iônica foi estatisticamente não-diferente para todas as soluções de hipoclorito de sódio estudadas. Essa redução geral pode ser explicada pelo fato de quantidades padronizadas de tecido pulpar bovino terem sido colocadas em contato com as soluções para o processo de dissolução; ou seja, a remoção de íons ocorreu de forma semelhante pelo fato de um dos reagentes do processo, que era o próprio fragmento pulpar, ter tido dimensões e peso mais ou menos uniformizados em todas as amostras.
A redução da condutividade iônica das soluções de hipoclorito de sódio nas condições com ou sem tensoativo foi também estatísticamente não-diferentes. Isso sugere que a redução da quantidade de íons em solução que ocorre durante o processo de dissolução pulpar não foi alterada quantitativamente pela presença do tensoativo. Essa redução geral pode ser também explicada pelo fato da utilização de quantidades padronizadas de tecido pulpar bovino.
A complementação da análise da velocidade de dissolução do tecido pulpar pelo estudo da tensão superficial foi necessária devido à possibilidade de ocorrencia da reação II de saponificação entre a solução de hipoclorito de sódio e o tecido pulpar não-putrefato o que reduziria a tensão superficial dessa solução. Medindo-se a tensão superficial no início e no final dos processos de dissolução do tecido pulpar, poder-se-ia analisar a maior o menor intensidade com que essa reação II de saponificação ocorreria.
A tensão superficial das soluções de hipoclorito de sódio recém-preparadas quantificada anteriormente aos processos de dissolução pulpar apresentava-se entre 73 e 78 dinas por cm. Tais resultados estão de acordo com PÉCORA et al. (1991), SPANÓ (1999), NAUMOVICH (1963) e MILANO et al. (1963). Observa-se que, quanto maior a concentração dessas soluções, tanto mais elevada é, numericamente, a tensão superficial.
A adição do tensoativo aniônico lauril dietilenoglicol éter sulfato de sódio promoveu uma redução de aproximadamente 50 por cento na tensão superficial das soluções de hipoclorito de sódio antes dos processos de dissolução pulpar apresentando valores de tensão superficial resultante numericamente muito próximos uns dos outros variando de 29,9 a 31,2 dinas por centímetro.
Os valores de tensão superficial das soluções com tensoativo são semelhantes aos das soluções aquosas de lauril dietilenoglicol éter sulfato de sódio a 0,125 por cento (Tergentol) como mostrou o trabalho de MILANO et al. (1963). Tal fato conduz à conclusão de que o lauril dietilenoglicol éter sulfato de sódio age reduzindo a tensão superficial da mesma forma, tanto nas soluções de hipoclorito de sódio como nas soluções aquosas.
Observou-se, no presente estudo, que quanto maior a concentração das soluções de hipoclorito de sódio tanto maior a variação da tensão superficial entre o início e o final dos processos de dissolução pulpar.
Este achado pode ser explicado pelo fato de que as soluções mais concentradas, e portanto de maior concentração de hidróxido de sódio, devem propiciar maior formação de sais de ácidos graxos (sabões) por meio da reação II. Os sabões formados reduzem a tensão superficial da solução resultante.
As soluções de hipoclorito de sódio sem tensoativo mostraram maior variação de tensão superficial que as soluções com tensoativo. No caso das soluções sem tensoativo, essa variação foi de redução da tensão superficial entre o início e o final do processo de dissolução, o que pode ser explicado pela ocorrência da reação II de saponificação.
No entanto, as soluções de hipoclorito de sódio com tensoativo mostraram menores variações porcentuais de tensão superficial entre o início e o final dos processos de dissolução pulpar, sendo essa variação de elevação porcentual de tensão superficial. Esse fato pode ser explicado por uma redução da concentração de tensoativo nessas soluções, durante o processo de dissolução pulpar, que poderia ter ocorrido pelo consumo de parte do conteúdo de lauril dietilenoglicol éter sulfato de sódio durante o processo de dissolução pulpar.
O tensoativo provavelmente reage com as substâncias envolvidas no processo de dissolução pulpar ou com o próprio hipoclorito (devido à agitação) formando um produto sem ação tensoativa. Essa especulação também explicaria o fato de a presença de lauril dietilenoglicol éter sulfato de sódio ter reduzido a velocidade de dissolução pulpar das soluções de hipoclorito de sódio, pois o tensoativo competiria com o tecido orgânico pelos reagentes contidos na solução de hipoclorito de sódio durante o processo de dissolução pulpar.
Em um teste piloto, as soluções de hipoclorito de sódio a 0,5 - 1,0 - 2,5 e 5,0 por cento com a adição de 0,1% de lauril dietilenoglicol éter sulfato de sódio tiveram a tensão superficial medida imediatamente após a sua elaboração. Essas soluções eram submetidas ao mecanismo de líqüido circulante utilizado neste trabalho, sem o tecido pulpar durante a média dos tempos medidos neste trabalho e, após isso, quantificava-se novamente a tensão superficial.
Esse teste piloto mostrou que ocorria um aumento da tensão superficial após a submissão dessas soluções ao mecanismo de líqüido circulante. Tal achado sugere a ocorrência de uma reação química entre o hipoclorito de sódio e o lauril dietilenoglicol éter sulfato de sódio. Isso explicaria o fato de as soluções de hipoclorito de sódio com tensoativo mostrarem uma elevação porcentual da tensão superficial entre o início e o final do processo de dissolução pulpar.
O estudo do teor de cloro remanescente, no processo de dissolução do tecido pulpar, foi necessário na medida em que a reação IV de formação de cloramina, que ocorre entre o ácido hipocloroso e os aminoácidos do tecido pulpar, poderia reduzir a concentração de cloro livre dessas soluções. Medindo-se o teor de cloro no início e no final dos processos de dissolução do tecido pulpar, poder-se-ia analisar a maior ou menor ocorrência dessa reação.
Os menores
porcentuais de cloro remanescente, após os processos de
dissolução
pulpar, ocorreram nas soluções de hipoclorito de
sódio
a 0,5 por cento, e os maiores, nas soluções
a 1,0 - 2,5
e 5,0 por cento, a quais apresentaram valores estatisticamente
semelhantes
entre si.
Esse fato sugere que as soluções mais concentradas apresentem maior disponibilidade de reagentes para o processo de dissolução pulpar, estando o equilíbrio químico dinâmico da solução de hipoclorito de sódio desviado para a formação de hidróxido de sódio, o que privilegiaria a ocorrência das reações II e III, que não consomem íons hipoclorito, mantendo elevado o teor de cloro das soluções resultantes desse processo. Essa hipótese é corroborada pela maior condutividade iônica das soluções de hipoclorito de sódio mais concentradas e pelo fato de a maior redução porcentual da tensão superficial ter ocorrido nas soluções de hipoclorito de sódio com concentrações maiores.
A grande redução do teor de cloro das soluções a 0,5 por cento implica um grande consumo de acido hipocloroso no processo de dissolução pulpar, sugerindo que nesses casos a reação IV de formação de cloramina seja a que mais ocorre, promovendo assim uma maior formação de cloraminas, o que consome os íons hipoclorito.
As soluções de hipoclorito de sódio sem tensoativo apresentaram os maiores porcentuais de cloro remanescente e as soluções com tensoativo, os menores. Esse fato sugere que, nos casos com tensoativo, mesmo com as soluções mais concentradas, a reação IV seja também a que mais ocorre, estando o equilíbrio químico dinâmico dessas soluções de hipoclorito de sódio desviado para a formação de ácido hipocloroso, ocorrendo assim maior formação de cloraminas e maior consumo de íons hipoclorito.
Os fatos descritos estão de acordo com SPANÓ (1999), que mostrou que soluções de hipoclorito de sódio com o equilíbrio químico dinâmico desviado para a formação de ácido hipocloroso apresentavam menor velocidade de dissolução pulpar, indicando isso maior ocorrência da reação IV, que parece ser mais lenta que as reações II e III, as quais utilizam o hidróxido de sódio como reagente advindo do equilíbrio químico dinâmico da solução de hipoclorito de sódio.
É importante considerar o fato de que as soluções de hipoclorito de sódio menos concentradas, que já possuem o teor de cloro reduzido, apresentam, após o processo de dissolução pulpar, um teor de cloro ainda mais reduzido, o que faria com que essas soluções perdessem parte de suas propriedades antimicrobianas quando utilizadas na terapêutica endodôntica.
As soluções de hipoclorito de sódio mais concentradas mostraram maior velocidade de dissolução. Essas soluções exibem também menor redução do pH após o processo de dissolução, o que demonstra que essas soluções possuem maior disponibilidade de íons hidroxilas, favorecendo o processo de dissolução. Portanto, os altos valores iniciais de pH provavelmente aumentam a incidência da reação II de saponificação e aceleram a velocidade de dissolução pulpar.
As soluções de menor concentração, que evidenciaram maior redução porcentual do pH e menor velocidade de dissolução, parecem possuir uma quantidade reduzida de hidroxilas, insuficientes para promover uma dissolução tão rápida como a das soluções mais concentradas. Isso sugere maior intensidade de ocorrência da reação IV de formação de cloraminas.
Nas soluções com tensoativo, a velocidade de dissolução pulpar foi menor que nas soluções sem essa substância. No entanto, a redução porcentual do pH foi estatísticamente semelhante, indicando igual consumo das hidroxilas no processo de dissolução. Isso sugere que o consumo de hidroxilas não se altera de modo quantitativo, porém os íons hidroxilas podem ter sido utilizados não na dissolução mas na neutralização do próprio tensoativo, aumentado a tensão superficial das soluções após o processo de dissolução.
As soluções mais concentradas, que apresentaram maior velocidade de dissolução pulpar, mostraram também maiores níveis de condutividade iônica, sugerindo que os íons em solução são realmente os reagentes necessários para a dissolução pulpar. Essas soluções, exibiram igualmente maiores reduções da tensão superficial após o processo de dissolução pulpar evidenciando a grande ocorrência da reação II de saponificação.
As soluções menos concentradas mostraram menor redução da tensão supercial, indicando que nesses casos a reação III de neutralização de aminoácidos e IV de formação de cloraminas são mais freqüentes que a reação II de saponificação. As reações III de neutralização de aminoácidos e IV de formação de cloraminas devem possuir uma velocidade de reação menor que a reação II de saponificação, já que nesses casos a velocidade de dissolução pulpar é menor.
A velocidade de dissolução e a variação (elevação) da tensão superficial foram menores nos casos com tensoativo. Isso indica pequena produção de sabão no processo de dissolução; produção essa que deve ter sido menor que a neutralização do tensoativo que ocorreu nesse caso, já que a tensão superficial aumentou, sugerindo maior incidência da reação III de neutralização dos aminoácidos e da reação IV de formação de cloraminas.
Nas soluções mais concentradas, que apresentaram maior velocidade de dissolução pulpar, detectou-se também maior quantidade de cloro remanescente, o que sugere maior intensidade de ocorrência da reação II de saponificação que não retira o íon hipoclorito da solução. Essa hipótese pode ser explicada pelo fato de as soluções mais concentradas apresentarem uma disponibilidade extremamente maior de íons hidroxila que as soluções menos concentradas, pois o pH é uma função logarítmica (na base 10) do inverso da concentração de íons hidrogênio ou, simplesmente, da concentração de hidroxilas.
Nas soluções menos concentradas, o porcentual de cloro remanescente foi menor, indicando que nesses casos a reação IV de formação de cloraminas foi a mais freqüente; porém a velocidade da reação IV de formação de cloramina aparenta ser menor que a da reação II de saponificação.
As soluções de hipoclorito de sódio com tensoativo apresentaram tanto menor velocidade de dissolução do tecido pulpar como também menor porcentual de cloro remanescente, sugerindo maior incidência da reação IV de formação de cloraminas como nos casos das soluções menos concentradas.
Os resultados deste trabalho sugerem que as reações II de saponificação, III de neutralização de aminoácidos e IV de formação de cloraminas são, em conjunto, responsáveis pelo processo de dissolução pulpar. No entanto, com as soluções de hipoclorito de sódio menos concentradas, e com as soluções de hipoclorito de sódio em diferentes concentrações com tensoativo, parece haver um freqüência maior da reção IV de formação de cloraminas, enquanto que, com as soluções de hipoclorito de sódio mais concentradas parece ocorrer maior freqüência da reação II de saponificação, o que implica maior velocidade de dissolução pulpar com essa reação II em relação às reações III e IV.
Devido à complexidade do assundo abordado, novos estudos serão ainda necessários para sanar algumas dúvidas surgidas, como por exemplo: a) qual seria o efeito da adição de cloreto de sódio nas soluções de hipoclorito de sódio a 1,0 por cento sobre a velocidade de dissolução pulpar? A adição do cloreto de sódio é utilizada na produção da solução de Milton, com a finalidade de aumentar a estabilidade (shelf life) desse produto, b) qual seria o efeito da adição de ácido bórico e do bicarbonato de sódio nas soluções de hipoclorito de sódio a 0,5 por cento sobre a velocidade de dissolução pulpar? A adição de ácido bórico e de bicarbonato de sódio é empregada na produção do líqüido de Dakin e da solução de Dausfrene, para reduzir o pH dessas soluções e aumentar a biocompatibilidade com os tecidos humanos.
Com base na metodologia empregada e nos resultados obtidos, pode-se concluir que:
1. A velocidade de dissolução do tecido pulpar bovino é diretamente proporcional à concentração da solução de hipoclorito de sódio.
1.1. A velocidade de dissolução pulpar é maior nas soluções de hipoclorito de sódio sem a adição do tensoativo lauril dietilenoglicol éter sulfato de sódio.2. A redução do pH, entre o início e o final do processo de dissolução pulpar, é inversamente proporcional à concentração da solução de hipoclorito de sódio com e sem tensoativo.1.2. A velocidade de dissolução pulpar foi tão maior quanto maior a disponibilidade de íons hidroxila e de íons hipoclorito na solução de hipoclorito de sódio, o que promoveu nesses casos maior redução da tensão supercial por saponificação de gorduras e um maior porcentual de cloro remanescente após o processo de dissolução respectivamente.
1.3. A adição de tensoativo reduziu a velocidade de dissolução pulpar e promoveu nesses casos uma ligeira elevação da tensão supercial, interrompendo o processo de saponificação de gorduras, além de reduzir o porcentual de cloro remanescente, após o processo de dissolução do tecido pulpar.
4.2. As soluções sem tensoativo apresentaram redução da tensão superficial e, as soluções com tensoativo, elevação.
4.3. Quanto maior a redução da tensão superficial tanto maior a velocidade de dissolução do tecido pulpar o que indica a maior freqüência da reação de saponificação, que parece ser mais rápida que as demais, nesse processo.
5.2. Quanto menor o teor de cloro remanescente tanto menor a velocidade de dissolução do tecido pulpar, o que sugere que nas soluções menos concentradas a reação de formação de cloraminas, que parece ser mais lenta que as demais, é a mais freqüênte.
ABOU-RASS, M.; OGLESBY, S. W. The effects of temperature, concentration and tissue type on the solvent ability of sodium hypochlorite. J Endod, v. 7, n. 8, p. 376-377, Aug. 1981.
ABOU-RASS, M.; PICCININO, M. V. The effectiveness of four clinical irrigation methods on the removal of root canal debris. Oral Surg Oral Med Oral Pathol, v. 54, n. 3, p. 323-328, Sept. 1982.
ANDERSEN, M.; LUND, A.; ANDREASEN, J. O.; ANDREASEN, F. M. In vitro solubility of human pulp tissue in calcium hydroxide and sodium-hypochlorite. J Endod, v. 8, n. 3, p. 104-108, Jun. 1992.
BARBOSA, S. V.; SAFAVI, K. E.; SPÅNGBERG, L. S. W. Influence of sodium hupochlorite on the permeability and structure of cervical human dentine. Int Endod J, v. 27, p. 309-312, 1994.
BARRETT, M. T. The Dakin-Carrel antiseptic solution. Dent Cosmos, v. 59, n. 44, p. 446-448, Apr. 1917.
CALLAHAN, J. R. Sulfuric acid for opening root-canals. Dent Cosmos, v. 36, n. 12, p. 957-959, Dec. 1894.
CHEUNG, G. S. P.; STOCK, C. J. R. In vitro cleaning ability of root canal irrigants with and without endosonics. Int Endod J, v. 26, p. 334-343, 1993.
COOLIDGE, E. D. Studies of germicides for the treatment of root canals. J Am Dent Assoc, v. 16, n. 4, p. 698-712, Aug. 1929.
CUNNINGHAN, W. T.; BALEKJIAN, A. Y. Effect of temperature on collagen-dissolving ability of sodiun hypochlorite endodontic irrigant. Oral Surg Oral Med Oral Pathol, v. 49, n. 2, 175-177, 1980.
CUNNINGHAN, W. T.; JOSEPH, S. W. Effect of temperature on the bactericidal action of sodium hupochlorite endodontic irrigant. Oral Surg Oral Med Oral Pathol, v. 50, n. 6, p. 569-571, Dec. 1980.
DAKIN, H. D. On the use of certain antiseptic substances in the treatment of infected wounds. Brit Med J, v. 2, p. 318-320, 1915.
DEUS, Q. D. de Endodontia. 5°ed., Rio de Janeiro, Medsi, 1992.
FILGUEIRAS, J.; BEVILLAQUA, S.; MELLO, C. F. Endodontia Clínica. Rio de Janeiro, Ed. Científica, 1962. p. 268-9.
FOGEL, H. M.; PASHLEY, D. H. Dentin permeability: effects of endodontic procedures on root slabs. J Endod, v. 16, n. 9, p. 442-445, Sept. 1990.
GAMBARINI, G.; DE LUCA, M.; GEROSA, R. Chemical stability of heated sodium hypochlorite endodontic irrigants. J Endod, v. 24, n. 6, p. 432-434, June 1998.
GORDON, T. M.; DAMATO, D.; CHRISTNER, P. Solvent effect of various dilutions of sodium hypochlorite on vital and necrotic tissue. J Endod, v. 7, n. 10, p. 466-469, Oct. 1981.
GROSSMAN, L. I. Irrigation of root canals. J Am Dent Assoc, v. 30, n. 13, p. 1915-1917, Dec. 1943.
GROSSMAN, L. I. Endodontic treatment of pulpless teeth. J Am Dent Assoc, v. 61, n. 6, p. 671-676, Dec. 1960.
GROSSMAN, L. I.; MEIMAN, B. W. Solution of pulp tissue by chemical agents. J Am Dent Assoc, v. 28, n. 2, p. 223-225, Feb. 1941.
GUERISOLI, D. M. Z.; SOUSA NETO, M. D.; PÉCORA, J. D. Ação do hipoclorito de sódio em diversas concentrações sobre a estrutura dentinária. Rev Odont UNAERP, v. 1, n. 1, p. 7-11, 1998.
GUERISOLI, J. D. Avaliação das propriedades físico-químicas das soluções de hipoclorito de sódio em diferentes concentrações, puras e associadas com tensoativo aniônico. Braz Endod J, em publicação.
HAND, R. E.; SMITH, M. L.; HARRISON, J. W. Analysis of the effect of dilution on the necrotic tissue dissolution property of sodium hypochlorite. J Endod, v. 4, n. 2, p. 60-64, Feb. 1978.
HARLAN, A.W. Pulp-digston. Dent Cosmos, v. 42, n. 12, p. 1272-1274, Dec. 1900.
HASSELGREN, G.; OLSSON, B.; CVEC, M. Effects of calcium hydroxide and sodium-hypochlorite on the dissolution of necrotic porcine muscle-tissue. J Endod, v. 14, n. 3, p. 125-127, Mar. 1988.
INGLE, J. I.; ZELDOW, B. J. An evaluation of mechanical instrumentation and negative culture in endodontic therapy. J Am Dent Assoc, v. 57, n. 4, p. 471-476, Oct. 1958.
JOHNSON, B. R.; REMEIKIS, N. A. Effective shelf-life of prepared sodium hypochlorite solution. J Endod, v. 19, n. 1, p. 40-43, Jan. 1993.
KIRK, E. C. Sodium peroxid. A new dental bleaching agent and antiseptic. Dent Cosmos, v. 35, n. 2, p. 192-198, Feb. 1893.
KOSKINEN, K. P.; MEURMAN, J. H.; STENVALL, H. Appearance of chemically treated root canal walls in the scanning electron microscope. Scand J Dent Res, v. 88, n. 5, p. 397-405, Oct. 1980 a.
KOSKINEN, K. P.; STENVALL, H.; UITTO, V. J. Dissolution of bovine pulp tissue by endodontic solutions. Scand J Dent Res, v. 88, n. 5, p. 406-411, 1980 b.
LAGE, T. C.; FONSECA, G. A. Soluções irrigadoras mais comumente usadas em Endodontia. Rev. Bras. Odont., v. 6, p. 31-396, 1980.
LEONARDO, M. R. Avaliação comparativa dos efeitos de doluções irrigadoreas utilizadas durante o preparo biomecâncio dos canis radiculares. Rev Fac Far Odont Araraquara, v.2, n. 1, p. 37-66, 1968.
LEONARDO, M. R.; LEAL, J. M. Endodontia: tratamento de canais radiculares. 3 ed., São Paulo, Panamericana, 1998.
MACHTOU, P. L’Irrigation en endodontie. Actual Odonto Stomatol, v. 34, n. 131, p. 387-394, Sept. 1980.
MARCHESAN, M. A.; SOUZA, R. A.; GUERISOLI, D. M. Z.; SILVA, R. S. Análise de algumas propriedades físico-químicas das águas sanitárias encontradas no mercado brasileiro. RBO, v. 55, n. 5, p. 301-303, set./out. 1998.
MARSHALL, F. J.; MASSLER, M.; DUTE, H. L. Effects of endodontic treatment of root dentine. Oral Surg Oral Med Oral Pathol., v. 13, n. 2, p. 208-223, Feb. 1960.
MARTIN, H.; SPRING, S. Quantitative bactericidal effectiveness of an old and a new endodontic irrigant. J Endod, v. 1, n. 5, p. 164-167, may 1975.
McCOMB, D.; SMITH, D. C. Comparison of physical properties of policarboxilate-based and conventional root canal sealers. J Endod, v. 2, n. 8, p. 228-235, 1976.
MILANO, N. F.; KOLLING, I. G.; FACHINNI, B. F. Tensão superficial de alguns auxiliares químicos usados em Endodontia. RGO, v. 31, n. 37-38, 1963.
MILANO, N. F.; GIRARDI, V.; BERGOLD, A. M.; CHIAPINI, L. G. Alguns aspectos do uso do hipoclorito de sódio em Endodontia. R Fac Odontol, v. 32, n. 1, p. 7-10, Jul. 1991.
MOORER, W. R.; WESSELINK, P. R. Factors promoting the tissue dissolving capability of sodium hypochlorite. Int Endodontic J, v. 15, n. 4, p. 187-196, Oct. 1982.
MORGAN, R. W.; CARNES, D. L.; MONTGOMERY, S. The solvent effects of calcium hydroxide irrigating solution on bovine pulp tissue. J Endod, v. 17, n. 4, p. 165-168, Apr. 1991.
NAKAMURA, H.; ASAI, K.; FUJITA, H.; NAKAZATO, H.; NISHIMURA, Y.; FURUSE, Y.; SAHASHI, E. The solvent action of sodium hypochlorite on bovine tendon collagen, bovine pulp, and bovine gingiva. Oral Surg Oral Med Oral Pathol, v. 60, n. 3, p. 322-326, Sept. 1985.
NAUMOVICH, D. B. Surface tension and pH of drugs in root canal therapy. Oral Surg, v. 16, p. 965-968, 1963.
NERY, M. J.; HOLLAND, R.; SOUZA, V. de Eficiência de diferentes técnicas de irrigação e soluções irrigadoras na remoção de detritos do interior dos canais radiculares. APCD, v. 3, n. 1, p. 21-27, 1982.
NICHOLLS, E. The efficacy of cleansing of the root canal. Br Dent J, v. 112, n. 4, p. 167-170, Feb. 1962.
PAIVA, J. G. Irrigação e aspiração em Endodontia. R G O, v. 7, n. 4, p. 162, 1959.
PAIVA, J. G.; ANTONIAZZI, J. H. Endodontia. Bases para a prática clínica. São Paulo, Artes médicas, 1988.
PÉCORA, J. D. Contribuição ao estudo da permeabilidade dentinária radicular. Apresentação de um método histoquímico e análise morfométrica. Ribeirão Preto, 1985, 110p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
PÉCORA, J. D.; MURGEL, C. A. F., COSTA, W. F.; CAPRIGLIONI, M.; VANSAN, L. P. Capacidade de umectação dos tensoativos (aniônicos, catiônicos e anfóteros) - teste in vitro. R B O, v. XLV, n. 1, p. 22-25, 1988.
PÉCORA, J. D.; GUIMARÃES, L. F.; SAVIOLI, R. N. Surface tension of several Drugs Used in Endodontics. Braz Dent J, v. 2, n. 2, p. 123-127, 1991.
PÉCORA, J. D.; SAVIOLI, R. N.; GUERISOLI, D. M. Z. Efeito da redução da tensão superficial das soluções de hipoclorito de sódio em diferentes concentrações, sobre a limpeza dos canais radiculares. Em andamento.
PEREZ, F.; CALAS, P.; ROCHD, T. Effect of dentin treatment on in vitro root tubule bacterial invasion. Oral Surg Oral Med Oral Pathol, v 82, n. 4, p. 446-451, Oct. 1996.
PUCCI, F. M. Conductos Radiculares. Montevideo, Barreiro Y Ramos, 1945.
ROBAZZA, C. R. C. Contribuição in vitro da permeabilidade dentinária radicular quando do emprego de algumas substâncias de uso endodôntico. Ribeirão Preto, 1973, Tese (Doutorado) Faculdade de Odontologia e Farmácia de Ribeirão Preto, Universidade de São Paulo.
ROSENFELD, E. F.; JAMES, G. A.; BURCH, B. S. Vital pulp tissue response to sodium hypochlorite. J Endod, v. 4, n. 5, p. 140-146, may 1978.
SAVIOLI, R. N.; COSTA, W. F.; SAQUY, P. C.; ANTONIAZZI, J. H.; PÉCORA, J. D. Estudo comparativo entre o hipoclorito de sódio e o ácido cítrico na capacidade de limpeza do canal radicular. Rev Odonto USP, v. 7, n. 4, p. 273-277, out./dez. 1993.
SCHILDER, H. Cleaning and shaping the root canal. Dent Clin North Am, v. 18, n. 2, p. 269-296, Apr. 1974.
SCHREIER, E. The treatment of infected root-canals with kalium and natrium. Dent Cosmos, v. 35, n. 9, p. 863-869, Sept. 1893.
SENIA, E. S.; MARSHALL F. J.; ROSEN, S. The solvent action of sodiun hypochlorite on pulp tissue of extracted teeth. Oral Surg Oral Med Oral Pathol, v. 31, n. 1, p. 96-103, Jan. 1971.
SHIH, M.; MARSHALL, F. J.; ROSEN, S. The bactericidal efficiency of NaOCl as an endodontic irrigant. Oral Surg Oral Med Oral Pathol, v. 29, n. 4, p. 613-617, Apr. 1970.
SÓ, M. V.; CEMIM, A.; PEREIRA, E. P.; IRALA, L. E. D. Tissue dissolution ability of sodium hypochlorite from different manucacturers. Bras Endod J, v. 2, n. 2, p. 33-35, 1997.
SPANÓ, J. C. E. Estudo in vitro das propriedades físico-químicas das soluções de hipoclorito de sódio, em diferentes concentrações, antes a após a dissolução de tecido pulpar bovino. Ribeirão Preto, 1999, 96p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
STEWART, G. G. The importance of chemomechanical preparation of the root canal. Oral Surg Oral Med Oral Pathol, v. 8, n. 9, p. 993-997, Sept. 1955.
STEWART, G. G.; KAPSIMALS, P.; RAPPAPORT, H. EDTA and urea peroxide for root canal preparation. J Am Dent Assoc, v. 78, n. 2, p. 335-338, 1969.
STRINDBERG, L. S. - Comparison between root canal cleansing with sulphuric acid or cetyl-pyridine chloride (Biosept). Swenst Tandläk, 49 (7): 373-86, 1956.
SVEC, A. T.; HARRISON, J. W. The effect of effervescence on debridement of the apical regions of root canals in single-rooted teeth. J Endod, v. 7, n. 7, p. 335-339, Jul. 1981.
TAYLOR, H. D.; AUSTIN, J. H. The solvent action of antisseptics on necrotic tissue. The Journal of Experimental Medicine, v. 27, p. 155-164, 1918.
THÉ, S. D. The solvent action of sodium hupochlorite on fixed and unfixed necrotic tissue. Oral Surg Oral Med Oral Pathol, v. 47, n. 6, p. 558-561, 1979.
THÉ, S. D.; MALTHA, J. C.; PLASSCHAERT, A. J. M. Reactions of guinea pig subcutaneous connective tissue following exposure to sodium hypochlorite. Oral Surg Oral Med Oral Pathol, v. 49, n. 5, p. 460-466, May 1980.
TREPAGNIER, C. M.; MADDEN, R. M.; LAZZARI, E. P. Quantitative study of sodium hypochlorite as an in vitro endodontic irrigant. JEndod, v. 3, n. 5, p. 194-196, May 1977.
TÜRKÜN, M.; GENGIZ, T. The effects of sodium hypochlorite and calcium hydroxide on tissue dissolution and root canal cleanliness. Int Endod J, v. 30, p. 335-342, 1997.
VARELLA, J. A. F.; PAIVA, J. G. Manual de Endodontia. 2 ed., São Paulo, Atheneu, 1969.
WADACHI, R.; ARAKI, K.; SUDA, H. Effect of calcium hydroxide on the dissolution of soft tissue on the root canal wall. J Endod, v. 24, n. 5, p. 326-330, May 1998.
WALKER, A. A definite and dependable therapy for pulpless teeth. J Am Dent Assoc., v. 23, n. 2, p. 1418-25, Aug. 1936.
WEINE, F. S. Endodontic therapy. 2° ed., St Louis, CV Mosby, 1976.
WENNBERG, A. Biological evaluation of root canal antiseptics using in vitro and in vivo methods. Scand J Dent Res, v. 88, n. 1, p. 46-56, Feb. 1980.
YANG, S.F.;
RIVERA, E.M.; BAUMGARDNER, K.R.; WALTON, R.E.; STANFORD, C.: Anaerobic
tissue-dissolving abilities of calcium hidroxide and sodium
hipochlorite.
J
Endod, v. 21, n. 12, p. 613-616, dec. 1995.