Unidades Métricas Correlacionadas à Temperatura
de Prof. Dr. Jesus Djalma Pécora e Ricardo Gariba Silva
com a colaboração de Alexandre Capelli;
Desirée Dumont Adams S. Souza;
Eduardo Luiz Barbin e Júlio
César Emboava Spanó.
Formato para Impressão e Leitura Off-Line.
1 Introdução
Temperatura, uma palavra derivada do Latin, reconhecida cognitivamente como o nível de calor que existe no ambiente, resultante, por exemplo, da ação dos raios solares ou nível de calor existente num corpo. A temperatura é explicada pela Física como a grandeza termodinâmica intensiva comum a todos os corpos que estão em equilíbrio térmico. São vários os conceitos da Física correlacionados com a temperatura, tais como:
=> Temperatura absoluta: a que não depende de medida nem da substância ou propriedade utilizada para medi-la, e que usualmente é medida na escala Kelvin cujo símbolo é "T";
=> Temperatura centígrada, temperatura Celsius ou temperatura centesimal: a que é medida na escala centígrada;
=> Temperatura crítica: temperatura acima da qual um gás real não pode ser liquefeito por compressão isotérmica;
=> Temperatura basal (Fisiologia): temperatura do corpo, estando este em repouso absoluto;
=> Temperatura Curie: temperatura acima da qual uma substância ferromagnética perde o ferromagnetismo e passa a paramagnética;
=> Temperatura de cor: temperatura que se determina pela comparação entre a energia irradiada por um corpo num certo comprimento de onda (ou numa faixa de comprimentos de onda) e a energia irradiada por um corpo negro no mesmo comprimento de onda (ou na mesma faixa de comprimentos de onda);
=> Temperatura efetiva: temperatura igual à de um corpo negro que emitiu para o conjunto de todos os comprimentos de onda um fluxo total igual ao do corpo considerado;
=> Temperatura internacional: a que é medida na escala internacional de temperatura;
=> Temperatura Kelvin: temperatura absoluta medida na escala Kelvin;
=> Temperatura reduzida: o quociente da temperatura absoluta de um gás pela sua temperatura crítica;
=> Temperatura termodinâmica: num sistema isolado, a derivada parcial da energia interna pela entropia.
De forma qualitativa, podemos descrevê-la de um objeto como aquela que determina a sensação de quanto ele está quente ou frio quando entramos em contato com ele.
É fácil mostrar que quando dois objetos são postos em contato (dizemos que eles estão em contato térmico), o objeto que possui temperatura maior esfria, enquanto que o objeto que possui temperatura menor esquenta, até um ponto em que não ocorrem mais mudanças e, para os nossos sentidos, eles parecem possuir a mesma temperatura. Quando as mudanças térmicas terminam, dizemos que os dois objetos (sistemas) estão em equilíbrio térmico.
Podemos então definir temperatura como uma quantidade que é a mesma para ambos os sistemas, se eles estão em equilíbrio térmico.
Se fizermos experiências com mais de dois sistemas, encontraremos que muitos sistemas podem ser colocados em equilíbrio térmico entre si. Ou seja, o equilíbrio térmico não depende do tipo de objeto utilizado.
Ou, mais precisamente, se dois sistemas estão separadamente em equilíbrio térmico com um terceiro, então eles também devem estar em equilíbrio térmico entre si, e eles todos possuem mesmo valor de temperatura independentemente do tipo de sistemas que eles forem.
A sentença, logo abaixo, é chamada de Lei Zero da Termodinâmica, e pode ser reconstruída na forma:
"Se três ou mais sistemas estiverem em contato térmico
entre si,
e se todos estiverem em equilíbrio em conjunto,
então qualquer dois deles separadamente estão em
equilíbrio térmico entre si."
Qualquer um dos três sistemas pode ser utilizado para calibrar a medida da temperatura, ou seja, usado como um termômetro.
Quando um termômetro calibrado é posto em contato com um sistema e alcança equilíbrio térmico, temos então uma medida quantitativa da temperatura do sistema.
Por exemplo, um termômetro clínico de mercúrio em vidro é posto em contato sob a língua de um paciente e se espera até o momento em que ele chegue a um equilíbrio térmico com a boca do paciente - observamos então quanto o mercúrio expandiu no tubo e lemos a escala do termômetro para achar a temperatura do paciente.
Um termômetro é um instrumento que mede quantitativamente a temperatura de um sistema.
A maneira mais fácil de se fazer isso é achar uma substância que possua uma propriedade que se modifica de modo regular com tal temperatura.
A forma direta mais 'regular' é a forma linear: t(x) = ax + b, onde "t" é a temperatura da substância utilizada e muda com a propriedade "x" da substância.
As constantes "a" e "b" dependem da substância utilizada e podem ser calculadas especificando dois pontos na escala de temperatura, tais como: zero grau para o ponto de congelamento da água e 100 graus para o seu ponto de ebulição.
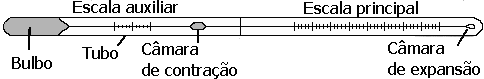
Por exemplo, o elemento mercúrio (o único metal líquido em baixas temperaturas) é líquido no intervalo de temperatura de - 38.9ºC a 356.7ºC. Como todo líquido, o mercúrio expande à medida que ele é aquecido. Sua expansão é linear e pode ser calibrada com precisão. A Figura 3.1 ilustra esquematicamente um termômetro de mercúrio em um tubo de vidro.

Figura 3.1 Ilustração esquemática de um termômetro de mercúrio em um tubo de vidro.
Pode-se observar na Figura 3.1 que o termômetro possui um bulbo cheio de mercúrio, que é permitido expandir em um tubo capilar (tubo muito fino). A sua taxa de expansão é calibrada na escala de vidro.
4 Escalas de temperatura
Os primeiros termômetros surgiram na idade média, e eram chamados de termoscópios. Eles consistiam de um bulbo contendo um tubo longo com um extremo mergulhado em água colorida (vinho era muito utilizado). Um pouco do ar no tubo era expulso antes de colocar o líquido. Isto fazia com que o líquido subisse no tubo. Quando o ar restante no tubo e no bulbo era aquecido ou esfriado, o nível do líquido no tubo variava, refletindo uma mudança no valor da temperatura do ar. Uma escala no tubo permitia que uma medida quantitativa dessas flutuações fosse feita (Figura 4.1).
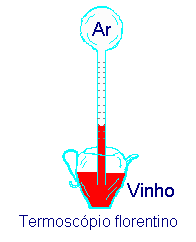
Figura 4.1. Modelo esquemática de um Termoscópio.
Em 1702, o astrônomo Ole Roemer de Copenhagen utilizou dois pontos fixos em sua escala: gelo e água em ebulição.
Em 1724 Gabriel Fahrenheit, um consertador de instrumentos em Danzig e Amsterdam usaram o mercúrio como líquido de termômetro.
A expansão térmica do mercúrio é grande e uniforme. Ele não adere ao vidro, e permanece líquido em um grande intervalo de temperaturas. Sua aparência metálica facilita a leitura.
Na escala usada por Fahrenheit o ponto de ebulição da água foi definido como 212. E o ponto de congelamento da água foi calibrado em 32, de modo que o intervalo entre os dois pontos pudesse ser representado pelo número 180.
As temperaturas medidas nessa escala são chamadas de grau Fahrenheit (ºF).
Em 1745, Carolus Linnaeus de Upsala, Suécia, descreveu uma escala em que o ponto de congelamento da água era zero e o ponto de ebulição 100, definindo a escala do centígrada (passo de cem).
Anders Celsius (1701-1744) usou a escala contrária em que zero representa o ponto de ebulição da água e 100 o seu ponto de congelamento. Novamente, com 100 graus entre os dois pontos de definição.
Em 1948 o uso da escala de Centígrada foi trocado pelo uso de uma nova escala de graus Celsius (ºC). A escala Celsius é definida pelos seguintes dois itens, que discutiremos posteriormente:
=> o ponto triplo da água é definido como 0.01°C
=> um grau Celsius é igual à mesma mudança de temperatura que um grau numa escala de gás ideal.
Na escala Celsius o ponto de ebulição da água nas condições normais de pressão atmosférica é 99.975 ºC, em contraste com os 100 graus definidos pela escala do Centígrada.
Para converter da escala Celsius para a Fahrenheit, deve-se multiplicar o valor em graus Celsius por 1,8 e somar 32, ou seja: TºF = TºC . 1,8 + 32.
Em 1780, J. A. C. Charles, um médico Francês, mostrou que para o mesmo aumento de temperatura, todos os gases exibem o mesmo aumento de volume.
Como o coeficiente de expansão dos gases é aproximadamente o mesmo, é possível estabelecer uma escala de temperatura baseada em um ponto fixo simples, em vez de uma escala com dois pontos fixos, como as escalas Fahrenheit e Celsius. A Figura 4.2 ilustra um Termômetro de gás a volume constante.
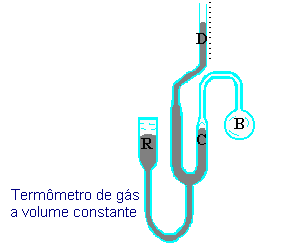
Figura 4.2 Termômetro de gás a volume constante.
Em um termômetro de gás a volume constante, um grande bulbo de gás "B", por exemplo, hidrogênio, sob uma dada pressão é conectado a um manômetro de mercúrio por meio de um tubo de volume muito pequeno. (O bulbo "B" é a parte sensível á temperatura e deve conter a maior parte do hidrogênio). O nível de mercúrio em "C" deve ser ajustado subindo, ou abaixando, o reservatório de mercúrio "R".
A pressão do gás de hidrogênio, que é a variável "x" na relação linear com a temperatura, é dado pela diferença entre os níveis "D" e "C" mais a pressão acima de "D".
Observa-se experimentalmente que existe pouca diferença nas escalas de temperatura para gases diferentes a pequenas pressões. Nessas condições, todos os gases se comportam como gases perfeitos, obedecendo a relação: Pv = constante. T ."...VERIFICAR...!!!".
Esta temperatura é conhecida como temperatura termodinâmica e é hoje aceita como uma medida fundamental da temperatura. Note que existe um zero natural nessa escala - é o ponto em que a pressão do gás ideal é zero. Logo, apenas um outro ponto precisa ser definido. Este foi definido pelo Comitê Internacional de Pesos e Medidas como sendo o ponto triplo da água (o ponto em que a água, o gelo e o vapor de água coexistem em equilíbrio).
Seu valor foi tomado como 273,16. A unidade de temperatura nessa escala é chamada de Kelvin, e o seu símbolo é o K. As medidas de temperatura na escala Kelvin não são utilizadas com o símbolo de grau). Uma "célula" de ponto triplo é mostrada na Figura 4.3.
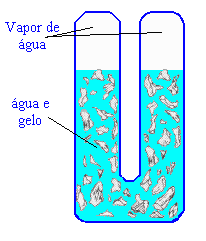
Figura 4.3. Célula de ponto triplo da água.
A célula é resfriada até que a água, gelo, e vapor de água estejam em equilíbrio; a temperatura é 273,16 K por definição; e um termômetro pode ser calibrado inserindo-o no tubo central.
Para converter valores de temperatura de graus Celsius para Kelvin, é necessário somar 273 ao valor em graus Celsius: TK =TºC + 273.
A temperatura termodinâmica é a temperatura fundamental; sua unidade é o Kelvin que é definido como a fração 1/273,16 da temperatura termodinâmica do ponto triplo da água. A Tabela 3.1 compara as escalas de temperatura.
Tabela 4.1. Comparações entre as escalas de temperatura.
|
Estados da Água |
oC |
K |
oF |
|
Água em ebulição |
100 |
373 |
212 |
|
Água congelada |
0 |
273 |
32 |
|
Zero absoluto |
-273 |
0 |
-459 |
5 Que é calor?
"O calor consiste nos
diminutos movimentos
das partículas de um corpo.
(Newton)"
Calor é a energia cinética das moléculas. Você pode produzir calor de vários modos. Dobre um pedaço de ferro para um lado o para o outro varias vezes. Você produzirá calor. Risque um fósforo. Enquanto ele se queima, a energia química da madeira se transformará em calor. Faça uma corrente elétrica passar pelo filamento de uma lâmpada. As cargas elétricas, movendo-se por entre os átomos do metal, produzirão calor.
6 Temperatura e energia cinética:
Suponha que você pudesse ver as moléculas (ou átomos) de um bloco de ferro. Você observaria que cada molécula vibra, ou se move para um lado e para o outro, de modo muito desordenado, porém, se você adicionasse calor ao ferro, aumentando sua temperatura, você faria suas moléculas vibrar mais violentamente e assim lhes adicionaria energia cinética. Se você esfriasse o ferro cada vez mais, suas moléculas se agitariam menos. Finalmente, á temperatura mais baixa possível (zero absoluto) elas vibrariam muito pouco. Aumentando a temperatura, de um corpo, você aumentará a energia cinética (média) de suas moléculas. A Tabela 6.1 ilustra esquematicamente o estado de agitação molecular em função da temperatura.
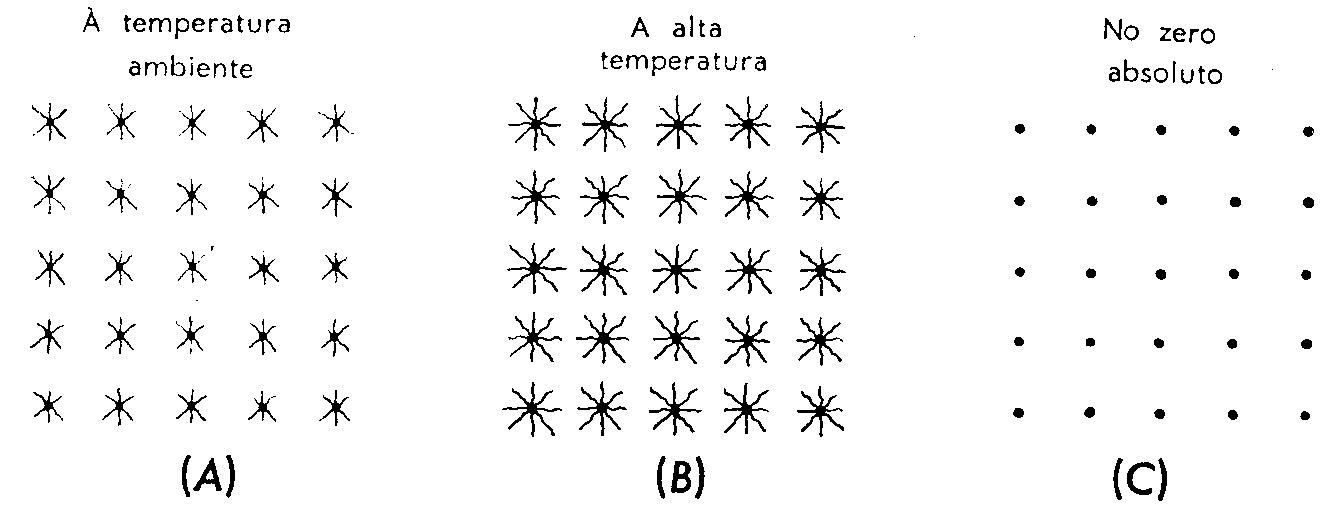
Tabela 6.1 Ilustração esquemática do estado de agitação molecular segundo em função da temperatura.
Uma representação ampliada dos átomos do ferro. (A) á temperatura ambiente eles vibram com certa intensidade. (B) á temperatura mais alta eles vibram mais vigorosamente. (C) á temperatura mais baixa possível (zero absoluto) eles vibram muito pouco. As moléculas têm maior energia cinética quando a temperatura é mais alta.
O conceito físico de temperatura está associado ao conceito de equilíbrio térmico. Um sistema mecânico tem muitas configurações possíveis, dependendo da distribuição de energia de seus subsistemas.
Dentre estas configurações, existe aquela mais provável, em que todos os subsistemas estão em equilíbrio térmico, e que pode ser calculada com as técnicas da mecânica estatística.
Como o assunto envolve resultados de tratamento detalhados de muitos campos da física, aqui simplesmente citaremos os resultados, e justificaremos com argumentos qualitativos, deixando a demonstração para textos especializados.
Em um sistema clássico, as partículas se movem em trajetórias definidas, de modo que podemos, em princípio, distinguir entre as partículas, mesmo idênticas, isto é, podemos colocar rótulos de partícula 1, partícula 2, ... em uma descrição quântica isto não pode ser feito porque o Princípio da Incerteza de Heisenberg, que rendeu o prêmio Nobel em física de 1932 ao físico alemão Werner Karl Heisenberg (1901-1976), não permite a contínua observação do movimento das partículas, sem mudar o comportamento do sistema. Isto é equivalente a dizer que, em mecânica quântica, que descreve as partículas como ondas tridimensionais, onde a função de onda associada a cada partícula não é pontual e dá a probabilidade de se encontrar a partícula em uma posição, a superposição desta função de onda torna impossível a distinção entre as partículas. Portanto, em uma descrição quântica, as partículas idênticas são indistinguíveis.
Partículas descritas por autofunções assimétricas têm spin semi-inteiro, e são chamadas de férmions, em honra ao físico ítalo-americano Enrico Fermi (1901-1954), e estão sujeitas ao Princípio da Exclusão, elaborado pelo físico austríaco Wolfgang Pauli (1900-1958), e que lhe rendeu o prêmio Nobel em 1945: duas partículas de mesmo spin não podem ocupar o mesmo estado quântico.
As partículas de Bose, ou bósons, em honra ao físico indiano Satyendra Nath Bose (1894-1974), têm spin inteiro, e embora indistinguíveis, não estão sujeitas ao Princípio da Exclusão, porque têm autofunções simétricas (spin inteiros), que não se anula se todos os números quânticos de duas ou mais partículas forem idênticos.
|
Edição |
Atualização |
|
WebMasters do Laboratório de Pesquisa em Endodontia da FORP-USP: Eduardo Luiz Barbin Júlio César Emboava Spanó Jesus Djalma Pécora |
13/07/05 |