Análise in vitro da Proliferação Celular de Fibroblastos de Gengiva Humana Tratados com Laser de Baixa Potência.

Análise in vitro da Proliferação Celular de Fibroblastos de Gengiva Humana Tratados com Laser de Baixa Potência.

| Luciana
Almeida-Lopes
Dissertação apresentada ao Instituto de Pesquisa e Desenvolvimento da Universidade Vale do Paraíba como parte dos requisitos para obtenção do título de Mestre em Ciências, do Curso de Pós-Graduação em Engenharia Biomédica. Orientador:Prof. Dr. Renato Amaro Zângaro Co-orientador :Prof. Dr. João Guidugli Neto São José dos Campos, SP, 1999 |
|
|
O laser operando com baixa potência tem sido utilizado em tratamentos médicos e odontológicos visando sua ação terapêutica sobre os diferentes tecidos biológicos. Esse tipo de laser tem sido estudado desde a década de 60, principalmente por seus efeitos na reparação tecidual, melhorando a regeneração e cicatrização de tecidos.
A cicatrização tecidual, por sua vez, é um processo complexo que envolve atividade local e sistêmica do organismo, sendo os fibroblastos uma das células diretamente envolvidas nesse complexo processo. A ação terapêutica do laser na cicatrização também é bastante complexa, induzindo efeitos locais e sistêmicos; trófico-regenerativos, antiinflamatórios e antiálgicos. Estes efeitos foram demonstrados em estudos "in vitro" e "in vivo", destacando-se trabalhos que enfatizam o aumento da microcirculação local, ativação do sistema linfático, proliferação de células epiteliais e de fibroblastos, assim como o aumento da síntese de colágeno por parte desses últimos.
Desenvolvemos
uma linhagem de fibroblastos de gengiva humana, propondo dois modelos de
estudo "in vitro" onde trabalhamos com fibroblastos em condição
de déficit nutricional parcial (meio de cultivo com 5% de soro fetal
bovino) e em condição de déficit nutricional total
(meio sem soro fetal bovino), simulando duas situações de
estresse, já que os dados da literatura nos mostram que esse tipo
de laser não age em células e tecidos em homeostase. Verificamos
que o primeiro modelo é o ideal para se trabalhar com essas células.
Analisamos a proliferação celular nessa linhagem por meio
da contagem do número de células existentes antes e depois
de receberem irradiação com diodos lasers operando em diferentes
comprimentos de onda. Verificamos que quando as células receberam
irradiação com mesma irradiância e fluência o
comprimento de onda que induziu maior proliferação celular
foi aquele situado na região do visível. No caso onde se
manteve mesma fluência mas diferente irradiância, o melhor
resultado foi obtido com radiação no infravermelho. Em ambos
os casos os grupos irradiados apresentaram proliferação significativamente
maior nos grupos irradiados quando comparados ao controle.
The Low Level Laser Therapy (LLLT) has been used in medicine and dentistry due to its therapeutical action on the different biological tissues. The use of LLLT has been studied since 60’s mainly to improve wound healing, in order to get the healing better besides scarring of soft tissues.
Wound healing is a very complex involving-process local and systemic body activity, and fibroblasts are considered one of the most important cells on healing to be directly involved in this process. The LLLT action in wound healing is so complex, induced by local and systemic effects: several studies have shown that laser light can have healing, anti-inflammatory and analgesic effects both "in vitro" and "in vivo" studies. Those were also associated for increasing the local circulation, the effects on the lymphatic system, the proliferation of epithelial cell and fibroblasts and also for improving collagen production.
We
developed a primary culture of human gingival fibroblasts proposing two
study models "in vitro" with fibroblasts, the former with partial and the
latter with total decreased nutritional condition in order to simulate
a stress situation, due the literature has showed us that the LLLT doesn’t
act in cells and tissues in homeostasis. We verified that the former is
more appropriated for this kind of studies. It was analysed the cellular
proliferation on this primary culture by counting of the cell number that
had existed after and before the irradiation with different wavelength.
We had observed that cells irradiated by the same irradiance and fluence
presented higher proliferation when by receiving visible laser light. In
case where the cells received the same fluence but different irradiance,
the best results were obtained with infrared laser. In both irradiated
groups, the cells proliferation was bigger than non-irradiated ones.
A palavra laser é um acrônimo com origem na língua inglesa: Light Amplification by Stimulated Emission of Radiation (Amplificação de Luz por Emissão Estimulada de Radiação). Esta radiação é eletromagnética não ionizante, sendo um tipo de fonte luminosa com características bastante distintas daquelas de uma luz fluorescente ou de uma lâmpada comum.
A radiação laser é monocromática, ou seja, emite radiações em um único comprimento de onda. É uma radiação com coerência espacial e temporal onde as ondas propagam-se com a mesma fase no espaço e no tempo. Sua direcionalidade permite a obtenção de alta densidade de energia concentrada em pequenos pontos. Com o auxílio de dispositivos ópticos, sua radiação pode ainda ser polarizada.
São justamente as características especiais desse tipo de luz que a faz ter propriedades terapêuticas importantes (Laser de Baixa Potência ou Terapêutico) assim como ser utilizada em cirurgias com vantagens muito superiores ao uso do bisturi convencional (Laser de Alta Potência ou Cirúrgico). As radiações ópticas produzidas por esses lasers têm basicamente as mesmas características, porém se trabalha com o laser buscando resultados clínicos bastante específicos.
A célula tem um limiar de sobrevivência, segundo o tecido onde ela está localizada e segundo seu estado fisiológico. Quando trabalhamos respeitando esse limiar de determinada célula, lhe oferecemos uma baixa intensidade de energia, que será utilizada por ela de maneira que irá estimular sua membrana, ou suas mitocôndrias. Dessa forma estaremos induzindo essa célula à biomodulação, ou seja, ela trabalhará buscando um estado de normalização da região afetada, isso denomina-se Laser Terapia. Sua principal indicação são todos os quadros patológicos onde se gostaria lograr melhor qualidade e maior rapidez do processo reparacional (quadros de pós-operatório, reparação de tecido mole, ósseo e nervoso), quadros de edema instalado (onde se busca uma mediação do processo inflamatório), ou nos quadros de dor (crônicas e agudas). Quando, ao contrário, se oferece uma densidade tão alta de energia a ponto dessa energia transformar-se em dano térmico e ultrapassar o limiar de sobrevivência dessa célula, estaremos utilizando o laser com finalidade cirúrgica, e à isso denominamos Laser Cirurgia.
O comprimento de onda é fator determinante na interação laser-tecido. Corresponde à distância percorrida pela onda em uma oscilação completa. sendo medida em nanometros (nm) e a freqüência de suas oscilações em Hertz (Hz). O comprimento de onda pode variar desde o infravermelho distante até os raios cósmicos e segundo seu meio ativo, onde é gerada a radiação. É o meio ativo, em geral, que dá o nome ao laser determinando sua pureza espectral e seu comprimento de onda, conferindo características diferentes de emissão e de possível ação biológica.
A radiação laser pode ser refletida, transmitida, absorvida ou espalhada (scattering) pelo tecido. A monocromaticidade do laser determina a absorção seletiva por parte dos cromóforos, com resposta afim a um ou a vários comprimentos de onda, fenômeno conhecido como ressonância à uma determinada freqüência. Cada comprimento de onda, portanto, terá um tipo diferente de interação segundo o tecido alvo.
A utilização do laser operando com baixa potência tem sido estudada desde os anos 60, sendo Mester (1966) um dos pioneiros em demonstrar seus efeitos na reparação tecidual.
Os efeitos terapêuticos dos lasers sobre os diferentes tecidos biológicos são muito amplos, ao induzir efeitos trófico-regenerativos, antiinflamatórios e analgésicos, os quais se têm demonstrado em estudos tanto in vitro como in vivo; destacando-se os trabalhos que demonstram um aumento na microcirculação local (MIRÓ et al., 1984; MAIER et al., 1990), no sistema linfático (LIEVENS, 1986; 1988; 1990; 1991), proliferação de células epiteliais (STEINLECHNER e DYSON, 1993) e fibroblastos (LUBART et al., 1995; WEBB et al., 1998; ALMEIDA-LOPES et al., 1998b) assim como aumento da síntese de colágeno dos fibroblastos (ENWEMEKA et al., 1990; SKINNER et al., 1996). Muitos estudos clínicos foram publicados (TRELLES et al., 1989a; BIHARI e MESTER, 1989; ROCHKIND et al., 1989; BAXTER, 1994; KAMEYA et al., 1995; TANG et al., 1997; REDDY et al., 1998) confirmando esses efeitos observados no laboratório.
Os estudos in vitro sobre fibroblastos descrevem um efeito proliferativo e/ou ativador da síntese protéica, dependendo das características e parâmetros do laser utilizado como: comprimento de onda, forma de emissão, densidade de potência e densidade de energia utilizadas. Muitos autores como ABERGEL et al., 1986; 1988; KARU, 1990; AL-Watban e ZHANG, 1994 entre outros (BALBONI et al., 1985; HALLMAN et al., 1988; SOUNDRY et al., 1988; MESTER e MESTER, 1989; POURREAU-SCHNEIDER et al., 1989; 1990; LOEVSCHALL et al., 1994; NOGUEROL et al., 1994; HALEVY et al., 1997) trabalharam in vitro com fibroblastos, principal célula responsável na reparação. Estes estudos se correlacionam com outros in vivo que mostraram efeitos, tal como a redução do tempo de cicatrização de feridas dentro do estrato cutâneo e de mucosas (ABERGEL, et al., 1988; TERRIBILE et al., 1992; TRELLES et al., 1989; BIHARI E MESTER, 1989; ROCHKIND et al., 1989; AL-WATBAN e ZHANG, 1994; HALEVY et al., 1997).
A reparação tecidual é um processo complexo que envolve atividade local e sistêmica do organismo, sendo os fibroblastos uma das células diretamente envolvidas nesse complexo processo.
A ação dos diferentes comprimentos de onda no metabolismo celular vem sendo estudada por diferentes autores. Já se sabe que a ação desses lasers variam segundo a posição que ocupam no espectro de radiações eletromagnéticas, e que a ação sobre as células é diferente para os comprimentos de onda infravermelhos e para os visíveis (KARU, 1988). Porém, a resposta clínica não varia intensamente.
O
objetivo deste trabalho é analisar o efeito, in vitro, dos
diodos laseres operando em 670, 780 e 786 nm sobre a proliferação
de fibroblastos de gengiva humana.
2.1.
Laser
2.1.1.
Introdução
Os laseres tiveram sua aplicação inicial no setor bélico, mas foram rapidamente introduzidos na área médica. As aplicações em oftalmologia e dermatologia foram as que incorporaram a tecnologia laser com maior rapidez.
Se a radiação de um laser de alta potência atingir um tecido alvo, dependendo do coeficiente de absorção deste tecido, ele poderá sofrer carbonização, vaporização, coagulação ou ainda simplesmente ter suas proteínas constituintes degradadas ou desnaturadas. O que essas reações têm em comum é o fato de que em todas elas a estrutura do tecido atingido é destruído ou alterado permanentemente. Além desses efeitos foto-térmicos, existem outros efeitos não dependentes de calor, os quais criam igualmente alterações irreversíveis ou destruição do tecido, que são os efeitos: foto-osmótico, foto-iônico, foto-enzimático e foto-imunológico (FULLER, 1983; OHSHIRO e CALDERHEAD, 1988), entre outros.
Quando o laser de alta potência, que neste trabalho tratamos como laser cirúrgico, começou a ser utilizado em Medicina, observou-se que os pacientes submetidos a esse tipo de cirurgia relatavam menor desconforto pós-operatório e os médicos usuários desse tipo de equipamento observavam menor quadro de edema pós-cirúrgico e melhor cicatrização tecidual quando comparado ao método de cirurgia convencional. Levantou-se então a suspeita de que o laser poderia ter algum outro efeito adicional até então desconhecido, até que OHSHIRO e CALDERHEAD, em 1991, propuseram chamar esse efeito de "Efeito X do Laser". Estes autores propuseram que a explicação para este efeito seria a distribuição espacial de energia gaussiana que a maioria dos laseres apresentam. A figura 2.1, exemplifica o perfil gaussiano de um feixe laser, sendo que o pico de energia concentra-se na região central do feixe, decrescendo gradualmente à medida que se aproxima da periferia. Ela representa também os efeitos típicos da interação laser-tecido biológico, evidenciando estes efeitos em função da variação da densidade de energia. Na região de interface entre a desnaturação protéica e a ativação foto-térmica a temperatura não ultrapassa 40°C. Na região correspondente à ativação foto-térmica haverá um aumento da temperatura, porém não suficiente para causar mudança estrutural macroscópica no tecido, devendo somente ativá-lo. Na zona mais afastada, temos uma região denominada não foto-térmica, mas que ainda assim pode sofrer ativação. Essas duas últimas zonas não mostram alteração macroscópica na estrutura tecidual (CALDERHEAD, 1998), ainda que os dados da literatura comprovem efeitos sobre o mesmo. Estes efeitos são conhecidos atualmente como "Terapia com Laser de Baixa Potência" ou "Laser Terapia" (OHSHIRO e CALDERHEAD, 1998), e podem ocorrer simultaneamente às reações foto-destrutivas do laser cirúrgico. OHSHIRO e CALDERHEAD, 1991, relatam este efeito como "Laserterapia Simultânea". Neste trabalho utilizamos a terminologia de "Efeito Residual do Laser Cirúrgico".
Tendo o efeito residual como ponto de partida, sistemas laseres foram desenvolvidos especialmente para este tipo de aplicação.
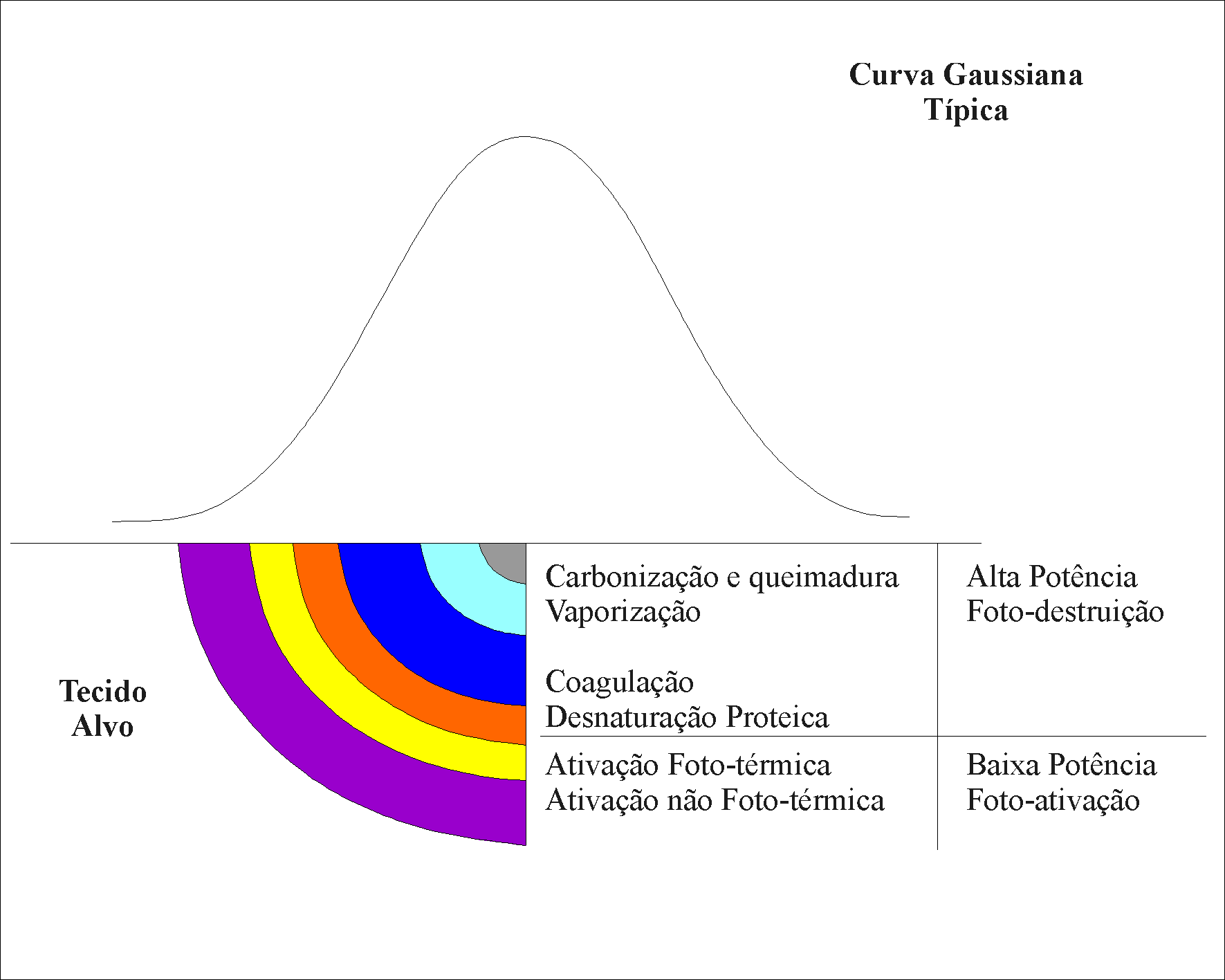
Figura 2.1: Perfil espacial gaussiano de um feixe laser e sua interação com o tecido, proposto por OHSHIRO e CALDERHEAD em 1988.
2.1.2. Aspectos Históricos
O primeiro laser da história foi construído em 1960 por Theodore maiman na Califórnia-USA (maiman, 1960), era um laser de Rubi, operando em 694,3 nm. Em 1961 foi fundado, na Universidade de Cincinnati por Leon Goldman, o primeiro laboratório de laser para aplicações médicas (GOLDMAN, 1981), onde as primeiras experiências em animais foram realizadas.
Em 1962 PATEL desenvolveu o primeiro laser com finalidade terapêutica, um Hélio-Neônio (He-Ne) com comprimento de onda de 632,8 nm (PÖNTINEN, 1992).
As primeiras aplicações clínicas com laser operando em baixa potência foram relatadas em 1966 por Endre Mester de Budapeste, Hungria, que apresentou os primeiros relatos de casos clínicos sobre "Bioestimulação com Laser" de úlceras crônicas de membros inferiores usando laseres de rubi e de argônio, tendo publicado seus primeiros artigos em 1966 (MESTER, 1966). Ele produziu um grande volume de trabalhos científicos, clínicos e experimentais, tendo o laser de He-Ne, como tema central.
Os laseres terapêuticos mais utilizados nas décadas de 70 e 80 foram os de He-Ne com emissão na região do visível. Nesta região do espectro eletromagnético, a radiação laser apresenta pequena penetração nos tecidos biológicos, o que limita a sua utilização. Para aplicação desse tipo de laser em lesões mais profundas, era necessário uma fibra óptica para guiar a radiação até o interior do corpo do paciente, limitando e contra-indicando muitas vezes esse tipo de terapia, por ser uma técnica invasiva. Outra limitação dos laseres de He-Ne era sua grande dimensão e também o fato de seu meio ativo estar contido por ampolas de vidro que poderiam romper-se facilmente, além do gás Hélio permear rapidamente a parede da ampola, reduzindo drasticamente o tempo de vida destes aparelhos.
Em 1973, seguindo a mesma linha de Mester, Heinrich Plogg de Fort Coulombe - Canadá, apresentou um trabalho sobre "O uso do laser em acupuntura sem agulhas", para atenuação de dores (BAXTER,1994). A partir do final dessa década começaram a ser desenvolvidos diodos laseres semicondutores, dando origem ao primeiro diodo operando na região do infravermelho próximo (l = 904nm), constituído de um cristal de Arsenieto de Gálio (As-Ga). As vantagens deste sobre o He-Ne é que, além da menor dimensão, apresenta maior penetração no tecido biológico. Outra vantagem é que este dispositivo pode operar de forma contínua ou pulsada, enquanto que o He-Ne só opera em modo contínuo. O efeito da foto-bioestimulação com laser pulsado foi tema de diferentes trabalhos, sendo que MORRONE et al., em 1998, demonstraram que para aplicações in vivo a radiação contínua apresenta melhores resultados que a radiação pulsada
Em 1981, apareceu pela primeira vez o relato da aplicação clínica de um diodo laser de As-Ga-Al, publicado por CALDERHEAD (1981), do Japão, que comparava a atenuação de dor promovida por um diodo laser e o laser de Nd:YAG, (Ytrio e Alumínio, dopado com Neodímio), operando em 1064 nm.
À partir dos anos 90, diferentes dopantes foram introduzidos na tecnologia para obtenção de diodos laser gerando uma larga faixa de comprimentos de onda, conforme pode ser observado na tabela 2.1. Com estes dispositivos hoje pode-se ter aparelhos pequenos, de fácil transporte e manuseio, com baixa freqüência de manutenção além do baixo custo.
Tabela 2.1: Diodos Laseres Semicondutores com diferentes hospedeiros e dopantes.
|
|
|
|
| Fosfeto arsenieto de gálio |
|
0.65
- 0.9
|
| Arsenieto de gálio e alumínio |
|
0.65
- 0.9
|
| Arsenieto de gálio |
|
0.9
|
| Fosfeto de índio |
|
0.91
|
| Antimonieto de gálio |
|
1.5
|
| Fosfeto arsenieto de índio |
|
1.6
|
| Arsenieto de gálio-índio |
|
1.8
- 2.1
|
| Fosfeto de gálio-índio |
|
0.76
|
| Arsenieto de índio |
|
3.1
|
| Arsenieto de antimônio-índio |
|
3.2
|
| Antimonieto de índio |
|
5.4
|
| Sulfeto de chumbo |
|
4.3
|
| Telureto de chumbo |
|
6.5
|
| Seleneto de chumbo |
|
8.5
|
| Telureto de chumbo |
|
6.5
– 30
|
| Seleneto de chumbo-estanho |
|
10
- 12
|
2.1.3. Aspectos Teóricos
2.1.3.1. Conceito de Irradiância e Fluência
Irradiância é o termo que os foto-biologistas usam como sinônimo para densidade de potência (DP), que é definida como sendo a potência óptica de saída do laser em Watts, dividida pela área irradiada em cm2. É através do controle da irradiância que o cirurgião pode cortar, vaporizar, coagular ou "soldar" o tecido, quando da utilização de laseres cirúrgicos. A densidade de potência apropriada pode também gerar foto-ativação com laser de baixa potência.
O outro fator sobre o qual o clínico tem controle é o tempo de exposição. Multiplicando a irradiância pelo tempo de exposição dado em segundos, pode-se obter a fluência ou densidade de energia (DE) em joules/cm2.
Para uma dada potência, a irradiância e a fluência podem produzir efeitos sobre o tecido biológico que podem ser nitidamente diferenciados. Por exemplo, um laser com potência de saída de 10 W, irradiando uma área de 10 cm2 (F = 3,5 cm), terá uma irradiância de 1 W/cm2. Se o tempo de exposição for igual a 10 minutos, a fluência será de 600 J/cm2, o que pode ser considerado como alta energia, causando inclusive dano no tecido alvo. Se o mesmo laser for focalizado sobre uma área de 8 cm2, (F = 0,4 mm), a irradiância será aumentada de oito vezes, possivelmente gerando dano térmico ao tecido. Se neste segundo caso, o tempo de exposição for reduzido para 1 milisegundo (0,001 s), então a fluência decresce drasticamente atingindo valores da ordem de 8 J/cm2, valores tipicamente utilizados em terapia com laser de baixa potência.
2.1.3.2. Comprimento de Onda
O
comprimento de onda é extremamente importante pois é ele
quem define a profundidade de penetração no tecido alvo (BOURGELAISE,
1983; FULLER, 1983). Diferentes comprimentos de onda apresentam diferentes
coeficientes de absorção para um mesmo tecido. Na figura
2.2, JACQUES (1995) resume os diferentes coeficientes de absorção
para diferentes tecidos em função do comprimento de onda.
Como podemos observar, as radiações emitidas na região
do ultravioleta e na região do infravermelho médio apresentam
alto coeficiente de absorção pela pele, fazendo com que a
radiação seja absorvida na superfície, enquanto que
na região no infravermelho próximo (820 nm e 840 nm) constata-se
baixo coeficiente de absorção, implicando em máxima
penetração no tecido (KARU, 1985; 1987).
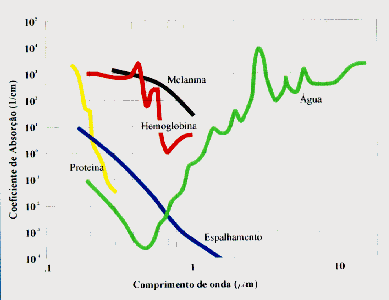
Figura 2.2: Coeficientes de absorção para diferentes tecidos em função do comprimento de onda, proposto por JACQUES em 1995.
2.1.3.3. Conceito de Foto-bioativação
O laser operando em baixa potência foi considerado por MESTER, em 1969, um Bioestimulador, e por isso, por um determinado período de tempo, encontramos na literatura essa terminologia utilizada como sinônimo para designar esse tipo de laser, que também era chamado de laser de bioestimulação. Ainda não se conhecia muito bem seu mecanismo de ação nessa época, e o que se observava era que os terapeutas tinham excelentes resultado no tratamento de feridas e úlceras abertas, estimulando seu processo de cicatrização. Porém, com o passar do tempo, essa terapia começou a ser utilizada não só para estimular e acelerar processos mas também para detê-los. MESTER (1969) escolheu a terminologia "Bioestimulação" porque ele basicamente utilizava essa terapia para acelerar o processo de cicatrização. Entretanto, essa terapia passou a ser utilizada muitas vezes buscando efeitos antagônicos no tecido biológico: foi utilizada para remover excessos de pigmento, mas também para restaurar a falta deles (SASAKI e OHSHIRO, 1989); para tratar cicatrizes deprimidas, mas também cicatrizes hipertróficas (STRONG, 1997); para aliviar a dor, mas também para fazer com que a sensibilidade voltasse a instalar-se em áreas de parestesia ou paralisia (ROCHKIND et al., 1989); para controlar hipotensão, mas também para tratar hipertensões (ASAGAI et al., 1998). A partir de estudos clínicos e laboratoriais pôde-se concluir que essa terapia não somente acelerava determinados processos, mas também retardava outros. Os autores começaram então a entender que nesse tipo de terapia o laser desempenhava um papel de normalizador das funções celulares e OSHIRO e CALDERHEAD em 1991, propuseram a expressão "Balanceador e Normalizador de funções".
2.1.4. Diferença da Ação entre a Luz Laser Visível e Infravermelha
A energia dos fótons de uma radiação laser absorvida por uma célula será transformada em energia bioquímica e utilizada em sua cadeia respiratória. Tina Karu em 1988, descreveu um mecanismo de ação diferente para os laseres emitindo radiação na região do visível e do infravermelho próximo (Fig. 2.3).
A luz laser visível induz a uma reação foto-química, ou seja, há uma direta ativação da indução de síntese de enzimas (BOLOGNANI et al., 1993; OSTUNI et al., 1994; BOLTON et al., 1995), e essa luz tem como primeiros alvos os lisossomos e as mitocôndrias das células.
As organelas não absorvem luz infravermelha, apenas as membranas apresentam resposta à este estímulo. As alterações no potencial de membrana causadas pela energia de fótons no infravermelho próximo (PASSARELA et al., 1984) induzem a efeitos foto-físicos e foto-elétricos, causando o choque entre células que se traduz intracelularmente por um incremento na síntese de ATP (COLLS, 1986).
O
mecanismo de interação do laser em nível molecular,
foi descrito primeiramente por KARU (1988). Os incrementos de ATP mitocondrial
que se produzem após a irradiação com laser, favorecem
um grande número de reações que interferem no metabolismo
celular (Fig. 2.3) (PASSARELA et al., 1984; POURREAU-SCHNEIDER et al.,
1989; FRIEDMANN et al., 1991). Em estados patológicos, o laser interfere
no processo de troca iônica, acelerando o incremento de ATP (KARU
et al., 1991a; YOUNG et al., 1990; LUBART, et al., 1992b; LOEVSCHALL E
ARENHOLT-BINDSLEV, 1994; LUBART et al., 1996; LUBART et al., 1997).
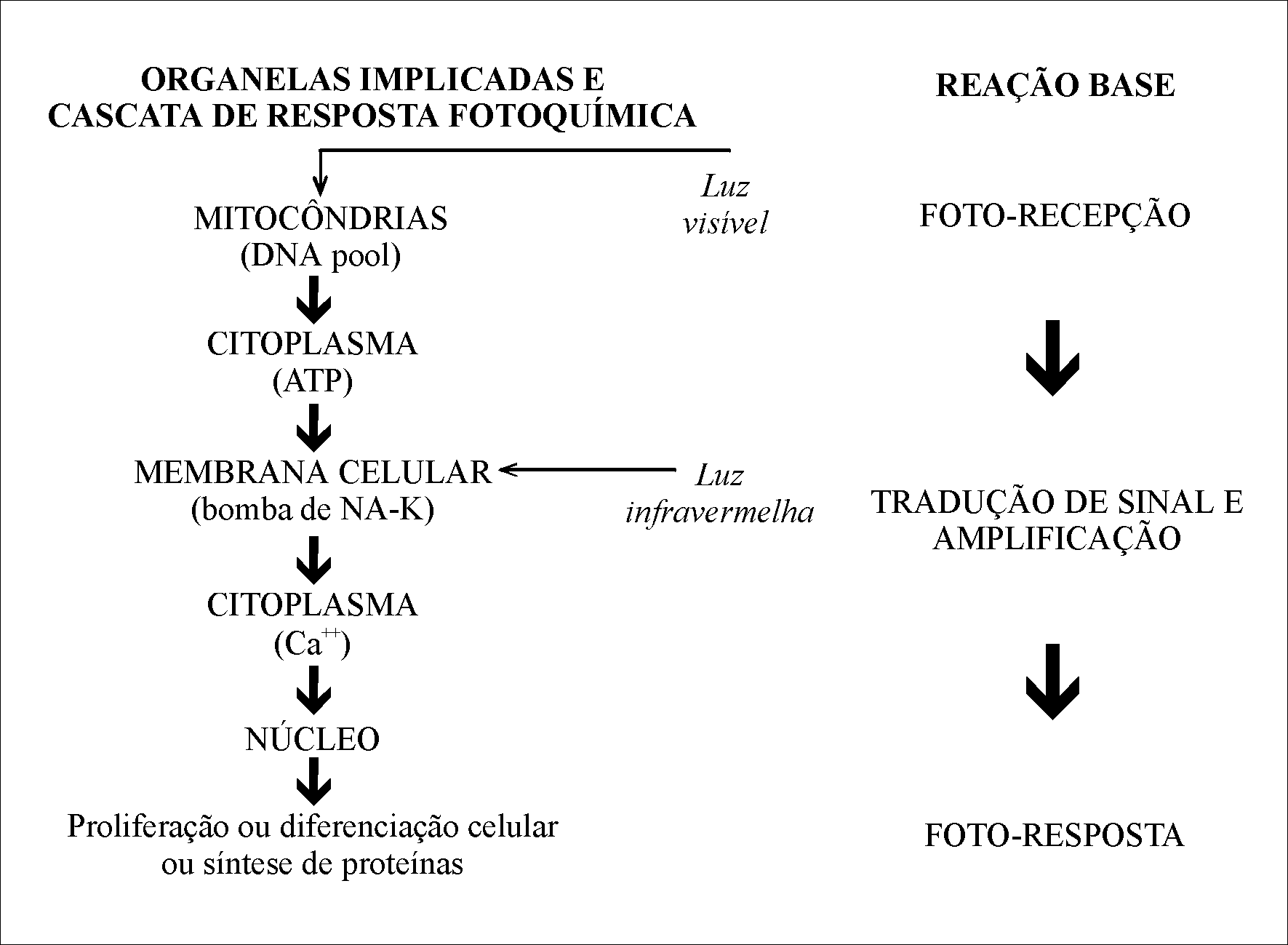
Figura 2.3: Modelo de KARU modificado por SMITH. Ação foto-química do laser visível na cadeia redox da mitocôndria. Ação foto-física do laser infravermelho na membrana celular. Ambos desencadeiam uma resposta celular, que gera uma cascata bioquímica de reações.
2.1.4.1. Atuação da Terapia com Laser de Baixa Potência
Os laseres utilizados nesse tipo de terapia estão situados na porção visível do espectro das radiações eletromagnéticas, bem como no infravermelho próximo. Os comprimentos de onda mais utilizados estão entre 600 e 1000 nm, estes comprimentos de onda são relativamente pouco absorvidos e consequentemente apresentam uma boa transmissão na pele e nas mucosas (RIGAU, 1996).
O significado biológico e clínico da coerência ainda não está bem definido. Alguns autores como KARU, em 1987, baseados em achados em cultura de células e de bactérias, demonstraram que a coerência não é importante. Outros autores como YOUNG et al., 1990, trabalharam com cultura de células utilizando linhagem de macrófagos e fibroblastos e demonstraram efeitos foto-bioestimulativos significativos utilizando igualmente fontes de luz não-coerente. Também SVAASAND, em 1990, demonstrou que a absorção de fótons advindos das radiações de laser de baixa potência por parte de um sistema biológico, em condições de homeostase, são de natureza não-coerente. A coerência da luz perde-se nos primeiros estratos da pele, devido ao fenômeno de dispersão da luz, antes que se produza a absorção dos fótons por cromóforos como a melanina, hemoglobina, porfirinas, citocromo oxidasa, entre outros, e não é essencial in vivo, como demonstraram PARRISH, 1980; JORI, 1980; ANDERSON e PARRISH, 1982; MCKINLEY et al., 1988; HAZEKI e TAMURA 1989; YOUNG et al., 1990; TERRIBILE et al., 1992 e LUBART et al., 1995. Dessa forma conclui-se que os efeitos biológicos dos laseres operando em baixa potência dependem principalmente de sua monocromaticidade (MESTER et al., 1978; BERKI et al., 1988; KARU 1987; KUBOTA et al. 1989; BIHARI e MESTER, 1989) e da fluência (SHIROTO et al., 1989; LUBART et al., 1992a; AL-WATBAN e ZHANG, 1994; WEI YU et al., 1994; KARU, et al., 1996), assim como da fase de crescimento celular em que as células receberam a irradiação (KARU et al., 1995).
Os diodos laseres e o laser de He-Ne rotineiramente utilizados em aplicações clínicas com finalidade bioestimulativa, e não inibitória, operam bem abaixo de 1 W, o miliwatt (mW = 0,001 W) é mais comumente utilizado para especificar a irradiância nesses sistemas. A irradiância média situa-se entre 0,01 e 100 mW/cm2, enquanto que a fluência entre 0,1 e 10 J/cm2 (TRELLES et al., 1989; MESTER e MESTER, 1989b; ROCHKIND et al., 1989; TERRIBILE et al., 1992; WEI YU et al., 1994; BOLTON et al., 1995).
Para os laseres pulsados e chaveados, alguns autores (DYSON et al., 1991; KARU et al., 1997) especificaram que diferentes freqüências produzem diferentes efeitos biológicos. Em 1996, EL SAYED e DYSON apresentaram um estudo in vitro sobre o efeito da média de pulso e pulso de duração no número de mastócitos e sua degranulação. Os autores observaram que o aumento do número de mastócitos não foi dependente da freqüência de pulso, enquanto que sua degranulação foi.
Quando os experimentos são feitos in vitro, por exemplo em cultura de células cujos cultivos apresentem-se em monocamadas, a luz laser incide e conserva sua polaridade e coerência. Aqui sim esses fatores podem ser determinantes nos resultados biológicos gerados.
A absorção de fótons por parte da célula, seja diretamente por captação a nível de crómoforos mitocondriais ou por ação em sua membrana celular, produz estimulação ou inibição de atividades enzimáticas e de reações foto-químicas. Estas ações determinam alterações foto-dinâmicas em cascatas de reações e em processos fisiológicos com conotações terapêuticas (FUNK et al., 1992; LOEVSCHALL e ARENHOLT-BINDSLEV et al., 1994; LUBART et al., 1997).
Esses processos podem manifestar-se clinicamente de três modos. Primeiramente vão agir diretamente na célula, produzindo um efeito primário ou imediato, aumentando o metabolismo celular (KARU et al., 1989; ROCHKIND, et al., 1989; BOLTON et al. 1995), ou por exemplo, aumentando a síntese de endorfinas e diminuindo a liberação de transmissores nosciceptivos, como a bradicinina e a serotonina (ATAKA et al., 1989). Também terá ação na estabilização da membrana celular (PALMGREN, 1992; IIJIMA et al., 1991). Clinicamente observaremos uma ação estimulativa e analgésica dessa terapia. Haverá além disso um efeito secundário ou indireto, aumentando o fluxo sangüíneo (SCHENK, 1985; KUBOTA e OHSHIRO, 1989) e a drenagem linfática (LIEVENS, 1986; 1988; 1990; 1991), por exemplo. Dessa forma, clinicamente observaremos uma ação mediadora do laser na inflamação. Por fim, haverá a instalação de efeitos terapêuticos gerais ou efeitos tardios e clinicamente observaremos, por exemplo, a ativação do sistema imunológico (MESTER et al., 1977; TRELLES, 1986; SKOBELKIN et al., 1991; VÉLEZ-GONZÁLEZ et al., 1994; TUNÉR e HODE, 1996).
2.1.5. Aplicações Clínicas
Devido às suas características de aliviar a dor, estimular a reparação tecidual, reduzir edema e hiperemia nos processos antiinflamatórios, prevenir infecções, além de atuar em parestesias e paralisias, o laser de baixa potência tem sido empregado freqüentemente em múltiplas especialidades médicas e odontológicas.
Na clínica odontológica existe grande número de aplicações, e o uso dessa terapia já se faz rotineira para bioestimulação óssea, em casos de implantes e cirurgia oral menor; para diminuir a dor e edema nos casos de pós-operatórios diversos, úlcera aftosa recorrente, herpes, nevralgias e hipersensibilidades dentinárias; além de ativar a recuperação em quadros de paralisias e parestesias (ALMEIDA-LOPES, 1997; 1998a).
Em Medicina utiliza-se essa terapia para melhorar a cicatrização no tratamento de queimados e de pacientes que receberam algum tipo de enxerto ou retalho, ativando a vascularização dessas regiões. Também é utilizada para o tratamento de dores agudas e crônicas de diversos tipos (KERT e ROSE, 1989) e até mesmo aquelas causadas por herpes genitais e em pós-operatórios diversos em ginecologia. Também é freqüente sua utilização por fisioterapeutas e por médicos que trabalham em medicina do esporte naqueles pacientes que sofreram trauma esportivo, devido ao seu emprego com sucesso em quadros de distensões e contraturas musculares (TUNÉR e HODE, 1996).
2.2.
Reparação Tecidual
2.2.1.
Introdução
O processo de reparação não é um simples processo linear no qual fatores de crescimento disparam a proliferação celular e sim uma integração de processos interativos dinâmicos, que envolve mediadores solúveis, elementos figurados do sangue, produção de matriz extra celular e células parenquimatosas. Desencadeados, esses processos seguem-se em uma seqüência e tempo específicos. Deve ser separado, na reparação, a regeneração e a cicatrização. Regeneração é quando a reposição tecidual é realizada por células do mesmo tipo das que foram perdidas. Assim, quando possível, os parênquimas regeneram. Por outro lado, entende-se por cicatrização quando a reposição tecidual é feita de modo inespecífico, com produção de um tecido conjuntivo próprio: a cicatriz. Ambos os processos estão entremeados, ocorrendo conjuntamente, mas conceitualmente passam-se de maneira diversa. Foge ao escopo deste trabalho estudarmos o fenômeno da regeneração, que tem identidade própria. Daremos ênfase ao estudo da cicatrização, por estar nele envolvido o fibroblasto.
Os eventos da cicatrização tecidual podem ser classicamente divididos em três fases: a fase da inflamação, fase de formação de tecido de granulação com depósito de matriz extracelular e a remodelação tecidual (CLARK, 1993). Essa fases não são mutuamente exclusivas, e sim sobrepostas no tempo.
Para McKinney, 1989, os fatores que influenciam o processo também influenciam na aparência final da dita cicatriz. Segundo o grau de isquemia, oxigenação e aporte de fatores angiogênicos de crescimento, que aparecem desde o momento em que se estabelece uma ferida até o momento final de sua remodelação, passando pelo seu processo de reposição de tecidos, haverá um processo específico de cura. O grande cenário para a reparação combina três eventos: hemostasia (porque os vasos estão abertos), inflamação (porque houve uma injúria), e reparação propriamente dita, pois se estruturas foram lesadas ou destruídas, deverá ocorrer reposição de tecidos por regeneração ou por cicatrização.
O plano básico do processo de cicatrização, de uma maneira geral, é sempre o mesmo: preencher aquele espaço e selá-lo com uma cicatriz. Os detalhes de que forma isso irá evoluir, entretanto, variam segundo a presença ou ausência de bactérias, a natureza da ferida (se é fechada ou aberta), o grau de suprimento sangüíneo, a quantidade de tecido morto para ser eliminado, o tipo de tecido lesado e muitos outros fatores (MAJNO e JORIS, 1996).
A situação mais favorável para a cicatrização é quando a ferida está fechada, suturada e não infectada; isto é conhecido como ferida incisional, como oposição a ferida excisional, por meio da qual um pedaço de tecido é removido.
Aqui a cicatrização pode começar imediatamente, porque não há população bacteriana significativa e virtualmente não há tecido morto para ser eliminado. Um termo cirúrgico para esta situação é "cicatrização por primeira intenção" (Fig. 2.4). Em contra partida, a reposição é alongada se há sinal de infecção ou se a ferida permanece aberta devido a uma perda tecidual. Estas duas condições são obstáculos que devem ser superados antes que a ferida se feche; este tipo de cicatrização que ocorre é conhecida por "cicatrização por segunda intenção" (Fig. 2.5).
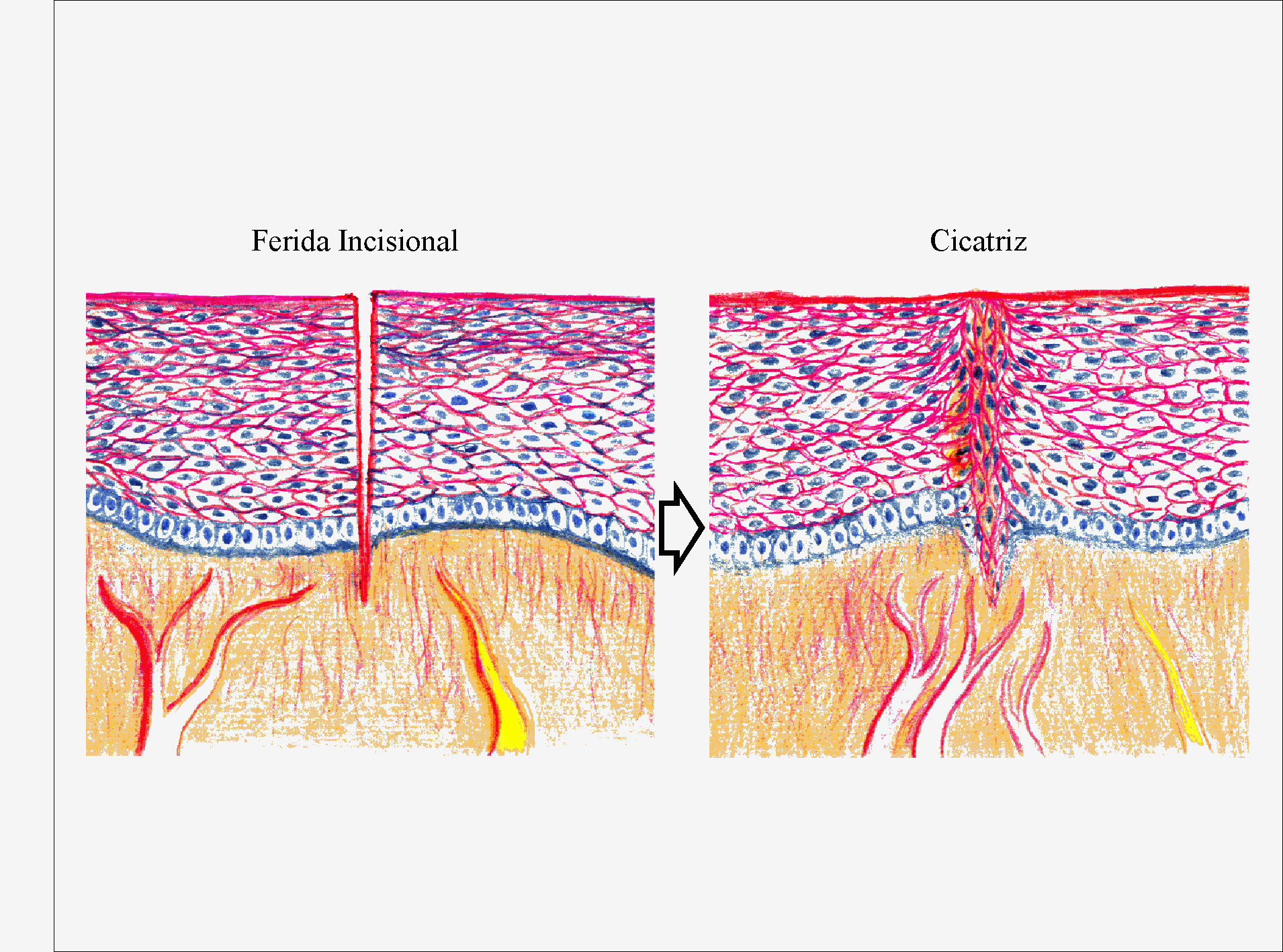
Figura 2.4: Quadro de uma cicatrização por primeira intenção numa ferida fechada, não infectada, como uma ferida cirúrgica incisional. As margens estão próximas e o processo de cicatrização evolui diretamente à produção de uma cicatriz.
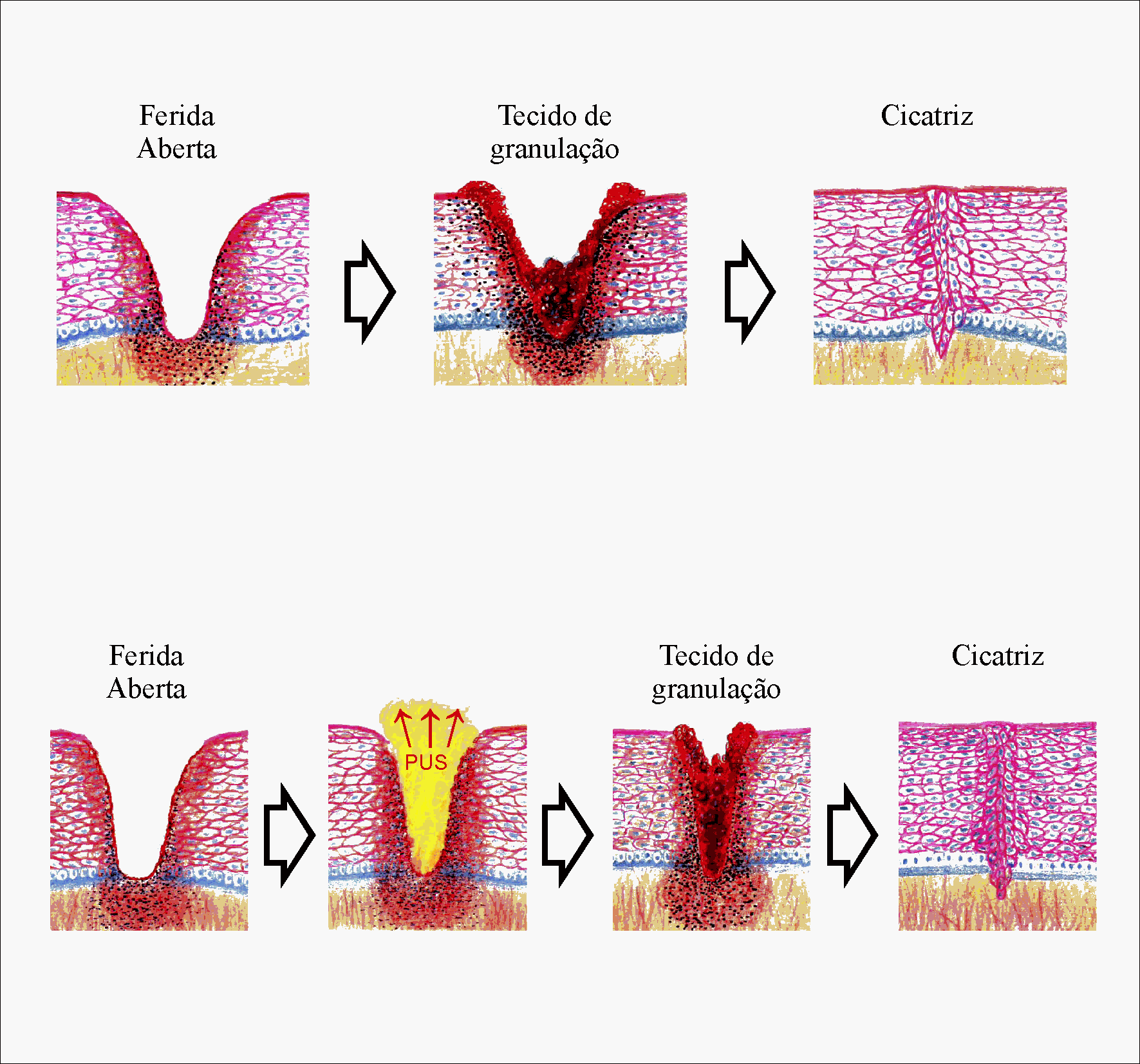
Figura 2.5: Quadro de uma cicatrização por segunda intenção. Acima: cicatrização por segunda intenção numa ferida aberta não infectada. A fenda é primeiramente preenchida por tecido de granulação, o qual se contrai e torna-se uma cicatriz. Abaixo: cicatrização por segunda intenção em uma ferida infectada (as setas vermelhas representam as bactérias). A ferida é preenchida com tecido de granulação, o qual produz pus até as bactérias serem eliminadas. Depois disso o tecido de granulação contrai e produz uma cicatriz.
2.2.2. Cicatrização por Primeira Intenção: Fechamento de Feridas Assépticas
A seguir, será descrita a cicatrização de uma ferida incisional suturada não infectada. Tecnicamente todas as feridas são infectadas em menor ou maior grau; entretanto na cirurgia asséptica o número de bactérias é bastante reduzido o que faz com que o processo de reparação tecidual não seja perturbado. A seqüência de eventos é razoavelmente constante, mas a regulação indicada abaixo é meramente indicativa, pois conforme as condições, esses eventos podem ser antecipados e acontecerem na metade desse tempo ou serem postergados, e terem seu tempo de evolução dobrado.
2.2.2.1. Hemostasia: dentro de segundos a minutos
A primeira prioridade do organismo é a hemostasia, ou seja, parar o sangramento. As arteríolas lesadas contraem-se e o derramamento de sangue cessa. Além disso mecanismos de coagulação do sangue são desencadeados. O sangue poderá coagular-se por meio de dois mecanismos: intrínseco e extrínseco. No mecanismo extrínseco o processo de coagulação é desencadeado pelo contato com colágeno. No intrínseco inicia-se pela influência da ação de fatores de crescimento liberados por células lesadas e por plaquetas e fatores sangüíneos. Ambos mecanismos são disparados na ferida, e então o coágulo sangüíneo forma-se, ajudando a cessar o sangramento.
Uma injúria provoca ruptura de vasos sangüíneos com concomitante extravasamento de seus elementos. A ativação de plaquetas inicia a hemostasia, com sua respectiva adesão à parede endotelial dos vasos lesados e conseqüente aglutinação. A agregação plaquetária iniciará a formação do coágulo por via intrínseca. Atividades do endotélio intacto do vaso sangüíneo limitarão o coágulo às áreas vasculares lesadas. Enquanto o coágulo sangüíneo no interior do lúmen do vaso mantém a hemostasia, o coágulo presente no espaço da ferida provê uma matriz provisória para a migração celular. Por exemplo, fibrina e fibronectina exsudados atuam como uma matriz provisória para a diapedese de monócitos e a orientação de fibroblastos (GRINNELL et al., 1980).
Enquanto estes eventos passam-se na luz dos vasos, fibrinogênio exsudado para o interstício transforma-se em fibrina e forma uma tênue rede que conecta os dois lados da ferida no chamado leito da ferida. Os próprios produtos do coágulo ajudam a iniciar o processo de reparação. Trombina, a enzima que catalisa a formação de fibrina, atrai macrófagos e causa a replicação de fibroblastos; e o fator de crescimento derivado de plaquetas (PDGF) liberado por degranulação de plaquetas é também um mitógeno e um quimiotático para fibroblastos (COLVIN, 1986).
As plaquetas têm dupla função: além de facilitarem a formação do tampão hemostático, também secretam citocinas incluindo fatores de crescimento como o PDGF, fator de crescimento transformante a (TGFa ), fator de crescimento transformante b (TGFb ), fator de crescimento epidérmico (EGF), além de outros mediadores com uma multiplicidade de ações. As plaquetas liberam ainda muitas substâncias biologicamente ativas incluindo moléculas da matriz extra celular (MEC), como a fibronectina, a trombospondina e o fator de Von Willebrand.
2.2.2.2. Inflamação: dentro de minutos a horas
A inflamação é iniciada imediatamente, independente da presença de bactérias na região. Esse é provavelmente um procedimento preventivo que o organismo encontra para não haver uma importante perda de tempo, caso haja contaminação dessa ferida. Após uma agressão, seguem-se fenômenos iniciais da cicatrização, conhecidos como "fase de demolição". Levam a uma limpeza ou demolição dos tecidos lesados, restos de agentes, entre outras coisas; o processo não é senão uma inflamação asséptica, caso não haja agentes contaminantes. Assim sendo, uma grande quantidade de mediadores da inflamação são gerados, um exsudado de células e fluido começa a extravasar das vênulas, as arteríolas dilatam-se e leucócitos movem-se lentamente, atraídos por agentes quimiotáticos, como substâncias químicas endógenas ou algum microorganismo. Caso eles encontrem algum, a batalha começa e mais leucócitos são recrutados. Entretanto, numa ferida estéril, o número de leucócitos no exsudato não é suficiente para chamá-lo de pus. A limpeza do debridamento, incluindo os neutrófilos remanescentes, começa imediatamente. Os tecidos próximos à ferida entumescem um pouco devido ao edema inflamatório. Nos espaços de tecido conectivo distendidos, os exsudatos coagulam e formam uma fina rede de fibrina; isto, juntamente com a fibronectina, oferece aos leucócitos uma superfície extra contra a qual eles podem capturar as bactérias (fagocitose de superfície).
2.2.2.3. Formação da Crosta
A crosta começa a ser formada com o exsudato filtrado da ferida suturada e aparece na superfície da pele: isso coagula e eventualmente resseca. Este processo continua e forma uma crosta, que tem a importante função de isolar a ferida do meio ambiente, prevenir a penetração de bactérias e impedir a dessecação. GRILLO apud MAJNO e JORIS, 1996, é da opinião que a crosta é um curativo natural da ferida.
2.2.2.4. Migração de Células Fixas: dentro de 24 horas
Após 24 horas, algumas células estacionárias como os fibroblastos, células epidérmicas e endoteliais (GROTENDORST e MARTIN, 1986) começam a mover-se. Os leucócitos atraídos à ferida agora incluem mais monócitos, que colonizam o espaço da ferida e seu redor; eles fagocitam os restos de neutrófilos, os quais continuam a chegar e a morrer horas depois de sua chegada. Conforme os macrófagos limpam, eles tornam-se ativados; eles secretam citocinas que direcionam a atividade de todas as outras células.
A rede de fibrina continua a crescer pelo fibrinogênio fornecido pelo exsudato inflamatório. Mecanicamente ele não é muito forte, porém desempenha outro importante papel: filamentos de fibrina coagulados com a proteína plasmática fibronectina são adequadas como ponto de apoio para as células epidérmicas e fibroblastos migratórios. Após 24 horas, os fibroblastos alargam-se e começam a migrar em direção ao leito da ferida, arrastando-se ao longo dos filamentos de fibrina coagulados. Um desses fatores chamados de quimiotáticos é o PDGF, liberado pelas plaquetas no processo da hemostasia.
As células epidérmicas são mobilizadas dentro de horas. Células basais ao lado do corte, ativadas pela repentina ausência de vizinhança (MONTESANO e ORCI em 1988 chamaram esse fenômeno de "efeito de vizinhança-livre"), deprimem-se e arrastam-se à área desnudada; as primeiras células ativadas são as fagocitárias, as quais devem ajudá-las a digerir a região abaixo e ao longo da crosta em formação.
A angiogênese, que é a regeneração de vasos sangüíneos, é difícil de ser observada às 24 horas através de microscopia de luz, mas eles já estão se desenvolvendo em ambas faces da ferida, em resposta a fatores angiogênicos, e crescem junto ao leito da ferida. A anoxia (falta de oxigênio) é o principal fator determinante do estímulo interno vascular. No leito da ferida a tensão de oxigênio está próxima do zero: se isso é aumentado artificialmente, a angiogênese cessa (KNIGHTON et al., 1981). Essa fase de angiogênese também se deve aos macrófagos. Eles migraram ao interior do leito da ferida tornando-se anóxicos, e a anoxia incentivou-os a secretar um fator que estimula o crescimento capilar (KNIGHTON et al., 1983), provavelmente o TNFa (LEIBOVICH e WISEMAN, 1988). Este fator também é secretado quando há altas concentrações de lactato, situação essa ocorrida no leito de feridas (JENSEN et al., 1986).
Devido à grande variedade de fatores quimiotáticos presentes na área da injúria, haverá a atração de determinadas células, por exemplo, após as primeiras horas depois da agressão, neutrófilos infiltrarão na área na tentativa de limpá-la de partículas e bactérias. Após uma variação de 24 a 48 horas, também se observará uma presença maciça de monócitos. Se uma excessiva contaminação ocorrer ou se houver a presença de partículas não passíveis de sofrerem fagocitose nessa região, a presença de neutrófilos, cuja principal função é liberar o tecido de fragmentos teciduais mortos e de microorganismos contaminantes, poderá causar ainda mais dano ao tecido devido à produção de enzimas e produtos citotóxicos. Os monócitos serão ativados a estado de macrófago.
Os macrófagos têm varias funções. Eles debridam o tecido através da fagocitose e digestão de microorganismos patogênicos, limpando a área de tecido lesado e de neutrófilos efetores, desempenhando um papel crítico para o início da reparação tecidual. Esses neutrófilos poderão ainda ser fagocitados por fibroblastos (NEWMAN et al., 1992).
Quando o neutrófilo infiltra, o acúmulo de monócitos continua, estimulado pelos fatores quimiotáticos seletivos de monócitos. Esses fatores incluem fragmentos de colágeno, elastina e fibronectina; trombina enzimaticamente ativa e TGF-b . Similar ao recrutamento de neutrófilos, fatores quimiotáticos ativam monócitos circulantes a aderir à parede endotelial do vaso sangüíneo em direção ao interstício da matriz extra celular. Os macrófagos também controlam a síntese e liberação de enzimas como a colagenase, por parte do fibroblasto (HUYBRECHTS-GODIN et al., 1979) que facilitam esse debridamento (CAMPBELL et al., 1987). Além disso, quando os macrófagos são ativados por endotoxinas bacterianas, substâncias como a proteína neutrófilo-ativadora (NAP) são liberadas e facilitam o recrutamento de mais células inflamatórias ao local. Os macrófagos além de promover fagocitose e debridamento, aderência para matriz extra celular, também estimulam o monócito a sofrer uma metamorfose a macrófago inflamatório/reparativo.
Dessa forma, os macrófagos desempenham um papel de suma importância na transição entre a inflamação e a segunda fase da reparação das feridas, que é a formação do tecido de granulação.
2.2.2.5. Cicatrização: 3 dias
Em relação às células inflamatórias, aos dois ou três dias, os monócitos começam a exceder o número de neutrófilos (SIMPSON e ROSS, 1972). A regeneração, que havia começado já às 24 horas da injúria, agora domina o panorama. O avanço de células epidérmicas faz-se entre a crosta sero-hemática e o derma, por secreção de colagenase. Células basais normais não tem receptores para fibronectina enquanto que células em regeneração tem. A regulação depende, em grande parte, da extensão da crosta. Onde a epiderme estiver perfurada por uma linha de sutura, as células epidérmicas crescem para dentro da linha da sutura como um tubo circundando o fio. Isto deveria ser esperado, já que a tendência de crescimento do epitélio é sobre as superfícies teciduais expostas.
Os fibroblastos ativados estão em plena diferenciação. Em resposta aos fatores de crescimento eles multiplicam-se e produzem fibras colágenas, primeiramente colágeno do tipo III (McPHERSON e PIEZ, 1988). Eles também secretam proteoglicans e fibras elásticas.
A angiogênese progride suficientemente para que aos dois ou três dias, alguns brotos comecem a aparecer de ponta a ponta. A isso se conhece por inosculation (em latim ósculo significa beijo, RUDOLPH e BALLANTYNE, 1990). Os novos fibroblastos acumulados misturam-se a novos capilares para formar o começo do tecido de granulação. O tecido de granulação começa a ser formado por volta do quarto dia após a injúria (GUIDUGLI-NETO, 1987). Os vasos têm células endoteliais com características de forte ativação (GUIDUGLI-NETO, 1992).
O tecido de granulação consiste em um denso leito de macrófagos, fibroblastos e neovasos suportados por uma matriz de fibronectina, colágeno tipo I e tipo III e ácido hialurônico. Os fibroblastos movem-se dentro do leito da ferida e ostentam diferentes fenótipos. Primeiro os fibroblastos assumem um fenótipo migrante, depois um fenótipo produtor de colágeno e finalmente um fenótipo contrátil, o miofibroblasto. Este é o responsável pelo fenômeno importante de contração da cicatriz.
2.2.2.6. Cicatrização Precoce: entre 7 e 10 dias
Dentro de uma semana o leito da ferida teve tempo suficiente para ser preenchido com tecido de granulação (GUIDUGLI-NETO, 1987). Muito pouco dele é requerido devido ao fato de que os dois lados da ferida estão muito próximos. Uma rede de capilares atravessa o leito da ferida. A rede linfática começa a ser regenerada com algum atraso em relação `a rede vascular: eles avançam de ponta a ponta assim como os vasos sangüíneos. Lentamente o tecido de granulação adquire mais e mais fibras colágenas e começa adquirir a aparência da massa fibrosa denominada "cicatriz".
De uma extremidade à outra, a limpeza efetuada pelos macrófagos continua e eventualmente a fibrina também é removida. O colágeno do tipo I começa a aparecer nessa fase (CLARK e HENSON, 1988).
Embora a epiderme tenha sido regenerada, os anexos da pele, como pêlos e glândulas, ainda não se desenvolveram. As cicatrizes em humanos geralmente são imberbes além de pálidas, devido a regeneração dos melanócitos ocorrer pobremente.
2.2.2.7. Maturação da Cicatriz: entre 1 mês e 2 anos
Finalmente a cicatriz será uma massa de tecido fibroso com muitas fibras colágenas, algumas células e alguns vasos, porém o processo de maturação é lento. Conforme o tempo passa, a maioria das células desaparecem: observa-se apoptose dos fibroblastos e das células endoteliais (DARBY et al., 1990). Eosinófilos às vezes aparecem nas últimas fases da reparação tecidual; talvez eles contribuam com fatores de crescimento (TODD et al., 1991). O colágeno tem cada vez mais pontes entre as fibras. Permanecem algumas fibras elásticas. Muitos capilares desaparecem e por isso as cicatrizes antigas têm aparência esbranquiçada, sendo hipo-vascularizadas.
A fase final da reparação de uma ferida é a remodelação da matriz, que se solapa em parte com as fases predecessoras. Ou seja, a produção de matriz e sua remodelação produz-se simultaneamente com a formação do tecido de granulação. Entretanto, nos meses seguintes após a reepitelização, há uma redução e alteração contínua da matriz. A fibronectina é rapidamente eliminada da matriz e as fibras de colágeno tipo I aumentam lentamente ao longo da neomatriz para aportar resistência à pele e à cicatriz
Todavia, tarda muitos meses, até mesmo um ano ou dois, para que uma cicatriz cirúrgica mude de cor rosa para branca. A troca local de colágeno permanece alta durante anos.
A resistência ao estiramento é alterada na cicatriz. Até mesmo uma cicatriz madura nunca é tão forte como a pele normal. A força de tensão permanece abaixo do normal, nunca atingindo, na pele, a original. Em tecidos frouxos pode-se, contudo, atingir níveis superiores.
2.2.2.8. Mediadores Químicos da Reparação Tecidual
Nas primeiras horas após o estabelecimento de uma injúria, os mediadores são aqueles pertinentes à inflamação aguda. Por exemplo, mastócitos lesados liberam histamina que causa hiperemia, e uma variedade de células liberam prostaglandinas. Plaquetas do tampão hemostático prontamente liberam serotonina (um vasoconstritor) e uma infinidade de outros mediadores. O aumento da permeabilidade de vênulas pode resultar da liberação de leucotrienos, liberado pelas plaquetas. Essas reações ocorrem em cadeia: a coagulação é acompanhada da ativação de calicreinas de origem plasmática, as quais produzem bradicinina; a bradicinina induz a produção de prostaglandinas (WILLIAMS, 1988). Leucócitos são atraídos pelo leucotrieno B4 e por muitos produtos da proteólise. Enzimas proteolíticas produzidas de diversas fontes (lisossomas de células e plaquetas lisadas, grânulos de mastócitos, plasmina do sistema fibrinolítico ativado), e elas atuam numa variedade de proteínas para produzir mediadores (substratos incluindo moléculas do complemento C3, C4, C5, cininogênio e fibrina). Complementos, de qualquer forma, ajudam a atrair neutrófilos ainda que não sejam essenciais para a reparação tecidual (WAHL apud MAJNO e JORIS, 1996). Dentro de horas, os mediadores da inflamação aguda desaparecem e o papel principal é desempenhado por uma variedade de citocinas e fatores de crescimento, especialmente o PDGF e o TNFa , secretado por macrófagos. Alguns desses fatores são liberados pelas plaquetas, especialmente nas primeiras horas, entretanto os mastócitos também os fornecem. Dentro de dois ou três dias os macrófagos assumem a "vigilância" do processo reparacional, parecendo ser a anóxia um dos indutores principais.
Os fatores de crescimento implicados na reparação de feridas são inúmeros, têm complexa ação e inter-relação uns com os outros, e ainda há controvérsia e falta de elucidação em relação a eles.
O termo "fatores de crescimento" deriva de seus efeitos estimuladores sobre a proliferação celular e a síntese de DNA in vitro. Eles constituem uma família de peptídeos reguladores com múltiplas e variadas funções. SPORN e ROBERTS, em 1988, afirmaram que os fatores de crescimento formam parte de uma complexa linguagem de sinais celulares em que os peptídeos individuais são o equivalente às letras de um alfabeto ou código. ROTHE e FALANGA (1989) consideram que esses peptídeos desempenham um importante papel em muitos processos biológicos in vivo, incluindo a embriogênese, a oncogênese e a reparação de feridas.
Os fatores de crescimento implicados diretamente na reparação tecidual e sua atividade biológica estão resumidos nas tabelas 2.2 e 2.3 [segundo RIGAU, 1996].
Tabela
2.2: Fatores de crescimento implicados na reparação de feridas
cutâneas.
|
|
|
|
|
|
PM:30.000 |
cel.endotelial macrófagos |
cél. musc. lisa cels. gliais |
|
|
PM:6.045 |
gl. submaxilar |
cél. endotelial fibroblastos |
|
|
PM:7.800 |
hepatócitos |
queratinócitos hepatócitos |
|
|
PM:7.471 |
hepatócitos |
fibroblastos hepatócitos adipócitos |
|
|
PM:5.700 |
cels. tumorais macrófagos |
hepatócitos fibroblastos osteoblastos cels. Schwann |
|
|
PM:25.000 |
|
hepatócitos fibroblastos osteoblastos |
alta afinidade |
|
Pm:15.600 |
retina |
fibroblastos condrócitos cels. gliais cels. epiteliais osteoblastos queratinócitos |
|
|
Pm:16.400 |
retina corpo lúteo macrófago rim próstata
|
fibroblastos condrócitos cels. gliais cél. epitelial osteoblastos queratinócitos |
sem endocitose do complexo FGF-FGF-R |
Tabela
2.3: Atividade biológica dos fatores de crescimento implicados na
reparação cutânea.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2.3. Cicatrização por Segunda Intenção
A reparação tecidual pode ser retardada em duas circunstâncias: se a ferida for contaminada ou se a ferida for aberta.
2.2.3.1. Cicatrização de Feridas Infectadas
Na superfície exposta de uma ferida infectada, ocorrem ondas de neutrófilos. Mesmo se a ferida estiver suturada, as superfícies justapostas não podem se aderir umas às outras, devido ao fato de elas estarem separadas por pus. Eventualmente, as duas superfícies são cobertas por uma camada de tecido de granulação similar à membrana piogênica de um abscesso, produzindo pus. De fato, uma ferida infectada comporta-se muito mais como um abcesso bem delimitado. A reparação não pode começar até que a infecção tenha sido superada; naquele ponto da ferida, preenchido parcialmente por tecido de granulação, tornar-se-á uma ferida aberta. Dessa forma o processo de cura dessa ferida evoluirá de maneira especial. A presença de neutrófilos, trazendo grande quantidade de enzimas líticas, e a alteração do pH, comprometem o adequado crescimento celular.
2.2.3.2. Cicatrização de Feridas Abertas
A reparação de uma ferida aberta, cirúrgica (excisional) ou acidental, apresenta um problema especial devido à sua perda de substância, que de alguma forma deve ser preenchida. O organismo é capaz de sintetizar algum preenchimento, como o tecido de granulação, porém tem um mecanismo coadjuvante mais rápido. Após um período que varia entre cinco e nove dias, as margens da ferida movem-se uma contra a outra, como se houvesse uma força invisível de tração (PEACOCK, 1984). Este fenômeno é conhecido por "contração da ferida". Embora presente em qualquer cicatrização, a maior quantidade de tecido de granulação fará com que o fenômeno ocorra de maneira quantitativamente mais exuberante.
Essa contração de feridas abertas é feita por pelo menos dois mecanismos distintos. Durante os primeiros dias, numa ferida aberta não coberta com um curativo úmido, é a crosta que contrai. A crosta consiste principalmente de fibrina seca. Quando ela séca ela se contrai, e estando firmemente ancorada no tecido de baixo, ela pode reduzir a superfície de uma ferida pequena aberta.
Outro mecanismo de contração começa a acontecer após cerca de uma semana, é um estirão mecânico muito forte. Isso ocorre porque as feridas, abertas ou não, contém células capazes de contrair-se. Essas células são conhecidas por miofibroblastos.
2.2.3.3. Participação dos Miofibroblastos
Os miofibroblastos são fibroblastos que se diferenciam para agir na contração da ferida assumindo um fenótipo contrátil. Uma vez executado seu papel, eles se desdiferenciam e voltam a ser fibroblastos.
Se fibroblastos isolados tornam-se mais curtos, o tecido circundante não irá contrair de todo. Então, na diferenciação a miofibroblasto, eles desenvolvem estruturas peculiares que seriam esperadas de células desenhadas para puxar (GABBIANI apud MAJNO e JORIS, 1996). São elas: fibrilas intracelulares com densidade corpórea semelhante à músculos lisos; microtendões, nome que MAJNO e JORIS preconizam para feixes fibrosos que emergem das células, em continuidade a direção de fibrilas intracelulares ("fibronexus" é o nome oficial para esse arranjo); junções intracelulares de vários tipos, especialmente junções do tipo gap; que não são vistas habitualmente entre os fibroblastos ordinários. De fato, fibroblastos normais não estão em contato uns com os outros. Todas essas modificações levam o miofibroblasto a assemelhar-se, mas não a tornar-se, uma célula muscular lisa.
Os miofibroblastos são células intermediárias entre fibroblastos e células musculares lisas, porém o mecanismo de utilização de seu "maquinário contrátil" ainda não está inteiramente esclarecido. Eles parecem exercer esse estirão de duas diferentes maneiras (MAJNO e JORIS, 1996):
Os miofibroblastos alinham-se ao longo de novos depósitos de matriz extra celular no eixo axial da ferida, formando uniões de célula à célula e de célula à matriz para gerar posteriormente forças de tensão da ferida produzindo a contração de si mesma.
A reparação de mucosas é mais rápida que a de pele, mostrando que muitos dos relatos experimentais que foram realizados em pele devem ser extrapolados para outros locais com cuidado.
Observamos que a reparação tecidual envolve mecanismos complexos que abrangem eventos locais e sistêmicos; mecânicos, químicos e bioquímicos; onde interferem vários fatores como tipo de ferida, sua extensão, tipo e quantidade de células lesadas além de condições sistêmicas do paciente, bem como seu estado nutricional e imunológico. O laser de baixa potência portanto, tem diferentes ações segundo o momento da reparação e o tipo de paciente em que o estamos utilizando como terapia. Para analisarmos seus efeitos planejamos isolar parcialmente esses eventos, fazendo a revisão da ação do laser in vivo e in vitro, e buscando dessa forma elucidar o porque dessa terapia clinicamente manifestar-se por melhor tempo reparacional e melhor qualidade da cicatriz formada em pacientes submetidos a ela.
2.3. Revisão dos Efeitos do Laser na Cicatrização in vivo
2.3.1. Introdução
Os estudos in vivo em animais de laboratório bem como estudos clínicos em pacientes apoiam a teoria de que a regeneração tissular e a cicatrização de feridas são favorecidas quando tratadas com laser de baixa potência. Desde que MESTER (1966), nos anos 60, publicou seus primeiros resultados no tratamento de úlceras crônicas com laser de rubi operando em baixa intensidade de energia, foram publicados estudos e efeitos desse tipo de terapia com laser tanto em clínica humana como em animais, além de inúmeros trabalhos in vitro.
Ao princípio refletiam casos pontuais ou experiência de alguns poucos clínicos cuja casuística apresentada era pequena e pouco significativa. Além disso a metodologia empregada nesses estudos era de pouca qualidade científica e contestável em termos da casuística apresentada, havendo uma variedade enorme de parâmetros de irradiação e modelos de trabalho. Pouco a pouco foram aparecendo trabalhos seguindo uma metodologia mais adequada e homogênea além de parâmetros mais reproduzíveis e menos passíveis de contestação. Estudos a duplo cego e seguimentos a longo prazo começaram a dar mais qualidade e subsídio aos resultados obtidos nessas pesquisas.
A maioria das publicações in vivo apresentavam estudos em animais e humanos tratados com laser de baixa potência demonstrando sua ação sobre a síntese e remodelação de colágeno, número de fibroblastos, diâmetro e força de tração das feridas tratadas, viabilidade dos enxertos tratados, vascularização, vasodilatação, sistema linfático, efeito antibacteriano e imunológico, seus efeitos sistêmicos, e apenas alguns poucos estudos acerca da ação dessa terapia sobre o tecido periodontal, ou sobre sua ação diretamente em enfermidades associadas à prática odontológica (RIGAU, 1996).
MESTER produziu uma série de trabalhos desde meados da década de 60 (1966, 1969, 1971a, 1971b, 1971c, 1972, 1973a, 1973b, 1973c, 1974, 1975, 1977, 1978, 1982, 1984) até sua morte, em 1984 e concluiu que o laser de baixa potência acelerava a divisão celular. Observou em seus trabalhos feitos ao longo desses anos, um significativo aumento dos leucócitos que participavam na fagocitose e maior síntese de colágeno por parte dos fibroblastos tratados. Além disso observou que havia uma regeneração mais precoce de vasos linfáticos nos grupos tratados, o que o levou a concluir que facilitava o desenvolvimento do tecido de granulação.
O mais importante efeito do laser de baixa potência sobre a cicatrização de feridas foi o aumento da síntese de colágeno por parte dos fibroblastos, demonstrado nos experimentos onde monitorou-se essa síntese utilizando microscópio eletrônico para o controle da captação de prolina e glicina tritiada (RIGAU, 1996). Os efeitos observados fora da área tratada, foram atribuídos por MESTER (1974) e TRELLES (1983) a fatores humorais. Mediante esse importante postulado os autores preconizaram que no tratamento não seria necessário irradiar toda a área lesada para obter um efeito uniforme em toda a zona. Baseados nessa teoria, RODRIGO et al., em 1985, publicaram um estudo sobre o efeito do laser de He-Ne no tratamento de fístulas osteomielíticas múltiplas de ratos fêmeas, onde obtiveram a cura de todas elas no corpo, irradiando apenas uma única pata do animal.
Essa foi uma importante descoberta já que dessa forma surgiu uma possível resposta às dúvidas que apareceram quando equipes como as de KANA (1981), HUNTER (1984), BASFORD (1986) e SAPERIA (1986), em diferentes tipos de experimentos, não conseguiram resultados positivos na cicatrização de feridas padronizadas em animais de experimentação. Em todos esses experimentos, porém, os autores utilizaram o mesmo animal para estudar feridas irradiadas e não irradiadas. Ou seja, no mesmo animal utilizaram uma área com feridas não irradiadas como grupo controle e em outra área do mesmo animal, eram produzidas feridas que recebiam o tratamento e portanto eram irradiadas. Ainda assim, autores da equipe de SILVEIRA, pioneiro em pesquisas na área do laser de baixa potência no Brasil, em 1991, estudaram alguns aspectos do comportamento de mastócitos quando se irradiava cobaias com um diodo laser operando em 904 nm utilizando como modelo de estudo feridas em cobaias, sendo a ferida controle e a ferida irradiada no mesmo animal, e observaram que havia maior degranulação de mastócitos, além de maior proliferação fibroblástica e aumento da substância fundamental do tecido conjuntivo nas feridas irradiadas em relação as controle, mesmo estas sendo no mesmo animal.
Outro grande pesquisador nessa área foi ABERGEL e em 1988 ele e sua equipe fizeram um estudo sobre feridas padronizadas usando como modelo pele de porcos onde compararam o efeito do laser de He-Ne e de uma lâmpada de tungstênio sobre a cicatrização tecidual. Realizaram um seguimento fotográfico para verificação da força de tensão e da evolução do diâmetro da área da ferida tratada. Concluíram que houve resultado positivo de até 94% nas feridas tratadas com laser de baixa potência. Ainda assim, STRUBE et al. (1988), no mesmo ano, publicaram um artigo onde fizeram um experimento similar a esse e obtiveram resultados negativos. Outros autores como HALL et al., em 1994, e CHELYSHEV e KUBITSKY, em 1995, também não conseguiram observar nenhum tipo de efeito dessa terapia sobre a cicatrização tecidual, muito embora o primeiro autor trabalhasse com fluências extremamente inferiores àquelas preconizadas na literatura, e os segundos trabalhassem com regeneração de axônios mielinizados, modelo de estudo de natureza muito diferente àqueles preconizados e utilizados na literatura, desde a década de 60.
2.3.2. Estudos in vivo
2.3.2.1. Efeitos Sistêmicos
Vários autores como MARTINEZ et al. (1984), LEUNG et al. (1985), RODRIGO et al. (1985), SMITH-AGREDA et al. (1985; 1986), SARTI et al. (1995) e VILLAPLANA et al. (1995) têm estudado os efeitos do laser de baixa potência sobre as funções endócrinas, principalmente sobre células em cultivo e em tecidos de pequenos roedores. Esses estudos utilizavam lasers emitindo na região do visível, como o He-Ne, e lasers emitindo no infravermelho próximo, com diferentes comprimentos de onda, e em todos eles, nos grupos irradiados foram estimuladas as funções endócrinas e a divisão celular. Nos grupos irradiados as células tireoideanas e hipofisárias mostraram incremento de sua atividade após irradiação da adenohipófise. Esses resultados nos levam a deduzir os possíveis efeitos sobre glândulas secretoras. Esses autores recomendavam evitar a irradiação clínica em humanos diretamente sobre zonas glandulares, ainda que não houvesse nenhuma evidência clínica de que esse tipo de laser pudesse produzir hiperfunção glandular. Por isso, nos primeiros livros referentes à terapia com laser de baixa potência, autores como CISNEROS & TRELLES em 1987, sugeriam como contra-indicação, a irradiação clínica direta de glândulas.
Outro grande autor que vem contribuindo muito em esclarecer os mecanismos básicos de ação desse tipo de laser é ROCHKIND, que com outros autores em 1989 publicaram um estudo sobre os efeitos sistêmicos do laser de He-Ne comparando três diferentes tipos de modelos experimentais em rato. Observaram a evolução de feridas cutâneas provocadas por queimaduras padronizadas, por injúria do sistema nervoso periférico e por injúria do sistema nervoso central nesses animais. Dividiram esses três modelos em dois grupos. Os animais receberam duas feridas, uma de cada lado da espinha dorsal. Um grupo foi o controle e não recebeu irradiação laser e o outro grupo recebeu irradiação apenas em uma das feridas. Ambas feridas, irradiada e não irradiada, foram curadas em tempo significativamente inferior quando comparadas ao grupo controle não irradiado e não apresentaram diferença estatisticamente significante entre si. Os mesmos autores descreveram os efeitos positivos e sua persistência a longo prazo. Também demonstraram efeitos negativos quando se utilizou alta irradiância (200 mW/cm2).
Nessa mesma época, TRELLES et al. (1988) publicaram um estudo feito em sangue e línguas pulverizadas de rato, que haviam sido irradiadas com fluência de 2,4 J/cm2. Eles analisaram os níveis de histamina detectados em ambos modelos. Utilizaram dois protocolos: no primeiro trabalharam com um laser de 4 mW de potência de saída e no segundo com um laser de 50 mW. Em sangue não observaram alterações significativas entre os grupos irradiados e controle. Em língua, entretanto, o grupo irradiado com laser de 50 mW de potência de saída apresentou aumento de 30% de histamina em relação ao grupo controle, e no grupo irradiado com laser de 4 mW obteve-se aumento de 100% no nível de histamina em relação ao grupo controle.
Com base nesses resultados, os mesmos autores (TRELLES, 1989a e 1989b) realizaram um seguimento microscópio, com cortes semifinos e a nível ultraestrutural de línguas de rato irradiadas, e observaram degranulação de mastócitos significativamente aumentada nos grupos irradiados.
Em 1990, EL SAYED e DYSON realizaram um estudo em pele sã e lesada utilizando lasers emitindo seis diferentes comprimentos de onda com fluência de 10,8 J/cm2. Fizeram um seguimento observando a degranulação e o número de mastócitos nesses grupos. Demonstraram que em pele sã e irradiada, produziu-se um aumento do número de mastócitos porém sem sua degranulação. Em pele lesada, produziu-se um aumento do número de mastócitos bem como sua respectiva degranulação.
Os parâmetros de trabalho dos grupos foram diferentes. A equipe de El Sayed utilizou fluência 4 vezes maior que a equipe de TRELLES e ambos utilizaram diferentes técnicas para análise dos mastócitos. O modelo também influenciou bastante, já que o primeiro foi em mucosa enquanto que o segundo foi em pele, e ambos são muito heterogêneos do ponto de vista óptico. Também utilizaram irradiâncias diferentes, fato esse que foi significativo inclusive entre os diferentes grupos irradiados no primeiro experimento do grupo de TRELLES. Em 1996, RIGAU, da equipe desse autor, observou a respeito desses experimentos, que os mastócitos e os mediadores biologicamente ativos que são liberados durante a degranulação, são elementos chave durante a primeira fase inflamatória da cicatrização de feridas, tanto no papel que desempenham na permeabilidade vascular como na liberação de substâncias que influenciam na regulação da migração linfocitária e na adesão molecular das células endoteliais a partir dos capilares venosos. Também observou sua importância nos processos imunológicos à nível cutâneo, como demostrado nos experimentos de KAMINER et al., 1991; VAN NESTE, 1991 e REICH et al., 1991.
Em 1997, SASAKI e OHSHIRO fizeram um estudo sobre os efeitos de um diodo laser operando em 830nm na reparação tecidual utilizando modelo em pele de ratos. Utilizaram 20 animais onde fizeram feridas padronizadas e irradiaram com laser de 60 mW de potência de saída com fluência de 24 J/cm2, diariamente, durante 7 dias. Avaliaram alterações de citocinas, particularmente a interleucina-6 (IL-6), por ser a mais típica e a de mais fácil detecção. Os autores observaram que houve diferença significativamente maior na quantidade de citocinas no grupo irradiado, sobretudo no pós-operatório de 2 dias, além de histologicamente haver um melhor controle inflamatório. Também observaram que nos grupos irradiados houve grande número de neutrófilos e que apareceram mais cedo nos tecidos subcutâneos em relação ao grupo controle, e que igualmente desapareceram mais rapidamente. Os autores concluíram que o laser de baixa potência induziu mais rapidamente à fase proliferativa e aumentou os níveis de IL-6.
Em 1999, STADLER et al., estudaram os efeitos sobre linfócitos de um laser de Argon:Dye emitindo na região do visível e operando em 660 nm e de um diodo laser emitindo na região do infravermelho próximo operando em 830 nm. Os autores irradiaram linfócitos em suspensão com fluências diferentes, variando entre 0 e 5 J/cm2, na presença e ausência de eritrócitos. A irradiação com o primeiro diodo laser, na presença de eritrócitos, aumentou significativamente a resposta de proliferação dos linfócitos, sendo a resposta máxima detectada com fluência de 3 J/cm2. Para o segundo diodo laser, o máximo de interação ocorreu com fluência de 1,5 J/cm2. Os autores observaram que na ausência de eritrócitos, o efeito da irradiação mostrou uma fraca relação dose-resposta.
2.3.2.2. Efeitos Locais
Em 1982, DYSON e YOUNG demonstraram que um diodo laser emitindo na região do infravermelho próximo e com radiação pulsada e freqüência de 700 Hz acelerou a formação de tecido cicatricial enquanto que o mesmo diodo laser, com freqüência de 1200 Hz, não demonstrou ser efetivo quando não houve alteração em nenhum outro parâmetro de irradiação.
Em 1984, TRELLES e MESTER, publicaram um estudo clínico em pacientes portadores de úlceras vasculares de membros inferiores, onde as irradiaram com laser de He-Ne com fluência de 4 J/cm2. Os autores realizaram um seguimento fotográfico e à nível microscópico da evolução dessas feridas, observando melhor evolução do tecido de granulação, bem como da neo-vascularização e da epitelização dos grupos tratados com laser em relação aos grupos controles.
Em 1987, ABERGEL et al. publicaram um estudo dos níveis intracelulares de RNAm-procolágeno tipo I e tipo III presentes em feridas irradiadas com laser de He-Ne, comparando um grupo controle e um grupo irradiado com uma luz de tungstênio. Após 10 dias de tratamento não foram observadas alterações significativas. Aos 17 dias observou-se uma diferença no RNAm-procolágeno tipo I que aos 28 dias foi estatisticamente significativa. O RNAm-procolágeno tipo III aumentou aos 10 dias e foi significativo aos 17 e 18 dias.
Em 1988, TERRIBILE et al. fizeram um estudo utilizando um laser de He-Ne e um diodo laser emitindo no infravermelho próximo onde apresentaram um seguimento analisando o diâmetro das feridas, o material depositado no fundo e na superfície delas, seu grau de contração e de repitelização, a presença de fibras reticulares, de colágeno e elastina, além de material PAS positivo (presença de glicosaminoglicans) que foi produzido. Concluíram que tanto o laser de He-Ne como o diodo laser levaram a uma diminuição do tempo de epitelização e houve aparecimento mais precoce de material PAS positivo, favorecendo a cicatrização.
Em 1989, YEW et al. estudaram, por meio de microscopia de transmissão, a cicatrização em anastomoses intestinais tratadas com laser de He-Ne. Concluíram que houve maior síntese de colágeno nas suturas dos animais dos grupos tratados com laser.
Em 1989, BIHARI. e MESTER apresentaram um estudo clínico em pacientes portadores de úlceras. Os autores trabalharam com três grupos. Um grupo foi irradiado com laser de He-Ne, outro com a associação de laser de He-Ne e um diodo laser emitindo na região do infravermelho próximo e outro com uma luz não-coerente, cujo comprimento de onda foi de 632 nm. Em todos os grupos a fluência utilizada foi de 4 J/cm2. Os autores demonstraram a eficácia terapêutica da associação dos diferentes tipos de lasers, que demonstraram melhores resultados quando comparados aos demais grupos.
Em 1989, o filho de Endre Mester, Andre MESTER, que após a morte de pai manteve sua linha de pesquisa, publicou um seguimento clínico de 2167 pacientes portadores de úlceras cutâneas ou de mucosas, confirmando que a fluência ideal para a terapia desse tipo de úlceras era de 4 J/cm2, fluência essa que já havia sido preconizada como ideal por seu pai em 1966 (MESTER, 1966).
Em 1990, ENWEMEKA et al. realizaram um seguimento da cicatrização de tendões de Aquiles após sua incisão cirúrgica. A irradiação realizou-se transcutaneamente, com laser de He-Ne. Os autores observaram o número de fibroblastos e de fibras colágenas e concluíram que foram mais abundantes e seguiram um bom alinhamento no eixo longitudinal nos tendões irradiados em relação aos controles não irradiados.
Em 1991, TSUCHIDA et al. trataram feridas cirúrgicas de ratos normais e diabético-induzidos com laser de He-Ne com scanner e com fluência de 4 J/cm2. Fizeram um estudo do seguimento da velocidade de fechamento dessa feridas e observaram que as feridas tratadas com laser fecharam antes, tanto nos animais normais como nos diabéticos, quando comparados a seus respectivos grupos controles.
Em 1991, outro grande pesquisador dos mecanismos básicos da ação desses tipos de lasers, LIEVENS, publicou um de seus belos experimentos onde estudou o seguimento da cicatrização de feridas, avaliando o nível de adesão a planos inferiores, o grau de edema local, bem como a regeneração do sistema venoso e linfático. Após a análise detalhada dos resultados concluiu que a adesão após quatro dias da implantação da ferida foi de 100% nos grupos controle não irradiados, enquanto que nos grupos irradiados não foi significativo. Após 8 dias o edema havia desaparecido nesses grupos, persistindo naqueles. Seis meses depois, a permeabilidade dos vasos sangüíneos e linfáticos foi de 50% à mais nos irradiados em relação aos controle. RIGAU, em 1996, sugeriu que a explicação disso seria pela resposta diferenciada dos mastócitos presentes nos tecidos irradiados com laser de baixa potência.
Em 1991, IN DE BRAEKT et al. provocaram feridas em palato de cães da raça beagle e tatuaram pontos de ambos os lados das feridas para observar seu grau de contração durante a cicatrização. Usaram um diodo laser emitindo no infravermelho próximo com fluência de 1 J/cm2. Fizeram a irradiação três vezes por semana, durante três semanas, e não observaram alterações significativas em relação ao grupo controle não irradiado.
Em 1992, TERRIBILE et al. estudaram a evolução de feridas padronizadas em dorso de ratos fêmeas tratados com um laser de He-Ne e uma luz halógena não coerente, que foi filtrada para obter o comprimento de onda de 633 nm. Utilizaram fluência de 3,6 J/cm2. Observaram que a velocidade de fechamento da ferida foi muito maior e estatisticamente significativa nos grupos irradiados com luz coerente (laser de He-Ne) em relação aos grupos controle e irradiados com luz não coerente.
Em 1992, SMITH et al. fizeram um estudo em pequenos roedores onde controlaram a sobrevivência de retalhos comparando a utilização de um diodo laser e uma luz não coerente. A irradiação foi feita sobre a área receptora, cinco dias antes de receber o retalho e cinco dias após a intervenção cirúrgica. Não observaram alterações significativas.
Ainda em 1992, KUSAKARI et al., estudaram os efeitos do laser de baixa potência em cicatrização de gengiva e na reparação óssea. Pela primeira vez foi publicado um artigo in vivo específico em odontologia. Os autores fizeram o estudo em duas partes. Na primeira fizeram um seguimento in vivo e outro in vitro. Trabalharam com cães adultos, onde fizeram perfurações mandibulares e as irradiaram. In vitro trabalharam com osteoblastos da linhagem UMR 106 em cultivo e incorporaram timidina tritiada, após a irradiação. Para ambos experimentos utilizaram um diodo laser operando em 780 nm e com potência de saída de 30 mW. Na segunda parte do estudo, removeram dentes de cães adultos e implantaram cilindros de titânio, irradiaram os animais com um diodo laser operando em 810 nm e com potência de saída de 60 mW. Observaram que o laser estimulou a síntese de DNA e a expressão de ALP-atividade nas células osteoblásticas in vitro. In vivo observaram que os grupos irradiados tiveram maior recobrimento na perda óssea, além de melhor cicatrização gengival.
Em 1993, LEE e KIM fizeram feridas em ratos e injetaram Stafilococcus aureus para contaminá-las. Um grupo recebeu tratamento dessas feridas que foram irradiadas com um diodo laser emitindo na região do infravermelho, enquanto que o grupo controle não recebeu nenhum tipo de tratamento. Os autores observaram uma boa evolução das feridas tratadas em comparação aos grupos controles.
Em 1994, NOGUEROL et al. estudaram as alterações ultraestruturais periodontais em ratos após sua irradiação com um laser de He-Ne, por meio de microscopia eletrônica de varredura. Os animais foram divididos em três grupos: um irradiado com fluência de 10,5 J/cm2, outro irradiado com fluência de 51,5 J/cm2, e outro controle não irradiado. Os animais foram sacrificados imediatamente e aos 10 dias após a irradiação. Os autores observaram que nos grupos irradiados com fluências mais altas, houve maiores alterações celulares no epitélio, duas diferentes populações de fibroblastos presentes no tecido conjuntivo bucal, além de duas diferentes subpopulações de osteócitos.
Em 1994, ZHANG e AL-WATBAN publicaram um estudo em ratos onde fizeram feridas padronizadas para comparar a cicatrização de feridas tratadas com laser de He-Ne e de He-Cd (l = 442 nm), utilizando fluências variáveis de 1, 4, 7 e 11 J/cm2, com irradiações 3 vezes por semana. A cicatrização foi mais rápida e de melhor qualidade para os grupos tratados com o laser de He-Ne. Os autores observaram que esse comprimento de onda apresentou maior penetração e transmissão e menor absorção e espalhamento (scattering) que o comprimento de onda emitido pelo laser de He-Cd. No mesmo ano (AL-WATBAN e ZHANG, 1994) os autores trabalharam com esse mesmo modelo animal, e utilizaram um laser de He-Ne, porém com diferentes parâmetros de irradiação para os grupos tratados. As irradiações variaram entre 3 e 5 tratamentos por semana, a fluência utilizada foi de 25 J/cm2 para um grupo e de 7 J/cm2 para outro grupo. Observaram que variando a irradiância (de 3,7 a 15,9 mW/cm2) enquanto mantinham a fluência constante, não havia alteração significativa. Os resultados mostraram ser dependentes da fluência e freqüência do tratamento. Quando o tratamento foi dado por mais de 5 dias numa mesma semana, obteve-se um efeito inibitório sobre a cicatrização. No ano seguinte, em 1995, os autores publicaram um estudo baseado num protocolo parecido ao anteriormente relatado, porém utilizaram um laser de Argônio, operando com baixa intensidade de energia. Observaram um efeito inibitório desse laser quando utilizaram alta fluência (de 130 a 150 J/cm2) na irradiação (AL-WATBAN e ZHANG, 1995). Um ano depois, ainda seguindo essa linha de pesquisa, AL-WATBAN e ZHANG (1996) fizeram um estudo com o mesmo modelo animal utilizando lasers emitindo diferentes comprimentos de onda. Usaram diferentes lasers: laser de He-Cd (l = 442 nm), Argônio (l = 488 e l = 514 nm), He-Ne (l = 632,8 nm) e dois diferentes diodos lasers de As-Ga-Al (l = 780 nm e l = 830 nm). Para todos eles trabalharam com uma fluência de 20 J/cm2. Observaram que houve diferença significativa entre os grupos controle não irradiados e os irradiados. Entre os laseres utilizados, o laser de He-Ne foi o mais efetivo. Ainda em complementação, os autores fizeram a monitoração da temperatura durante a irradiação com os diferentes tipos de laser, porém não houve alteração significativa dela em nenhum grupo irradiado quando comparado ao controle.
Em 1995, KAMEYA et al. apresentaram um estudo em ratos onde irradiaram feridas padronizadas nesses animais com diodos lasers emitindo diferentes comprimentos de onda (l = 632,8; 680; 830 nm). Observaram diferenças macroscópicas significativas nos grupos irradiados em relação aos controle, embora não fossem estatisticamente significante entre os diferentes grupos irradiados. Histologicamente observaram que os três grupos irradiados apresentaram maior proliferação de tecido conjuntivo e maior presença de vasos sangüíneos quando comparados aos grupos controle.
Em 1995, GÓMEZ-VILLAMANDOS et al. apresentaram um bonito estudo feito em eqüinos, onde por via fibroendoscópica, trataram lesões ulcerosas na mucosa respiratória desses animais com um laser de He-Ne. Observaram que a cicatrização aconteceu mais rapidamente nos animais tratados com laser e que, histologicamente, o tecido estava melhor vascularizado, com menos edema e com tecido conectivo mais ativo quando comparados aos grupos controle.
Em 1996, EL SAYED e DYSON estudaram os efeitos do pulso de repetição e a importância do seu tempo de duração, com um diodo laser operando em 820 nm, sobre mastócitos de ratos. Os autores queriam determinar os parâmetros ideais de uso desse tipo de laser para aumentar o número de mastócitos locais bem como sua degranulação. Para isso usaram um mesmo comprimento de onda com diferentes freqüências de pulso, em modelo de feridas padronizadas em pele de rato. Verificaram que o aumento do número de mastócitos não dependeu da freqüência de pulso, porém a degranulação sim.
Em 1997, GÓMEZ-VILLAMANDOS et al., seguindo sua linha de pesquisa em eqüinos, fizeram um estudo sobre os efeitos do laser de He-Ne e de um diodo laser de As-Ga operando em 904 nm na cicatrização de lesões superficiais em mucosa de cavalos. Os autores produziram feridas padronizadas e as irradiaram com aplicações diárias, durante 15 dias, com fluência de 8 J/cm2. Os resultados micro e macroscópicos mostraram que nos grupos irradiados, além dos animais apresentarem cicatrização mais rápida, nenhum animal desenvolveu infecção, fato esse evidenciável em 70% dos animais dos grupos controle.
Em 1997a, WEI YU et al., utilizaram um laser de Argônio operando em 630 nm sobre feridas padronizadas em ratos geneticamente diabéticos para verificação de seus efeitos na cicatrização. Os autores dividiram os animais em 4 grupos. O grupo 1 foi utilizado como controle negativo, o grupo 2 como controle positivo (foi aplicado topicamente fator de crescimento fibroblástico local - bFGF sobre a ferida), o grupo 3 foi irradiado com laser e no grupo 4 foi utilizada a associação laser de baixa potência e aplicação tópica de bFGF. Para a análise dos resultados foi utilizada a evolução histológica e a velocidade de fechamento da ferida. Os autores observaram que clinicamente os grupos que tiveram as feridas fechadas mais rapidamente foram aqueles que receberam apenas irradiação laser, e histologicamente os animais desses grupos tiveram melhor e mais rápida epitelização, bem como formação de tecido de granulação e deposição de colágeno.
No mesmo ano, TANG et al. estudaram as alterações morfológicas que ocorreram em fibras de colágeno de ratos tratados com diodo laser operando em 830 nm. Trabalharam com fluência variável, de 400 a 550 J/cm2 e irradiância fixada em 250 W/cm2. Os autores observaram, por meio de microscopia óptica e de elétrons, alterações morfológicas nas fibras de colágeno dos animais irradiados. Os autores concluíram que essa alteração da morfologia espacial das fibras poderia explicar parcialmente a ação do laser de baixa potência na cicatrização tecidual.
Em 1998, REDDY et al., fizeram um estudo sobre os efeitos da foto-estimulação laser sobre a produção de colágeno em tendão de Aquiles de coelhos. Os autores lesaram esses tendões e imobilizaram as patas dos animais com talas de poliuretano. O tratamento foi feito com laser de He-Ne, com aplicações diárias, usando fluência de 1 J/cm2 durante 14 dias consecutivos. As análises bioquímicas dos tendões revelaram 26% de aumento na concentração de colágeno, indicando um processo de cicatrização mais rápido dos tendões dos animais irradiados, quando comparados aos do grupo controle não irradiado.
Em 1998, MORRONE et al., publicaram um estudo sobre a ação de um diodo laser de Ga-Al-As sobre trauma muscular. Os autores prensaram músculos de pata posterior de coelhos adultos e irradiaram com um diodo laser operando em 780 nm, com diferentes parâmetros de irradiação. Os animais foram divididos em 4 grupos. O grupo 1 foi usado como controle, o grupo 2 foi tratado com fluência de 150 J/cm2 e freqüência de 50 Hz, o grupo 3 foi tratado com fluência de 250 J/cm2 e freqüência de 100 Hz e o grupo 4 foi tratado com fluência de 800 J/cm2 com radiação contínua. A avaliação histológica e histomorfométrica do dano muscular e da cicatrização tecidual demonstrou melhor qualidade e quantidade do processo reparacional nos animais dos grupos irradiados. O grupo onde se obteve os melhores resultados foi aquele irradiado com 800 J/cm2 e com radiação contínua.
Em 1998, LOWE et al. estudaram a ação de um diodo laser operando em 890 nm sobre a cicatrização de feridas padronizadas em dorso de rato. Os autores trabalharam com fluências de 0,18, 0,54 e 1,45 J/cm2. As áreas foram analisadas por sistema de imagem por meio de vídeo e os autores não observaram efeitos estimulativos nos animais irradiados em relação aos do grupo controle, sendo que no grupo irradiado com fluência de 1,45 J/cm2 houve significativa inibição do processo cicatricial aos 16 dias da primeira irradiação.
Em 1999, ALMEIDA-LOPES et al. apresentaram um estudo clínico em pós-operatório de 150 pacientes submetidos a cirurgia oral menor, repetindo o mesmo protocolo de um estudo in vitro que haviam publicado anteriormente (ALMEIDA-LOPES et al., 1998b). Os pacientes foram divididos em três grupos: um controle não irradiado, um irradiado com um diodo laser operando em 635 nm e outro com um diodo laser operando em 780 nm. As irradiações foram feitas no pós-operatório imediato, aos 7 dias e 14 dias após intervenção cirúrgica, quando necessário. A fluência utilizada foi de 2 J/cm2. Os grupos irradiados apresentaram cicatrização significativamente mais rápida além de qualidade estética superior quando comparados ao grupo controle. Não houve diferença significativa entre os grupos irradiados com diferentes comprimentos de onda.
2.3.2.3. Efeitos Vasculares
Microcirculação
Foi demonstrado que o laser de baixa potência aumentava o grau de vascularização do tecido neoformado, quando se irradiava feridas em processo de cicatrização.
Em 1982, BENEDICENTI demonstrou que o fluxo de sangue em capilares mesentéricos aumentou após a irradiação com um diodo laser operando em 904 nm, fenômeno esse confirmado em 1984 por MIRÓ et al. que utilizaram como modelo de estudo o leito de unha e irradiaram com um diodo laser de As-Ga, observando que a circulação da região aumentou após a irradiação. O incremento do fluxo sangüíneo continuou durante 20 minutos após cessar a irradiação com laser, inclusive quando a área alvo foi esfriada. Em 1983, TRELLES et al. publicaram um experimento realizado em olho de coelho onde novamente foi confirmado esse fenômeno. Resultados similares foram obtidos em 1984 por MAYAYO e TRELLES, quando irradiaram mucosa anal de ratos. Nesses experimentos o esfíncter final dos capilares foi o primeiro a responder e a resposta dependeu da severidade da lesão na microcirculação.
MIRÓ concluiu que a vasodilatação e o aumento da microcirculação são resultados de um aumento do metabolismo tecidual e da normalização da homeostase.
Fluxo Linfático
LIEVENS foi um autor que trabalhou bastante no tema de efeitos do laser de baixa potência na atividade do sistema linfático. Publicou vários trabalhos bastante elucidativos nessa área (1986, 1988, 1990). Em 1991, o autor publicou um estudo grande com 50 animais, onde fez incisões na região abdominal de ratos e as irradiou com um laser de He-Ne e um diodo laser de As-Ga operando em 904 nm. Avaliou a adesão pós-cirúrgica, o edema local e a regeneração de veias e de vasos linfáticos da região mesentérica. Observou que ao irradiar essa região com laser, o fluxo linfático instalou-se rapidamente. A regeneração dos vasos linfáticos nos animais tratados com laser foi mais rápida que nos do grupo controle não irradiado. No primeiro grupo estava completa aos 9 dias, enquanto que o grupo controle apresentou regeneração incompleta ainda aos 55 dias após a cirurgia. O autor também observou uma neovascularização formada significativamente mais rápida nos animais tratados, que se deu em menos da metade do tempo que nos animais do grupo controle. A adesão peritoneal foi escassa nos grupos tratados com laser, enquanto que foi comum nos grupos controle.
Em 1986, LABAJOS observou que após a irradiação do intestino de ratos com um diodo laser de As-Ga emitindo no infravermelho próximo, com fluência de 1J/cm2, o fluxo de água e eletrólitos através da parede do intestino dos animais do grupo irradiado foi retardado simultaneamente com um incremento do potássio intracelular.
Imunidade
MESTER et al., em 1977 num estudo sobre cicatrização de feridas e TRELLES em 1986, num estudo sobre ação do laser de He-Ne sobre herpes genital, especularam que esse tipo de laser poderia agir sobre a função imunológica, envolvendo principalmente os leucócitos que incrementariam a fagocitose.
As publicações que analisam estudos com esse tipo de laser envolvendo vírus e bactérias ainda causam controvérsia e são pouco esclarecedoras. O laser de baixa potência atua como tratamento efetivo na prevenção dessas infecções in vivo como demonstrou TRELLES em 1986 em tratamento de pacientes com surto de herpes genital que foram irradiados com laser de He-Ne, ou desse tipo de tratamento associado com acyclovir em herpes labial e facial, como demonstrou VÉLEZ-GONZÁLEZ et al., em 1994 num estudo clínico feito em 60 pacientes, onde trataram um grupo com laser de He-Ne, outro com associação de laser de He-Ne e acyclovir e outro somente com acyclovir. Os autores obtiveram melhores resultados nos grupos tratados com a associação de laser de He-Ne e acyclovir. Também outros autores demonstraram a efetividade desse tratamento na prevenção de nevralgias pós-herpéticas, como IIJIMA, que em 1991 apresentou um estudo com 18 pacientes portadores desse tipo de alteração, e tratou-os com laser de He-Ne, obtendo resultados favoráveis.
Entretanto quando observamos estudos in vitro, verificamos que o laser de baixa potência pode estimular o crescimento ou virulência de bactérias e vírus em cultivo ou cultura. GILIOLI et al., em 1985 estudaram os efeitos de um diodo laser de As-Ga em HSV1 e HSV2 in vitro e observaram que esses vírus foram estimulados pela ação desse laser. Em 1987, RUBENSTEIN publicou um trabalho com 57 pacientes portadores de lesões ulcerativas vulvares induzidas por papiloma vírus (HPV). Ele fez sua remoção com laser cirúrgico de CO2 e irradiou o leito cirúrgico com um diodo laser emitindo na região do infravermelho próximo, com potência de saída de 25 mW, duas vezes por semana, com irradiância de 22 mW/cm2. Obteve resultados benéficos significativos, ao redor de 45%, nos casos assim tratados.
Esse assunto ainda é muito polêmico, porém autores como Trelles, 1986; Túner e Hode, 1996; e VÉLEZ-GONZÁLEZ et al., 1994; entre outros, atribuem esse efeito antiviral do laser de baixa potência, que se demonstra in vivo, presumidamente ao efeito estimulativo do sistema imunológico local e sistêmico.
Em 1985, RUFFOLO, publicou um trabalho onde utilizou o laser de baixa potência em tratamento de leucoplasias para alívio de sintomas daqueles pacientes que os apresentavam. O autor obteve bons resultados comentando que essa condição de normalização da área afetada seria devido a estimulação da imunidade local desses pacientes.
MAYAYO e TRELLES, em 1986 publicaram um artigo sobre laser de baixa potência e imunidade, onde trabalharam com ratos portadores de aplasia tímica e os induziram à septicemia. Irradiaram os animais a cada dois dias, com fluência entre 2 e 4 J/cm2. Os animais que receberam irradiação sobreviveram mais tempo que os do grupo controle que não receberam irradiação. No mesmo ano, COBO PLANA et al. (1986) apresentaram um estudo sobre o uso do laser de baixa potência na profilaxia da osteorradionecrose manipular. Os autores mostraram que utilizando um diodo laser operando em 904 nm, com fluência de 2 J/placa, diminuiu o crescimento de bactérias in vitro. Com um laser de He-Ne, com a mesma fluência, não houve alterações nessas placas. Em 1987, CARRILLO et al., fizeram um estudo in vitro sobre o crescimento de uma cepa de Stafilococus aureus, onde utilizaram um laser de He-Ne com fluências de 0,3 J/cm2 e 0,6 J/cm2. Os autores não observaram nenhum crescimento significativo.
Em 1991, SKOBELKIN et al., apresentaram um estudo clínico de pacientes oncológicos, que visava a ativação do seu sistema auto-imune como preparo pré-operatório. Foi um estudo envolvendo 60 pacientes onde os autores propuseram que essa terapia poderia ser utilizada como coadjuvante em pacientes portadores de imunodeficiências. Os pacientes foram divididos em quatro grupos e irradiados no pré-operatório imediato. Um grupo foi controle, outro irradiado transcutaneamente (sobre linfonodos) com um diodo laser operando em 890 nm, outro irradiado internamente com laser de He-Ne, e outro com uma associação de ambos métodos de irradiação. Os estudos avaliaram componentes de células brancas do sangue, ensaios de atividade imunoglobulínica (IgA, IgM e IgG) além de determinação do comportamento de frações de linfócitos T. Essa avaliação foi feita antes e depois das irradiações. Os autores observaram que a resposta imunológica dos pacientes irradiados foi significativamente aumentada em relação aos do grupo controle.
Em 1995, FILONENKO estudou os efeitos do laser de baixa potência na defesa imunológica específica e não específica. Utilizaram esse tratamento como prevenção de complicações pós-cirúrgicas em alterações de joelho e em pós-operatórios de liffting facial cirúrgico.
Em 1997b, WEI YU et al., estudaram a ação de um laser de Argon:Dye operando em 630 nm em ratos portadores de septicemia crônica. Os autores queriam verificar se o laser de baixa potência tinha efeito estimulativo na resposta autoimune em septicemia, usando modelo animal. Os autores abriram a cavidade abdominal de ratos e os submeteram à cirurgia. A irradiação foi feita no pós-operatório imediato com fluência de 5 J/cm2. Num experimento a parte, linfócitos de ratos normais in vitro foram utilizados para verificação dos efeitos bioestimulativos do laser. Os autores observaram in vivo que o laser de baixa potência aumentou significativamente a proliferação de linfócitos nos ratos com septicemia bem como o tempo de sobrevivência desses animais quando comparados aos do grupo controle não irradiado. Os autores verificaram in vitro que o laser de baixa potência estimulou significativamente a proliferação de linfócitos na presença de estímulo mitogênico e aumentou a síntese de ATP linfocitária. Concluíram que a irradiação laser aumentou a resposta imunológica e a sobrevivência dos ratos com septicemia.
Pelos trabalhos até aqui revisados observamos que a ação do laser de baixa potência na cicatrização tecidual in vivo depende de mecanismos complexos envolvendo eventos celulares e humorais. Para analisar esses eventos individualmente, fizemos a revisão da ação do laser de baixa potência in vitro, sobre as principais células envolvidas no processo de cicatrização.
2.4. Revisão dos Efeitos do Laser na Cicatrização in vitro
2.4.1. Cultura de Células
O estudo in vitro utilizando cultura de células tem sido muito usado devido à facilidade de padronização da amostra, cujo controle de pH, temperatura, pressão osmótica, tensão de CO2 e de O2 podem ser obtido de maneira precisa, além de conseguir-se amostras totalmente homogêneas. As desvantagens desse método de estudo são, por exemplo, a necessidade de trabalhar-se em ambiente estéril e asséptico, o que limita algumas vezes seus protocolos. Além disso exige uma certa prática por parte do pesquisador. Além disso a quantidade de material obtido em cultura é bastante pequeno; ainda assim o custo de um experimento feito com célula em cultura é muito maior que o mesmo feito em animais (FRESHNEY, 1990).
MENEGAUX et al. (1934) apud KAWAHARA et al. (1968), relatam que o primeiro estudo in vitro sobre materiais implantados foi realizado em medicina na área de ortopedia. Em odontologia foram realizados estudos in vitro utilizando cultura de células por KAWAHARA et al. (1955) e Grant (1955) apud KAWAHARA et al. (1968) para avaliar a citotoxidade de materiais dentários.
Através da observação da morfologia celular, efeitos na membrana, atividade celular e índice de proliferação, pode-se avaliar o dano celular. Em 1959, BERGMAN apud SPANGBERG (1969) introduziu o método de contagem celular e de número de mitoses para avaliação do dano celular, onde mistura-se a suspensão celular e a solução teste em uma câmara de cultura apropriada. Esta consiste de um anel de vidro fixada a uma lâmina. Após a fixação e coloração da cultura as células e mitoses são contadas.
Outros métodos de avaliação do dano celular foram propostos. Em 1965, GUESS et al. apud SCHMALZ (1994) relataram que efeitos de membrana poderiam ser demonstrados pelo vermelho neutro, que é armazenado em células viáveis e liberado no meio circundante após dano celular. Esse método porém é considerado subjetivo.
SPANGBERG, em 1973, para avaliação da citotoxidade do material, introduziu o método da mensuração da liberação de um isótopo radioativo incorporado no interior das células (cromo radioativo - 51Cr), baseado no dano celular após contato direto material-célula. Para avaliação quantitativa do dano celular, é usada a liberação de marcadores radioativos de células alvos. Após a exposição a materiais tóxicos, ocorrerá dano celular e a liberação de DNA marcado pode ser medida para indicar o dano celular. Esse método tem sido amplamente utilizado como teste de avaliação para muitos materiais dentários, cujas vantagens são ser um método rápido, altamente sensível, que possibilita adequado contato material-célula e permite quantificação objetiva do dano celular com boa precisão.
Em 1980, a Federação Dentária Internacional recomendou que a avaliação da toxidade de materiais dentários fosse feita segundo níveis biológicos, ou seja, testes iniciais, testes secundários e, finalmente, testes de uso.
De acordo com SCHMALZ (1994), outros métodos basearam-se na exclusão do corante Azul de Trypan, o qual penetra nas células mortas, com lesão da membrana celular, enquanto isso não ocorre nas células vivas, que apresentam membrana íntegra.
Em 1990, POLLARD sugeriu que a determinação do número celular fosse realizada usando-se um contador eletrônico de partículas ou através de um hemocitômetro. O primeiro método é mais preciso e pode ser usado para contar baixas concentrações celulares. O segundo requer maior densidade celular e é mais propenso a erro de amostragem. Entretanto permite uma estimativa visual do estado das células e pode ser usado para estimar a viabilidade celular quando combinado com a exclusão do corante azul de Trypan. Para a contagem, as células são ressuspendidas e diluídas em azul de Trypan. Uma gota de suspensão celular é adicionada aos dois lados do hemocitômetro; isso é feito para determinar a viabilidade celular, já que o número de células que não se coram são aquelas que apresentam a membrana intacta.
No mesmo ano, Baserga relatou que células em cultura podiam crescer por aumento no tamanho da célula ou por aumento de seu número. A contagem de células em uma placa de Petri nos diz quanto a população celular cresceu, porém não informa se as células estão ou não proliferando. Quando desejamos determinar o efeito de qualquer alteração da proliferação celular no meio de cultura, ou seja, sua capacidade de estimular ou inibir a divisão celular, o método mais indicado é contar o número de células antes e após o tratamento, de preferência a cada 24 horas. Para indicar se uma população celular está crescendo ou não, o melhor parâmetro é contar o número de células por placa de cultura.
Em 1996, CIAPETTI et al. afirmaram que os métodos que empregam a incorporação de nucleotídeos, ainda que sejam sensíveis, apresentam desvantagens como uso de equipamentos e sala específicos, perigo de manuseio dos marcadores radioativos, bem como geração de resíduos radioativos.
A citotoxidade de materiais dentários in vitro, segundo MJÖR et al. (1985) foi avaliada por meio de medidas de crescimento celular, alterações na permeabilidade da membrana, alterações metabólicas ou alterações citopáticas. Alguns métodos avaliam a citotoxidade por dois ou mais desses parâmetros associados.
Em 1998, DANIEL esclareceu que três testes utilizados para avaliar a citotoxidade são baseados em alterações na permeabilidade da membrana (teste do revestimento com ágar; teste da liberação de 51Cr) e em alterações metabólicas combinadas com um corante celular e microscópio (teste do filtro Millipore). O método da liberação do 51Cr, além de uma área de trabalho estéril e incubadora com controle de ar, umidade e temperatura, requer um espectômetro gama ou um contador de cintilação líquida e um sistema de distribuição de resíduos radioativos. Se a substância teste tem a capacidade de precipitar proteínas, esse método pode indicar um resultado falso, dando uma baixa liberação de 51Cr. No método do revestimento com ágar o material é colocado em contato direto com o ágar que reveste uma monocamada celular, a qual é corada com vermelho neutro vital. Ao ocorrer lise celular, registra-se um "índice de resposta" baseado no tamanho da difusão pela zona descolorida e a porcentagem das células lisadas dentro das zonas. O método do filtro Millipore registra de acordo com um escore baseado na intensidade da coloração da zona e o diâmetro ou extensão das áreas afetadas, classificando o material como não tóxico, levemente tóxico, moderadamente tóxico e severamente tóxico.
Em 1990, FRESHNEY revendo os ensaios em cultura de células, colocou que podem ser divididos em duas classes: (1) Resposta imediata ou de curto prazo, tal como alteração na permeabilidade da membrana ou perturbação de uma via metabólica; e (2) Sobrevivência a longo prazo, geralmente medida pela retenção da capacidade de auto-renovação ou sobrevivência em estado alterado, como por exemplo, transformação maligna. Os ensaios de curta duração são usados para medir a proporção de células viáveis após um determinado procedimento traumático. Segundo Daniel (1998) a maioria dos testes de viabilidade baseiam-se no rompimento da integridade da membrana, determinado pela penetração de um corante ao qual a célula normalmente é impermeável (azul de Trypan, eritrosina, nigrosina), ou a liberação de um corante ou isótopo normalmente retido pelas células viáveis (diacetato de fluoresceína ou cromo radioativo). Os ensaios a longo prazo são usados para demonstrar a capacidade metabólica ou proliferativa das células após influência tóxica, cujo objetivo é medir a sobrevivência.
BROWNE & TIAS em 1979 revisam o tema da dependência celular sobre o resultado da citotoxidade in vitro. Segundo eles, com relação ao tipo celular a ser utilizado no experimento, muitos aspectos destes testes são relevantes para a simulação do uso clínico de materiais dentários como o tipo de célula usado, método de contato dela com o material, estado físico do material e o método de avaliação da citotoxidade. Concluíram porém que o tipo de linhagem celular experimental empregada no experimento não era um fator decisivo na determinação da toxicidade de um material.
SCHMALZ (1994) afirmou que podem ser usados dois tipos de células: (1) linhagens de células permanentes derivadas de coleções tipo cultura (ou de fontes comerciais) e (2) linhagem de células primárias, derivadas de explants e estabelecidas em cada laboratório individualmente. O autor afirma que a escolha do método de registro deve ser baseada na informação que se deseja. Primeiramente o autor preconiza o uso de métodos mais simples, baseados nos efeitos de membrana ou no índice de proliferação celular. Caso haja necessidade de informações mais detalhadas, deverão ser usados métodos mais sofisticados, baseados na atividade celular. Esse autor acredita que o uso do índice de proliferação para registrar o dano celular é um dos métodos mais antigos e mais comumente utilizados. As vantagens da contagem celular direta é que a mesma é fácil de realizar e pode ser combinada com um corante vital a fim de excluir as células mortas.
Sabemos que o comportamento do fibroblasto humano de pele é diferente daquele observado no fibroblasto humano de mucosa, ainda que mantidos nas mesmas condições. Apesar disso, a maioria dos trabalhos in vitro utilizam fibroblastos obtidos à partir de amostras de pele humana, ou ainda de animais, pela praticidade de se trabalhar com fibroblastos de linhagens já estabelecidas, menos sensíveis a variações e que se podem adquirir no mercado.
Linhagens celulares obtidas de cultivos primários são mais delicadas e exigem um certo tempo de trabalho e grande dedicação antes de poder-se começar o experimento propriamente dito. Por isso, poucos autores demonstram a atividade dos lasers de baixa potência sobre fibroblastos de mucosa humana, sobretudo em linhagem primária.
2.4.2. Estudos in vitro
2.4.2.1. Angiogênese
Em 1988, TRELLES et al. fizeram um estudo em língua de ratos para observação de níveis de histamina local e sistêmica, após tratamento com laser emitindo na região do visível, operando em 632,8 nm, utilizando potências ópticas de saída de 4 mW e de 50 mW com fluência de 2,4 J/cm2. Com a potência óptica de saída de 4 mW observavam localmente nos grupos irradiados, aumento de 100% de histamina e nos grupos irradiados com potência óptica de saída de 50 mW, um aumento de 30%. Os autores também observaram diferença significativa na liberação de histamina à nível sistêmico em relação aos grupos controles.
Em 1989a, os mesmos autores (TRELLES et al.) repetiram o experimento com o mesmo modelo, mesmo comprimento de onda e mesma fluência, variando apenas as potências ópticas de saída dos aparelhos, que foram de 4 mW e 15 mW, variando portanto a irradiância. A análise de liberação de histamina local foi feita através de radioimunoanálise e foi feito estudo da morfologia da língua por meio de microscópio eletrônico de transmissão. Nos grupos irradiados foi observada marcada vasodilatação e degranulação ativa de mastócitos quando comparados aos grupos controle. Os níveis de histamina foram mais altos nos grupos irradiados com o laser de potência óptica de saída de15 mW.
Em 1990, EL SAYAD e DYSON utilizaram diodos lasers emitindo em diferentes comprimentos de onda (l = 660, 820, 870, 880, 940, 950 nm) sobre modelo animal. No grupo controle a irradiação foi feita com uma luz comum. Quando irradiaram pele normal com qualquer um dos comprimentos de onda do laser, houve maior número de mastócitos, embora sem degranulação, enquanto que os grupos irradiados com luz comum apresentaram resultados nulos. Quando irradiaram pele lesada, observaram aumento tanto no número como na degranulação de mastócitos em comparação com os grupos controle irradiados com luz comum. Os autores relataram que controlaram a temperatura durante a irradiação e que observaram uma elevação máxima na temperatura local dos animais de 1,8°C, que se normalizou aos 4 minutos, e não atribuíram os resultados obtidos no experimento à esse fato.
2.4.2.2.
Sistema Imunológico
Linhas
Hematológicas
Em 1989, VISCOR et al. usaram um laser de He-Ne com irradiância de 0,5 mW/cm2 para estudar a curva de fragilidade osmótica de eritrócitos. Observaram que nos grupos irradiados com laser, houve alteração da viscoelasticidade da membrana eritrocitária sem evidências de alteração em sua estrutura.
Em 1989, SHIROTO et al. estudaram os efeitos de dois diodos lasers de As-Ga-Al sobre a atividade de neutrófilos de amostras de sangue humano de adultos saudáveis. Dividiram as amostras em 4 grupos. Os grupos 1 e 2 foram irradiados com um diodo laser operando em 830 nm, o grupo 3 com um diodo laser operando em 904 nm, e o grupo 4 foi utilizado como controle e não foi irradiado. Utilizaram fluência e irradiância diferentes para todos os grupos. Os autores observaram que todos os grupos irradiados apresentaram maior atividade fagocitária dos neutrófilos, sendo que os resultados mostraram que essa atividade dependeu da fluência, já que os melhores resultados foram obtidos no grupo irradiado com o diodo laser operando em 830 nm com potência nominal de 60mW.
Em 1991, VINCENT et al. estudaram a ação de um laser de Argon:Dye sobre células sangüíneas, irradiando sangue de coelhos e humanos. Observaram que o comprimento de onda emitido em 630 nm foi fortemente absorvido pelo sangue. Com um hematócrito entre 42 e 50 e uma espessura de fluxo de sangue de 0,15 mm, absorveu 42% da luz e quando a espessura do fluxo foi de 1 mm, absorveu 80% da energia laser, com uma transmissão de 20%.
Em 1994, O’KANE et al. utilizaram um diodo laser operando em 660 nm para estudar a incorporação de timidina tritiada em linhagem celular hematopoiética (pré-monócitos e linha mielóide). Com fluência maior ou igual a 5,8 J/cm2 produziu-se uma redução significativa da incorporação de timidina tritiada na linha mielóide. Com fluência de 5,8, 7,2 e 11,5 J/cm2 , o mesmo ocorreu na linha pré-monocítica. Para nenhuma fluência houve aumento da incorporação de timidina tritiada em nenhuma das linhas e a viabilidade celular foi de 95%. Os autores observaram que a causa poderia ser por mudanças na proporção de células nas diferentes fases do ciclo celular ou por indução da diferenciação celular.
Em 1996, CALLAGHAN et al. estudaram a ação de um diodo laser emitindo na região do visível operando em 660 nm sobre uma linhagem de células hematopoiéticas U937. Usaram fluências que variaram de 1,0 a 11,5 J/cm2. A síntese de DNA foi significativamente aumentada quando utilizadas fluências de 2,9 e de 8,6 J/m2.
Linfócitos
Em 1987, OHTA et al. estudaram os efeitos de um diodo laser de As-Ga sobre linfócitos, com diferentes fluências. Observaram que quando irradiaram linfócitos com fluência de 10,8 mJ/cm2 produziu-se uma inibição da proliferação celular.
Em 1988, FEDOSEYEVA et al., da equipe de KARU, estudaram a ação do laser de He-Ne sobre linfócitos. Observaram que com uma fluência de 56 J/cm2 obtiveram os mesmos resultados de quando utilizaram uma determinada substância de ação mitógena (a fitohemaglutinina). Observaram a união de DNA com acridina-orange.
Em 1989, Inoue et al. estudaram o efeito mitógeno de um diodo laser de As-Ga-Al sobre linfócitos. Com fluências variando de 14,2 a 28,3 mJ/cm2 produziu-se inibição na replicação celular. Com fluência de 849 mJ/ cm2 produziu-se um aumento da replicação celular.
Em 1990, CHIO et al. estudaram os efeitos de três diferentes lasers (He-Ne, As-Ga-Al e Argônio) sobre linfócitos in vitro. Observaram que o índice mitótico foi inversamente proporcional a fluência de irradiação e que as rupturas cromossômicas aumentaram proporcionalmente com a fluência. Com o laser de He-Ne e com o diodo laser de As-Ga-Al não observaram nenhuma alteração significativa em relação ao grupo controle, tanto no índice mitótico como nas rupturas cromossômicas.
Em 1991, NARA et al. estudaram os efeitos do He-Ne sobre suspensão de linfócitos da circulação sangüínea periférica de humanos. Utilizaram fluências que variaram de 5 a 20 J/cm2 sobre esses linfócitos in vitro, mantidos em meio pobre em nutrientes e os resultados foram comparados aos grupos tratados com um mitógeno de origem vegetal (Concanavalina A). Observaram que em meio pobre em nutrientes, a irradiação com laser provocou um aumento significativo no índice mitótico, efeito que não se produziu quando o meio de cultivo foi o adequado para os linfócitos. O número de células viáveis não se alterou com a irradiação laser. Nessa época os autores fizeram uma importante afirmação, considerando que o efeito bioestimulador do laser dependia do estado fisiológico em que se encontravam as células antes da irradiação.
Durante o ano de 1991, KARU et al. (1991a, 1991b) publicaram uma série de artigos onde estudaram a incorporação de timidina tritiada em suspensão de linfócitos em meio livre de mitógenos, em comparação a grupos controles de cultivos estimulados com fitoaglutininas. Não houve diferença significativa entre os grupos. Após a irradiação dos cultivos acrescentaram fitoaglutininas ao meio, e observaram aumento na síntese de DNA, em comparação com a presença do mitógeno isolado. Em outro artigo da série, os autores comunicaram os resultados obtidos com o mesmo protocolo observando a expressão do receptor para Interleucina-2 em linfócitos irradiados, sem obterem resultados significativos (1991c).
KARU (1991d) concluiu que o laser de He-Ne, com fluência de 56 J/cm2, produziu um aumento no fluxo de íons de cálcio a curto prazo (alguns minutos) e um aumento da síntese de DNA a longo prazo.
Em 1992, HERBERT et al. estudaram a concentração de AMP, ADP e ATP em linfócitos em suspensão após sua irradiação com diodo laser operando em 820 nm com diferentes fluências. Com fluência de 1,2 J/cm2 produziu-se um aumento de ATP e diminuição de ADP, não se verificando alterações na concentração de AMP.
Em 1992, FUNK et al. estudaram a produção de citocinas após irradiação com laser de He-Ne sobre cultivos de células mononucleares de sangue periférico humano. Os autores irradiaram essas células em diferentes intervalos de tempo e utilizando diferentes fluências. Os autores verificaram que a média de incorporação de timidina tritiada ao DNA das células irradiadas decresceu de acordo com o aumento da fluência. Os níveis de interleucina-1a (IL-1a ), interleucina-2 (IL-2), fator de necrose tumoral-a (TNF-a ) e interferón-g (IFN-g ) foram quantificados no sobrenadante, antes e depois da irradiação. Observaram que as linfocinas aumentaram aos 30 minutos depois da irradiação, diminuindo porém aos 60 minutos. A incorporação de timidina tritiada diminuiu à medida que se aumentou a fluência.
Em 1995, VOLPI et al. usaram um laser de He-Ne para estudar a ação do laser de baixa potência sobre granulócitos e linfócitos. Observaram que aos 30 minutos após a irradiação, produziu-se nos linfócitos um aumento estatisticamente significativo de ATP e aos 60 minutos produziu-se nos granulócitos, sem modificação no total de adenilato da célula.
Em 1997, MANTEIFEL et al. estudaram as alterações ultraestruturais em mitocôndrias de linfócitos humanos após irradiação com laser de He-Ne. Após a irradiação dessas células com fluência de 56 J/cm2, foram feitos cortes ultra-finos para análise em microscopia eletrônica. Os autores observaram que nas células irradiadas houve um aumento de 20% no número de perfis mitocondriais na secção celular sem aumento em sua área total e que o número de mitocôndrias foi reduzido.
Macrófagos e Granulócitos
Em 1985, HUBACEK et al. estudaram os efeitos do laser de He-Ne sobre a atividade fagocitária de neutrófilos cultivados com cristais de cádmio. Trabalharam com fluências variáveis de 0,3, 0,7 e 1,5 J. Quando trabalharam com a primeira, não observaram efeito significativo sobre a fagocitose. A segunda estimulou a atividade fagocitária e a terceira produziu inibição desse fenômeno.
Em 1989, KARU et al. estudaram os efeitos do laser de He-Ne sobre a atividade fagocitária de neutrófilos, verificando que houve um incremento dessa atividade nos grupos irradiados em relação aos controle não irradiados.
Em 1989, RICEVUTI et al. estudaram a ação do laser de He-Ne sobre granulócitos em diferentes meios de cultivo. Avaliaram sua migração in vitro, seu metabolismo oxidativo, sua agregação granulocítica e a liberação de ATP dessas células. Em todos os cultivos produziu-se marcada inibição na migração celular comparado com os grupos controles, quando irradiados com fluência de 2 J. Quando irradiaram esses cultivos com fluência de 4 J, essa inibição foi máxima. Para nenhuma das fluências utilizadas houve modificação no metabolismo oxidativo. Os autores observaram a diminuição da liberação de ATP porém, após um estímulo mitógeno, houve um aumento na produção de ATP, somente nos grupos irradiados com fluência de 4 J. Esses mesmos autores trabalharam em humanos, irradiando pacientes a cada 12 horas com fluência de 2 J. Observaram uma diminuição significativa da celularidade global no sangue periférico. Estudaram também a presença de uma glicoproteína de membrana envolvida na quimiotaxia e agregação (CD 11a, b, c e CD 18). Observaram que seus níveis séricos não se modificaram após a irradiação.
Em 1990, OSANAI et al. estudaram a ação fagocitária de neutrófilos utilizando um diodo laser de As-Ga-Al. Não observaram nenhuma alteração significativa nos grupos irradiados em relação aos controle não-irradiados.
Em 1990, YOUNG et al. estudaram a ação de um diodo laser de As-Ga-Al emitindo em diferentes comprimentos de onda (l = 660, 820 e 870 nm) sobre granulócitos. Observaram que a máxima ativação da bomba de sódio e potássio aconteceu quando se utilizou fluências que variaram de 4 a 8 J/cm2. Quando utilizaram fluências maiores que isso, aconteceu inibição desse mecanismo. Trabalharam ainda com diferentes freqüências de onda e observaram que a freqüência mais ativa para a bomba de cálcio foi a de 16 Hz, ainda que com freqüências de 4,56, 700 e 5000 Hz, também observaram aumento de sua atividade. Não houve diferença significativa nos resultados encontrados para os diferentes comprimentos de onda utilizados.
Em 1991, OSTUNI et al. utilizaram um laser de He-Ne para estudar as alterações na fluorescência intrínseca emitida por granulócitos, monócitos e linfócitos na vascularização periférica, antes e depois da irradiação. Não houve alterações significativas em linfócitos e em monócitos, porém houve em granulócitos quando irradiados com um diodo laser operando em 280 nm.
Em 1991 e 1992, BOLTON et al. estudaram a ação de um diodo laser operando em 820 nm sobre cultivo de macrófagos. Irradiaram os cultivos, aspiraram seu meio e o colocaram em cultivo de fibroblastos, estudando a replicação destas células. Quando utilizaram irradiância de 400 mW/cm2 e fluências variando de 2,4 a 7,2 J/cm2, verificaram aumento significativo na população de fibroblastos. Seguindo o mesmo protocolo, estudaram se a luz polarizada podia afetar a proliferação dessas culturas. Compararam lasers com polarização de 95% e de 14%. Observaram que a primeira polarização foi mais eficiente que a segunda.
Em 1994, RAJARATNAM, utilizou o mesmo protocolo dos trabalhos publicados anteriormente trabalhando com diferentes freqüências de emissão (2,28; 18,24; 292,3 e 1000 Hz) com fluência fixada em 7,2 J/cm2. Todas as freqüências produziram aumento significativo no número de fibroblastos em comparação aos grupos irradiados com luz comum.
2.4.2.3. Queratinócitos e Células Epiteliais
Em 1988, SCHNEEDE et al. utilizaram um laser de He-Ne linhagem de células epiteliais controlando a incorporação de timidina tritiada, o consumo de glicose e a produção de lactato, assim como a síntese de prostaglandina E2. Com fluências de 142 e 569 J/cm2 não houve alteração no número de mitoses. Uma hora depois da irradiação, a incorporação de timidina tritiada diminuiu transitoriamente durante seis e nove horas. O autor também observou diminuição no consumo de glicose e um ligeiro aumento de LDH. A síntese de PgE2 diminuiu significativamente depois da irradiação.
Em 1990, Mester e SNOW estudaram o efeito do laser de He-Ne sobre a maturação e regeneração de explants neuroepiteliais olfatórios embrionários. Para uma fluência de 0,5 J/cm2, observaram diferença significativa em relação aos grupos controles.
Em 1990, GROSS e JELKMANN utilizaram o laser de He-Ne para irradiar células epiteliais de rim em cultivo. Com fluência de 4,7; 11,9 e 35,4 J/cm2 não houve alterações significativas. Quando utilizaram fluência de 71,1 J/cm2 observaram aumento no índice mitótico e para fluência de 142,2 J/cm2 observaram inibição do fenômeno. Os pesquisadores controlaram a temperatura nos cultivos observando um aumento de menos de 0,065°C, que não consideraram significativo.
Em 1990, HAAS et al. controlaram através de câmara de vídeo, durante seis horas, a migração de queratinócitos ao longo de uma franja de 0,1 mm, no centro de placas de cultivos confluentes de queratinócito humano. A distância em m m nos cultivos irradiados foi de 12 m m/hora, em comparação com os controles que foi de 4 m m/hora. O estudo da incorporação de bromodeoxiuridina sobre o mesmo modelo não foi conclusivo.
Em 1993, STEINLECHNER e DYSON, concluíram que tanto o laser de He-Ne como o diodo laser operando em 904 nm estimularam a proliferação de queratinócitos e que esta proliferação reduziu-se quando o cultivo estava confluente. Observaram ainda que o efeito foi muito importante quando as células cresceram em meio de cultivo pobre em soro (1%) e que o efeito bioestimulativo do laser produziu-se com fluência muito baixa (0,25 J/cm2).
Em 1996, HSIN-SU et al. estudaram a ação do laser de He-Ne em queratinócitos humanos em cultivo para avaliar os níveis de Interleucina-1a (IL-1a ) e Interleucina-8 (IL-8). Utilizaram fluência de 1,5 J/cm2. Os resultados revelaram que houve aumento significativo na produção de IL-1a e IL-8 e suas respectivas expressões no RNAm nos grupos irradiados com laser em relação aos controle. Os autores observaram ainda que esse efeito estimulativo dependeu da concentração de células em cultura.
Em 1998, GROSSMAN et al. estudaram os efeitos de diferentes fluências sobre queratinócitos em cultivo, buscando os parâmetros mais adequados de irradiação para que um diodo laser operando em 780 nm produzisse efeito proliferativo sobre essas células. Obtiveram os melhores resultados nos grupos irradiados com fluências entre 0,45 a 0,95 J/cm2. As demais fluências utilizadas foram consideradas menos efetivas.
2.4.2.4. Enzimas
Durante o ano de 1991, várias equipes publicaram estudos sobre os efeitos do laser de baixa potência na modulação, ativação e síntese enzimática. Nesse ano HUG e HUNTER escreveram um artigo sobre foto-modulação enzimática e dedicaram uma parte somente à bioestimulação laser. Eles utilizaram os trabalhos de KARU e de sua equipe sobre bactérias, leveduras e cultivos celulares, e concluíram que com alta fluência, quando se usava diodos lasers emitindo na região do visível e na região do infravermelho próximo, produzia-se atraso no crescimento dos microorganismos e inibição de suas cadeias respiratórias. Também concluíram que a ação bioestimuladora do laser de baixa potência dependia do estado fisiológico em que a célula se encontrava no momento da irradiação.
BOLOGNANI et al.(1991a e 1991b) trabalharam em sistemas enzimáticos. Inativaram LDH incrementando o CO2 do meio. Após irradiá-las com laser de He-Ne com fluência de 7,42 J/cm2, estas enzimas foram reativadas parcialmente (cerca de 60% delas) sem chegar a recuperação total (aos 100%). Observaram que a irradiação laser foi ineficaz na estimulação ou inibição da atividade de enzimas ativas, porém se as enzimas como Na-ATPase, K-ATPase eram inativadas parcialmente (3M-uréia e/ou choque térmico), eram reativados novamente pela ação de um diodo laser de As-Ga com radiação pulsada, utilizando freqüência de 4,5 KHz. A inativação de miosina-ATPase por um aumento na perfusão de CO2, foi recuperada a 20% pela ação de um laser de He-Ne. Em 1993, o mesmo autor e sua equipe (BOLOGNANI) seguindo a mesma linha de pesquisa, estudaram a atividade da ATPase e ATPsintetase na miosina exposta à irradiação laser e ao tratamento com campos eletromagnéticos emitindo radiações pulsadas. Os autores verificaram que a recuperação parcial da atividade da miosina ATPase inativada podia ser obtida por sua exposição ao laser. Os autores concluíram que a atividade enzimática foi aumentada pela sua exposição à radiação laser ou aos campos eletromagnéticos emitindo radiações pulsadas.
Em 1994, OSTUNI et al. estudaram a atividade da enzima desidrogenase glutamato. Os autores usaram um laser de He-Ne com diferentes fluências e irradiâncias. Para uma fluência de 4 J/cm2 e uma irradiância de 1,7 mW/cm2, houve aumento da atividade enzimática; com 10 mW/cm2 houve diminuição na atividade enzimática e com 24 J/cm2 para ambas irradiâncias utilizadas (7 e 10 mW/cm2) houve aumento na atividade enzimática.
Em 1995, BOLTON et al. publicaram um estudo dos efeitos de um diodo laser operando em 860 nm, utilizando fluências de 2 e 16 J/cm2, na proliferação celular de fibroblastos humanos de pele em linhagem primária e na atividade da succinato desidrogenase (enzima diretamente unida à cadeia de transporte eletrônico). Os autores observaram que com fluência de 2 J/cm2, os níveis dessa enzima aumentaram com a proliferação celular, efeitos esses que foram inibidos quando as células foram irradiadas com fluência de 16 J/cm2.
2.4.2.5. Fibroblastos
Em 1982, RYHANEN et al. estudaram a atividade das enzimas colagenase e gelatinase, que intervêm na degradação do colágeno. Os autores cultivaram fibroblastos em meio de cultivo isento de soro. Irradiaram essas culturas com dois diferentes tipos de lasers: He-Ne e um diodo laser de As-Ga, e observaram o comportamento dessas enzimas. Não houve alteração em sua atividade, nem na atividade da elastase. Concluíram que o aumento na formação de colágeno descrita neste estudo não foi devido à diminuição em sua degradação e sim a um aumento de sua síntese. O estudo de viabilidade celular com a incubação de fibroblastos com azul de Trypan, não demonstrou alterações. A atividade da LDH, e das enzimas intercelulares (que se liberam do citoplasma quando há alteração da integridade da membrana celular), não apresentou alterações após a irradiação.
Em 1883, Castro et al. (1983a, 1983b) estudarem a síntese de DNA após irradiação com laser de Nd:YAG usando fluência de 1,7 x 103 J/cm2 e incorporando timidina tritiada nos cultivos após irradiação. Mostraram uma significativa redução dessa síntese sem comprometimento da viabilidade celular. A incorporação de hidroxiprolina tritiada, quando se utilizou mesma fluência, mostrou-se significativamente reduzida. Por meio de uma fonte de calor de uma luz halógena de tungstênio, com um aumento de temperatura entre 30 e 50°C não se observou nenhuma diminuição na produção de colágeno. Portanto, os resultados indicaram que os efeitos observados com o laser de Nd:YAG não se podiam explicar unicamente devido à sua ação térmica. Baseados nesses resultados ABERGEL et al., em 1984, relataram que os lasers de alta potência como o Nd:YAG, podiam inibir de forma seletiva a produção de colágeno em situações experimentais, tanto in vivo quanto in vitro. Em 1986, ABERGEL et al. monitoraram a síntese de colágeno com a incorporação de hidroxiprolina tritiada em cultivo de fibroblastos de pele humana. A proporção de hidroxiprolina a prolina no colágeno do tipo I purificado, sintetizado nesses cultivos, foi de aproximadamente 0,7. Os resultados indicaram que mais de 20% da 3H-radioativa incorporada estava no procolágeno recém sintetizado. Os autores observaram aumento de 3,3 vezes na produção de procolágeno em uma das linhagens de fibroblastos com hidroxilação de prolina de 3,5%, enquanto que um aumento de até 36 vezes na produção foi detectado dentro de outra linhagem, com um grau inicial de hidroxilação de prolina de 0,4%. O aumento máximo na produção de procolágeno foi obtido com os lasers de He-Ne e o diodo laser de As-Ga utilizando fluências de 0,16 e 0,57 J/cm2. A hidroxilase de prolina é uma enzima intracelular chave que catalisa a formação de hidroxiprolina a partir dos polipeptídeos de procolágeno recém sintetizado. Não foi observada alteração na atividade desta enzima quando utilizadas fluências de até 1,6 J/cm2 para o laser de He-Ne e de 1,94 J/cm2 para o diodo laser de As-Ga. Os autores também estudaram a replicação de DNA pela incorporação de timidina tritiada. Nos grupos irradiados com o laser de He-Ne não foi observada nenhuma alteração, entretanto nos grupos irradiados com o diodo laser de As-Ga, os autores observaram que essa replicação foi significativamente inibida. Também foi comprovada a estimulação com o laser de He-Ne na incorporação de leucina tritiada no colágeno. Foi feita a monitoração da temperatura das culturas durante a irradiação e não foi observada nenhuma alteração significativa nas culturas celulares.
Em 1985, GIMENEZ e CASADO fizeram um estudo sobre respiração tissular e observaram que a irradiação sobre células in vitro teve um efeito bioestimulador, resultando num aumento do consumo celular de oxigênio e glicose. Quando a fluência excedeu 1 J/mg de tecido, a resposta foi inibitória, com diminuição da respiração celular.
Em 1986, LAM et al., da equipe de ABERGEL, continuaram a linha de trabalho utilizando prolina, leucina e timidina tritiada, para estudo da ativação de proteases. Os autores fizeram a monitoração de temperatura, o estudo ultraestrutural e de viabilidade celular, em diferentes linhagens de fibroblastos. Concluíram que o laser de He-Ne provocou um aumento do procolágeno porém não em todas as linhagens, assim como ausência de alterações à nível de DNA. Nos grupos irradiados com o diodo laser de As-Ga observaram diminuição na síntese de DNA. Nos demais parâmetros não houve alterações significativas. A partir desses trabalhos, vários pesquisadores seguiram essa mesma metodologia.
Em 1988, LABBE et al. realizaram um estudo verificando número de células, sua viabilidade, morfologia, índice mitótico e totalidade de DNA, após a irradiação com um diodo laser, sem observarem alterações significativas. Demonstraram que houve um aumento nos níveis de absorção de hidroxiprolina e nos níveis de ácido ascórbico e que ao subcultivar essas células irradiadas, os níveis anteriormente alterados se normalizaram. Propuseram assim, que o laser teria um efeito transitório.
Em 1988, GLASSBERG et al. utilizaram eritrócitos, células endoteliais e fibroblastos para estudar a viabilidade celular e incorporação de timidina e leucina tritiada após a irradiação com um diodo laser operando em 577 nm. Nos cultivos de células endoteliais ambas incorporações foram inibidas quando utilizaram fluências variando de 5 a 12 J/cm2. Nos cultivos de fibroblastos, foi preciso fluências acima de 12 J/cm2 para a inibição da síntese de proteínas. As fluências de 5 a 8,5 J/cm2 não afetaram a viabilidade celular. Ao colocar eritrócitos em cultivo não se observaram alterações significativas nas células endoteliais. Concluíram que esse comprimento de onda foi mais absorvido pelos eritrócitos presentes em cultivo.
Em 1988, HALLMAN et al. fizeram um estudo com laser de He-Ne para verificar a proliferação celular de fibroblastos humanos em cultivo. Irradiaram essas células em diferentes passagens: entre a terceira e quarta e entre a décima terceira e décima quarta. Não observaram nenhum efeito significativo estimulativo ou inibitório do laser.
Em 1989, COLVER et al. obtiveram resultados negativos ao estudar os efeitos proliferativos, síntese de colágeno, migração e síntese de glicosaminoglicans em fibroblastos, células epiteliais e endoteliais, utilizando um laser de He-Ne.
Em 1989, POURREAU-SCHNEIDER et al. estudaram a proliferação celular de fibroblastos de gengiva humana irradiados com um laser de He-Ne. Após uma ou duas irradiações, não observaram um aumento significativo no número de células, porém a partir da terceira irradiação houve um aumento estatisticamente significativo. Observaram ultra-estruturalmente: hipertrofia e hiperplasia mitocondrial com microfilamentos próximos à membrana plasmática e abundância de matriz fibrilar nas regiões pericelulares. Em 1990, a mesma equipe (POURREAU-SCHNEIDER et al.) fizeram um estudo in vitro com fibroblastos de linhagem primária e um estudo in vivo, irradiando feridas pós-cirúgicas de dentes com indicação de exodontia. Os autores demonstraram que o laser de He-Ne ativou a transformação de fibroblastos de gengiva humana em miofibroblastos. Concluíram que a indução de um fenótipo com propriedades contráteis deveria influenciar clinicamente na aceleração do processo de cicatrização.
Em 1990, WIEGAND-STEUBING et al. estudaram a incorporação de timidina tritiada em linhagem de células HeLa irradiadas com diodos lasers operando em três diferentes comprimentos de onda: 405, 633 e 675 nm. Também estudaram a produção de TNF em linha de monócitos. Não observaram alterações significativas nos grupos irradiados em relação aos grupos controle não irradiados. Embora outros autores como KARU et al., em 1996, tenham utilizado essas mesmas células para verificação de parâmetros ideais de irradiação, obtendo bons resultados. Os autores utilizaram luzes monocromáticas operando entre 580 e 860 nm e um laser de He-Ne, com fluência de 100 J/cm2. Observaram que a adesão célula-célula e célula-frasco foi estimulada pelo laser de He-Ne, fato que não ocorreu com os grupos irradiados com as luzes monocromáticas.
Em 1990, Labbe et al. estudaram a incorporação de hidroxiprolina tritiada em linhagem de fibroblastos irradiados com um diodo laser de As-Ga-Al, tendo obtido aumento na absorção de hidroxiprolina tritiada nas culturas irradiadas.
Em 1992, VAN BREUGEL e BÄR estudaram a ação do laser de He-Ne sobre fibroblastos humanos em cultura. Os resultados mostraram que com irradiância abaixo de 2,9 mW/cm2 houve aumento na replicação celular enquanto que com 5,9 mW/cm2 não se produziram efeitos. Os autores afirmaram que quando se busca um efeito foto-biomodulador, a irradiância e o tempo de exposição a que submetemos essas células é mais importante que a fluência total. Também observaram que a produção de colágeno do tipo I foi proporcional à proliferação celular.
Em 1992, NOBLE et al. estudaram a migração de fibroblastos embrionários em uma matriz de colágeno polimerizado. Observaram que os fibroblastos realizaram mais paradas e de maior duração, nas matrizes irradiadas e portanto, sua velocidade de deslocamento foi menor. As matrizes irradiadas apresentaram maior retração. Os autores concluíram que a turgidez do gel de colágeno poderia produzir um aumento do espalhamento (scattering) do laser com conseqüente diminuição de sua transmissão e absorção, devido a fenômenos como a vibração do gel que poderia haver detido o avanço dos fibroblastos.
Em 1992, HEIN et al. estudaram os efeitos do laser de He-Ne e de Kriptônio (l = 647 nm) na síntese de colágeno e na atividade quimiotática de fibroblastos. Utilizaram fluências de 0,05 a 32 J/cm2. Os autores não observaram resultados significativos entre os grupos irradiados com os dois tipos de laser em relação aos grupos controle não irradiados.
Em 1992a, LUBART et al. estudaram os efeitos de diodos lasers operando em diferentes comprimentos de onda: l = 360, 632, 780 nm em linhagens de fibroblastos. Avaliaram o índice mitótico e a morfologia dessa células por meio de microscopia eletrônica de varredura. Observaram que o número de mitoses nos cultivos irradiados aumentou significativamente em relação aos controles quando foi utilizada fluência de até 15 J/cm2. Quando utilizada fluência de 60 J/cm2, o número de mitoses diminuiu. Em 1993, os mesmos autores (LUBART et al.) estudaram o efeito proliferativo do laser de baixa potência sobre cultura de fibroblastos. Os comprimentos de onda emitidos em 540 nm e entre 600 e 900nm produziram aumento significativo do número de mitoses. Os autores concluíram que esses efeitos dependeram do comprimento de onda bem como da fluência utilizada.
Em 1992, NARA et al. estudaram os efeitos de lasers emitindo em diferentes comprimentos de onda em fibroblastos de polpa dental humana. Trabalharam com um laser de He-Ne e dois diodos lasers emitindo na região do infravermelho próximo (l = 790 nm e l = 830 nm). As fluências variaram de 0,05 a 2 J/cm2. Os autores verificaram que os grupos irradiados com laser de He-Ne com baixa fluência (0,1 J/cm2) mostraram proliferação não significativa em relação aos controle não irradiados, e os grupos irradiados com os diodos lasers não apresentaram qualquer efeito estimulativo.
Em 1994, WEI YU et al. estudaram o efeito de um diodo laser operando em 660 nm na produção de bFGF em cultura de fibroblastos 3T3 (linhagem preestabelecida). Os autores trabalharam com duas diferentes fluências: 3,2 J/cm2 e 2,1 J/cm2. Verificaram que fibroblastos irradiados com menores fluências demonstraram aumento na proliferação celular e na produção de bFGF, enquanto que aqueles submetidos a fluências maiores, não demonstraram aumento na proliferação celular nem nos níveis de bFGF quando comparados aos do grupo controle não irradiados.
Em 1994, LOEVSCHALL e ARENHOLT-BINDSLEV, estudaram os efeitos de um diodo laser de comprimento de onda de 812 nm sobre fibroblastos de gengiva humana. Utilizaram no protocolo irradiância fixada em 4,5 ± 0,5 mW/cm2 para todos os grupos variando as fluências de 4,5 a 4500 mJ/cm2. Os autores controlaram a incorporação de timidina tritiada após incubação de 16 horas. A incorporação demonstrou-se aumentada em todos os grupos irradiados, sendo a incorporação máxima observada nos grupos irradiados com fluência de 450 mJ/cm2. Os autores concluíram que o laser aumentou a síntese de DNA das células irradiadas.
Em 1995, LUBART et al. foto-sensibilizaram fibroblastos e queratinócitos com derivados hematoporfirínicos e posteriormente os irradiaram com diferentes diodos lasers (l = 540, 633, 660, 780, 940 nm). Observaram que com ou sem hematoporfirinas, os grupos irradiados demonstraram aumento significativo na proliferação celular. Nos grupos irradiados com comprimentos de onda emitidos na região do visível, com a presença de corante, o efeito foi muito maior em relação aos grupos irradiados com comprimentos de onda emitidos na região do infravermelho próximo. Os autores ainda observaram que os resultados obtidos com o laser de He-Ne (633 nm) foram dependentes da presença do pigmento exógeno, enquanto que não foram para o diodo laser de l = 940 nm.
Em 1996, RIGAU estudou o efeito de um laser de Argon:Dye operando em 633 nm no comportamento e na morfologia de fibroblastos de linhagem primária em cultivo. Trabalhou com um aparelho de potência de saída de 38mW, com fluência de 2 J/cm2 e irradiância de 4 mW/cm2. A autora verificou que esse tipo de laser induziu vários efeitos biológicos nos fibroblastos dos grupos irradiados como: formação de colônias, movimento de quimiotaxia e quimiocinética.
Em 1996, SKINNER et al. estudaram a ação de um diodo laser de As-Ga sobre fibroblastos de embrião humano em cultivo. As fluências entre 0 e 1 J/cm2 durante períodos entre 1 e 4 dias. A produção de procolágeno foi monitorada pela incorporação de hidroxiprolina tritiada e a replicação de DNA, por incorporação de timidina tritiada. Os autores verificaram que o máximo de aumento na produção de colágeno e na bioestimulação celular ocorreu após 4 aplicações com intervalos de 24 horas entre elas. Fluências de 0,09 a 0,52 J/cm2 tiveram efeitos estimulativos mais significativos na função fibroblástica. Os autores concluíram que os efeitos clínicos do laser de As-Ga podem ser resultado do aumento do tecido conectivo de reparação.
Em 1997, POGREL et al. estudaram o efeito do diodo laser de As-Ga-Al em fibroblastos e queratinócitos em cultura. As culturas foram irradiadas com fluências variadas e irradiâncias entre 5-100 mW. Os autores avaliaram a proliferação celular por absorção espectofotométrica, a adesão celular por microcolorimetria, e observaram a migração celular. Não houve diferenças significativas entre os grupos irradiados e controle para ambos tipos de células cultivadas.
Em 1997, LUBART et al. estudaram os efeitos do laser de He-Ne nas concentrações de Ca2+ em fibroblastos. Irradiaram culturas com diferentes fluências (1, 3 e 5 J/cm2) e observaram que com fluências apropriadas para aumentar a proliferação celular, houve produção transitória aumentada na concentração intracelular de cálcio nas células alvos. Os autores concluíram que essas observações poderiam inclusive explicar a foto-bioestimulação em importantes processos biológicos como a proliferação celular e a exocitose. Essa mesma autora, trabalhando com diferentes equipes, já havia anotado essa observação em um estudo que havia feito em 1992b (LUBART) com células de esperma de boi. Os autores irradiaram essas células com um laser de He-Ne e com um diodo laser operando em 780 nm, utilizando diferentes fluências, e observaram que o transporte de Ca2+ nas células irradiadas foi acelerado, o que significou que a radiação laser estimulou mudanças de Ca2+ através da membrana celular. Os autores concluíram que esse fato podia explicar as alterações transitórias na motilidade dessas células, e em outras, o fato de disparar a mitose. No grupo da mesma autora, (LUBART et al., 1996) autores avaliaram o papel da oscilação intracelular de cálcio na foto-bioestimulação, irradiando fibroblastos e queratinócitos com diodos lasers operando em diferentes comprimentos de onda, sendo alguns emitidos na região do vermelho (540 nm e 630 nm) e outros na região do infravermelho próximo (780 nm e 940 nm). Observaram que quando utilizaram baixa fluência houve um aumento significativo da proliferação celular em todos os grupos irradiados, porém apenas os grupos irradiados com laser de He-Ne e com diodo laser de l = 780 nm, tiveram alteração significativa na concentração de Ca2+ nos fibroblastos irradiados.
Em 1998, WEBB et al. estudaram os efeitos de um diodo laser operando em 660 nm sobre duas linhagens primárias de fibroblastos humanos, uma originada de tecido normal e outra de cicatriz hipertrófica. Utilizaram fluências de 2,4 e 4 J/cm2. Ambos os grupos tiveram um aumento significativo na proliferação celular em relação aos controles não irradiados.
Em
1998b, ALMEIDA-LOPES et al. fizeram um estudo piloto em fibroblastos de
gengiva humana onde utilizaram dois diferentes diodos lasers operando em
635 nm e 780 nm. Irradiaram os fibroblastos previamente divididos em grupos
com diferentes concentrações de soro fetal bovino. Os autores
observaram que houve proliferação significativa para os fibroblastos
cultivados em meio com déficit nutricional e irradiados quando comparados
com os grupos controle cultivados com o mesmo meio e não irradiados.
Não houve diferença significativa para os grupos irradiados
e controle que foram cultivados em condição nutricional ideal.
Não houve diferença significativa nos resultados obtidos
para os diferentes comprimentos de onda.
Na literatura compulsada parece haver controvérsia com relação aos efeitos do laser sobre o metabolismo celular de fibroblastos, células essas diretamente implicadas na reparação tecidual. Há grande variação de parâmetros, tais como comprimento de onda, fluência, irradiância, tempo de aplicação, quantidade e freqüência dessas aplicações.
Na literatura encontramos vários trabalhos que demonstram que, em condições de normalidade tecidual, não se observa nenhum efeito após a irradiação de laser nesses tecidos.
Sabemos também que o comportamento do fibroblasto humano de pele é diferente daquele observado no fibroblasto humano de mucosa, ainda que mantidos em mesmas condições. Apesar disso, a maioria dos trabalhos in vitro utilizaram fibroblastos obtidos à partir de amostras de pele humana, ou ainda de animais, pela praticidade de se trabalhar com fibroblastos de linhagens já estabelecidas, menos sensíveis a variações e que se podem adquirir no mercado. Linhagens celulares obtidas de cultivos primários são mais delicadas e exigem um certo tempo de trabalho e grande dedicação antes de poder-se começar o experimento propriamente dito. Por isso, poucos autores demonstraram a atividade de lasers de baixa potência sobre fibroblastos de mucosa humana.
O nosso objetivo é:
1) Obter uma linhagem celular a partir de cultivo primário de fibroblastos de gengiva humana.
2) Propor um modelo que simule uma condição in vitro de normalidade e outra de estresse celular.
3)
Analisar o efeito dos lasers de baixa potência na proliferação
de fibroblastos originados dessa linhagem celular e em complementação,
fazer uma análise comparativa dessa proliferação em
função de diodos lasers operando em diferentes comprimentos
de onda situados distantes uns dos outros dentro do espectro de radiações
eletromagnéticas (operando na região do visível e
outros na região do infravermelho próximo).
O material para o cultivo celular foi obtido de gengiva humana. Foi selecionada uma paciente de 24 anos, do sexo feminino, cuja anamnese revelou estado sistêmico normal. A paciente não relatou uso de qualquer tipo de medicamento nem nenhum tipo de enfermidade sistêmica. A paciente tinha indicação de extração do segundo pré-molar inferior direito, hígido, para tratamento ortodôntico interceptativo. Após a extração desse elemento dental, a paciente foi submetida à gengivoplastia com remoção de tecido gengival na altura cervical lingual. A cirurgia deu-se sob anestesia troncular do nervo alveolar inferior, em condições de assepsia e anti-sepsia compatíveis a ambiente ambulatorial. Antes da realização da cirurgia, a paciente foi informada sobre o projeto e optou por participar do mesmo por livre e espontânea vontade, com consentimento informado (protocolo de pesquisa aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Odontologia da Universidade de São Paulo - FOUSP, sob o parecer n.º 33/99; vide apêndice 1).
A amostra foi coletada, lavada em soro fisiológico por duas vezes, e colocada num frasco de transporte contendo meio de cultivo Dulbecco’s modified Eagle (DME) em temperatura ambiente. Após 2 horas nesse meio de transporte, a amostra foi processada no Laboratório de Cultivo Celular da Disciplina de Patologia Bucal da FOUSP.
4.1.2. Cultivo Primário
Todos os procedimentos para a obtenção do cultivo primário de fibroblastos gengivais foram realizados sob capela de fluxo laminar, em temperatura ambiente entre 25 e 28° C.
A amostra coletada (que media 2,5 cm x 0,8 cm x 0,2 cm) foi processada em placas de Petri (de 60 mm de diâmetro) contendo meio DME. A amostra foi fragmentada em pedaços diminutos (média de 0,1 mm2 cada pedaço) com a ajuda de duas lâminas 11 de bisturi tipo Bard-Paker.
Os fragmentos foram lavados duas vezes com solução tampão fosfato-salina sem cálcio e magnésio (PBSA), com pH 7,2 e posteriormente por solução de tripsina a 0,25% em PBSA e 1% de EDTA para obter individualização celular. Novamente foram lavados com PBSA e o líquido existente na placa de Petri foi aspirado com pipeta tipo Pasteur. Acrescentou-se 2 ml de meio DME sobre os fragmentos. Eles foram semeados, distribuindo-se a suspensão celular em quatro frascos de cultivo de 25 cm2 e incubados durante meia hora em estufa a 37°C em atmosfera úmida contendo 95% de ar e 5% de CO2, para favorecer sua adesão à superfície. Após esse tempo foi adicionado meio DME fresco, contendo 10% de soro fetal bovino e 1% de solução antibiótica-antimicótica, cerca de 3 ml em cada frasco, o suficiente para recobrir esses fragmentos. Os frascos foram devidamente identificados, datados e levados à estufa de cultivo com as tampas semi-abertas, para entrar CO2. Esses fragmentos de tecido que foram transplantados de seu sítio original (explants), foram mantidos a partir daí em meio artificial e foram incubados em incubadora com controle de temperatura e pressão (Forma Scientific) em ambiente úmido a 37°C, em fluxo de 95% de ar e 5% de CO2.
Foram aguardadas 72 horas para a primeira observação dos explants. A monitoração do crescimento celular e de sua evolução foi feita a cada 24 horas utilizando-se microscópio de observação direta (Axiovert 25), para detecção precoce de qualquer anomalia que pudesse fazer com que eles tornassem-se inviáveis.
Após 7 dias foi feita a primeira mudança de meio de cultivo dos frascos.
Uma vez que se iniciou o crescimento celular ao redor dos explants, o meio de cultivo foi renovado a cada três dias. Para a troca de meio de cultivo todas as substâncias (meio DME, PBSA, solução de Tripsina e EDTA) utilizadas nesse procedimento foram previamente aquecidas em aparelho de Banho-Maria a 37°C por 15 minutos, antes de começar a manipulação das células. Após esse tempo, as substâncias e as células foram levadas ao fluxo laminar. Todo o meio foi descartado, as células foram lavadas duas vezes com 2ml de PBSA e meio DME fresco foi colocado nos frascos. Foram utilizados frascos plásticos para cultivo de 25 cm2 de área cultivável, onde foram adicionados mais 3 ml de meio DME contendo 10% de soro fetal bovino e 1% de solução antibiótica-antimicótica.
O meio é uma solução composta de aminoácidos essenciais, vitaminas e sais minerais, algumas vezes são suplementados por glicose e outros suplementos orgânicos (PAUL, 1975). A qualidade do meio é de extrema importância, já que ele irá manter as células em condições nutricionais semelhantes àquelas que tinham quando estavam no organismo.
Sabemos que em cultura de fibroblastos, para que a divisão celular se realize em condições ótimas, é necessário que o meio de cultivo esteja em condições ideais de nutrição, isto é, o meio ideal para essas células é aquele que contenha 10% de soro fetal bovino (SFB), caso contrário essas células entrarão em estresse, e terão seu crescimento alterado de alguma forma. Por isso trabalhamos com meio DME contendo 10% de soro fetal bovino para o estabelecimento dessa linhagem primária.
Quando 70% do fundo do frasco estava coberto por células (a isso chamamos de subconfluência) essa cultura primária foi subcultivada (Fig. 4.1).
A subcultura, ou passagem de células de um frasco para outros, geralmente implica em subdivisão de uma população celular proliferativa capaz de perpetuação através de estabelecimento de uma linhagem celular. O número de passagem significa o número de vezes que uma cultura foi subcultivada.
A
primeira subcultura foi feita no vigésimo dia após a semeadura
(esse procedimento denomina-se "plaqueamento") dos explants. Nessa
fase, a expansão de células epiteliais estabilizou-se enquanto
que os fibroblastos colonizaram progressivamente toda a superfície
dos frascos, formando uma monocamada celular subconfluente. Para a subcultura
os fibroblastos foram suspensos pelo uso de solução de tripsina
a 0,25% em PBSA e 1% de EDTA1. Dessa forma realizou-se a separação
dos fibroblastos dos explants, já que os explants
com as células epiteliais, permaneciam mais tempo aderidos ao fundo
dos frascos. Assim obteve-se a primeira passagem do cultivo primário
de fibroblastos e nesse momento, essa cultura primária deu origem
a uma linhagem celular. A partir daí foi estabelecida a linhagem
celular denominada de LMF (iniciais da paciente).

Figura 4.1: Frasco de cultivo com 25 cm2 de área cultivável contendo as células em meio DME. A coloração alaranjada do meio de cultura demonstra a alteração do pH de 7,2 a 7,4 (pelo vermelho de fenol).
4.1.3. Linhagem Celular
As células passaram a crescer. A mudança de meio de cultivo deu-se entre dois e quatro dias.
A confluência dos cultivos celulares foi verificada em microscópio de observação direta, quando se observou que a superfície do frasco estava recoberta de uma monocamada contínua de células. A confluência modula a atividade mitótica das células. As células em cultivo sofrem um fenômeno que se conhece por inibição de contato, pois quando uma célula contata ao seu redor com outra células e forma-se uma monocamada, inibe-se o processo mitótico (ALBERTS et al., 1989).
Para perpetuação dessa linhagem celular, essas células foram lavadas duas vezes com PBSA e levantadas de seu substrato pela ação de solução de tripsina a 0,25% em PBSA e 1% de EDTA, durante 1 minuto a 37°C (tripsinização). O conteúdo de cada frasco foi removido, colocado em tubo de ensaio e centrifugado a 300g durante 5 minutos à temperatura ambiente em centrífuga (Excelsa Baby, modelo 206)4. O sobrenadante dos tubos foi descartado e as células que formavam o precipitado no fundo do tubo de ensaio foram ressuspendidas com 4ml de meio fresco (meio DME, contendo 10% de soro fetal bovino e 1% de solução antibiótica-antimicótica). Em cada novo frasco foi depositado 1 ml dessa suspensão de células e acrescentado 3 ml de meio DME fresco. Esse procedimento indicou uma nova passagem celular.
Na 6° passagem amostras das células LMF foram congeladas para estocagem.
4.1.4. Congelamento e Descongelamento Celular
Para o congelamento foi utilizado o método de tripsina EDTA que consiste em reproduzir os mesmos passos descritos para subcultura, com a variação de que, quando da ressuspensão, ao invés de depositá-la no frasco convencional para crescimento, cada 1 ml de suspensão celular foi colocado em um tubo criogênico ou cryovial1, previamente identificado e datado.
Depois que os cryovials estavam todos completos, foi acrescentado 100 m l de substância crioprotetora di-metil-sulfóxido (DMSO)1, rapidamente fechados e colocados no gelo. Sua temperatura foi diminuída lentamente (em à -20oC por 30 minutos, depois em freezer a - 70°C overnight), até seu congelamento total. Então as células foram armazenadas em freezer de nitrogênio a -170oC.
Cada vez que se ia começar um novo experimento, parte das células estocadas eram descongeladas.
Para o descongelamento, uma cápsula cariogênica contendo células foi descongelada rapidamente em banho-maria a 37°C, agitando-o por 60 segundos. Para desativar a substância crioprotetora (DMSO), o conteúdo do cryovail foi transferido rapidamente para um tubo de ensaio contendo 10 ml de meio de cultivo e centrifugado a 300g durante cinco minutos, à temperatura ambiente. O sobrenadante foi removido e o precipitado foi ressuspendido em 1 ml de meio DME fresco e transferido para um frasco de plástico de 25 cm2 previamente identificado. Foi acrescentado 5 ml de meio DME, contendo 10% de soro fetal bovino (SFB) e 1% de solução antibiótica-antimicótica. As células foram mantidas em estufa de cultivo e monitoradas até que se observou seu crescimento utilizando-se microscópio invertido de fase.
4.1.5. Contagem Celular
Antes de começar os experimentos foi necessário fazer a determinação do número de células existentes no frasco original. A finalidade dessa determinação era conhecer o número de células existentes em cada tubo para poder fazer-se a semeadura nas placas de experimento com números exatos de células nas placas, padronizando dessa forma os experimentos, da maneira mais precisa possível.
Para a determinação do número de células existentes nos frascos originais (Contagem Celular), as células foram lavadas duas vezes com PBSA e levantadas de seu substrato utilizando solução de tripsina a 0,25% em PBSA e 1% de EDTA. O conteúdo de cada frasco foi removido, colocado em tubo de ensaio e centrifugado. O sobrenadante dos tubos foi descartado e os precipitados foram ressuspendidos em 1 ml de PBSA e 0,1 ml dessa suspensão celular foi dispensada em um tubo de ensaio, sendo adicionado 0,8 ml de PBSA e 0,1 ml de Azul de Trypan1 a 0,4%. Fora do fluxo laminar, uma gota dessa mistura foi colocada em cada lado da Câmara de Neubauer, que foi levada ao microscópio invertido de fase para realização da contagem do número de células. As células coradas em azul representavam as células mortas, enquanto que as células que não estavam coradas representavam as células viáveis. Foram contados 25 quadrados na parte superior e 25 na parte inferior, perfazendo um total de 50 quadrados contados. O cálculo de contagem foi obtido pela fórmula onde o número total de células contadas (mortas e viáveis) foi multiplicado pela diluição (nesse caso de 10, já que usamos 100 m l de uma suspensão celular de 1000 m l) e multiplicado por 104 (pelo volume contado que é 0,1 mm3 ou 104 ml). Esse valor foi dividido pelo número de quadrados contados (50). A partir dessa fórmula então obtivemos a quantidade de células presentes em cada frasco.
O número total de células presentes no frasco foi obtido através da equação 4.1.
Equação
4.1:
No
de células = No total de células contadas x diluição
x 104
dividido
por: No de quadrados usados para contagem
A suspensão restante (0,9 ml) foi centrifugada, o sobrenadante aspirado, e o precipitado ressuspendido em 1 ml de meio DME fresco. De acordo com a quantidade de células existentes, foi adicionado meio DME suficiente a essa suspensão para obter-se 1, 8 x 104 células em cada 100 m l. Essa nova suspensão de células foi novamente subcultivada em placas de 35 x 10 mm (Fig. 4.2) onde as células aderiram e cresceram. Para a manutenção da viabilidade das células a troca dos meios de cultivo das placas foi feita a cada dois ou três dias. Aguardamos 24 horas após o plaqueamento para começarmos os experimentos.

Figura 4.2: Placas de cultivo com 35 x 10 mm de área cultivável contendo as células que foram semeadas e divididas em 3 grupos e 9 subgrupos. Em cada contagem três placas de cada subgrupo foram paradas e a contagem foi feita em triplicata.
4.2. Lasers Utilizados
l = 786nm, 30mW, área do feixe = 0,01 cm2.
4.3. Grupos Experimentais
Para todos os experimentos foi utilizada a linhagem LMF.
Todos os procedimentos experimentais foram realizados sob capela de fluxo laminar, e as células foram incubadas em estufas de cultivo a 37ºC, em atmosfera úmida contendo 95% de ar e 5% de CO2.
O meio de cultivo utilizado foi meio DME, porém a quantidade de soro fetal bovino variava. Para lavagem das células era usada a solução tampão de PBSA, pH 7,2 e para seu levantamento era utilizada solução de tripsina a 0,25% em PBSA e 1% de EDTA.
Para os experimentos foi montado um sistema de aplicação onde o sistema ponteira laser e placa estivessem fixos. A ponteira do aparelho era colocada junto à placa que recebia a irradiação de baixo para cima, diretamente sobre a monocamada celular, num ponto único preestabelecido quando da fixação da ponteira no sistema. Dessa forma, as aplicações foram feitas do lado de fora da placa, sem necessidade de abrir as tampas das mesmas para receberem a irradiação, diminuindo assim os riscos de contaminação das células.
O aparelho laser foi colocado fora do fluxo laminar, e suas ponteiras foram colocadas dentro do fluxo laminar, previamente esterilizadas em autoclave. Todas as placas foram colocadas dentro do fluxo laminar ao mesmo tempo, inclusive as placas controle, e assim permaneciam até que a última placa do último grupo fosse irradiada. Assim sendo, todas as placas foram submetidas às mesmas condições de estresse. Quando chegava o momento da irradiação, as placas eram colocadas uma a uma no sistema e recebiam sua aplicação correspondente. A figura 4.3 ilustra esse esquema de aplicação.
As irradiações foram feitas sempre da mesma forma, variando apenas o tempo de aplicação, em função da irradiância, segundo o experimento. A fluência recebida no centro de cada placa foi fixada em 2 J/cm2 por placa, utilizando-se para tanto o conceito SAEF (Spatial Average Energy Fluence). A técnica de aplicação utilizada nos experimentos foi a técnica puntual, ou seja, a irradiação foi feita em um único ponto, sempre no centro da placa.
Para os grupos controle seguiram-se os mesmos processos de manipulação, simulando-se receber aplicação de laser, permanecendo fora da estufa de cultivo, com conseqüente variação de temperatura, e em obscuridade parcial, sempre nas mesmas condições que os grupos irradiados.
Na
figura 4.4 observamos o esquema de aplicação dentro do fluxo
laminar.


Figura 4.4: Detalhe do esquema de aplicação dentro do fluxo laminar. A caixa contendo as placas servia para garantir condição de obscuridade parcial.
Experimento 1
Na 7ª passagem as células foram tripsinizadas, centrifugadas, ressuspendidas em meio DME sem soro e semeadas em placas (plaqueamento) de 35 x 10 mm. A concentração celular para o seguinte plaqueamento foi de 1,7 x 103 células/placa.
Utilizaram-se um total de 81 placas divididas aleatoriamente em 3 grupos de 27 placas, a saber:
Grupo A: meio DME sem soro fetal bovino
Grupo B: meio DME + 5% de soro fetal bovino
Grupo C: meio DME + 10% de soro fetal bovino
Foram utilizados o L1 e o L2 nos parâmetros demonstrados na Tabela 4.1.
Tabela 4.1: Parâmetros de irradiação de L1 e L2:
|
|
|
|
| Área de irradiação |
|
|
|
|
|
|
|
|
|
|
A primeira irradiação realizou-se em campo escuro, 12 h após o plaqueamento, quando havia confluência de 50% na maioria das placas, e posteriormente a cada 12 h num total de 4 sessões com fluência de 2 J/cm2 por sessão. Como foram utilizados dois diferentes diodos laser (L1, L2), dividimos os grupos em três subgrupos correspondentes a:
GRUPO A1 = 9 placas = controle (sem irradiação)
A2 = 9 placas = irradiado com L1
A3 = 9 placas = irradiado com L2
Para os GRUPO B e C foram realizadas as mesmas subdivisões.
A contagem celular, em triplicata, realizou-se às 48, 96 e 144 horas após a 1ª irradiação. Os dados obtidos foram tratados estatisticamente.
Experimento 2
Na 9ª passagem as células foram tripsinizadas, centrifugadas, ressuspendidas em meio DME sem soro e semeadas em placas de 35 x 10 mm. A concentração celular para o seguinte plaqueamento foi de 1,7 x 103 células/placa.
Utilizaram-se um total de 81 placas divididas aleatoriamente em 3 grupos de 27 placas, a saber:
Grupo A: meio DME sem soro fetal bovino
Grupo B: meio DME + 5% de soro fetal bovino
Grupo C: meio DME + 10% de soro fetal bovino
Foram utilizados o L3 e o L4 nos parâmetros demonstrados na Tabela 4.2.
Tabela 4.2: Parâmetros de irradiação de L3 e L4:
|
|
|
|
| Área de irradiação |
|
|
|
|
|
|
|
|
|
|
A primeira irradiação realizou-se em campo escuro, 4 h após o plaqueamento, quando havia confluência de 50% na maioria das placas, e posteriormente a cada 12 h num total de 4 sessões com fluência de 2 J/cm2 por sessão. Como foram utilizados dois diferentes diodos laser (L3, L4), dividiu-se os grupos em três subgrupos correspondentes a:
GRUPO A1 = 9 placas = controle (sem irradiação)
A2 = 9 placas = irradiado com L3
A3 = 9 placas = irradiado com L4
Para os GRUPO B e C foram realizadas as mesmas subdivisões.
A contagem celular, em triplicata, realizou-se às 48, 96 e 144 horas após a 1ª irradiação. Os dados obtidos foram tratados estatisticamente.
4.3.1. Curvas de Crescimento e de Viabilidade Celular
A contagem celular foi realizada para a obtenção de curvas de crescimento e de viabilidade celular, com finalidade de análise do efeito do laser sobre os fibroblastos.
Para o levantamento das células, as placas de cultivo foram lavadas duas vezes com PBSA e submetidas à tripsinização individualmente. O conteúdo de cada frasco foi removido, colocado em tubo de ensaio e centrifugado. O sobrenadante dos tubos foi aspirado e os precipitados foram ressuspendidos em 1 ml de PBSA e 0,1 ml dessa suspensão celular foi dispensada em um tubo de ensaio, sendo adicionado 0,8 ml de PBSA e 0,1 ml de Azul de Trypan a 0,4%1. Fora do fluxo laminar, uma gota dessa mistura foi colocada em cada lado da Câmara de Neubauer, que foi levada ao microscópio invertido de fase para realização da contagem do número de células. Esse procedimento repetiu-se para cada placa estudada.
O número total de células foi registrado segundo a equação 4.1:
Equação
4.1:
No
de células = No total de células contadas x diluição
x 104
dividido
por No de quadrados usados para contagem
A exclusão das células coradas de azul, células mortas, da contagem geral serviu para a determinação do número de células viáveis (equação 4.2) e da porcentagem de viabilidade celular (equação 4.3).
Equação 4.2:
No
de células viáveis = No total de células
contadas (não coradas) x diluição x 104
dividido
pelo No de quadrados usados para contagem
O percentual de viabilidade da população celular foi obtido pela equação 4.3, segundo Freshney, 1990:
Equação 4.3: No total de células viáveis x 100 dividido pelo No total de células
As suspensões celulares restantes (0,9 ml de cada placa contada) não utilizadas na contagem, foram descartadas com jato de líquido de Dakin.
4.3.2. Análise Estatística
Os
pontos das curvas de crescimento e de viabilidade celular representavam
a média +/- o erro da média da contagem de 3 placas para
cada período experimental. Os dados obtidos foram comparados por
teste estatístico de análise de variância e complementado
pelo teste de Tukey (SNEDECOR & COCHRAN, 1967) para comparação
entre médias quando da presença de uma curva normal (Tabela
5.2 e 5.4). Foi aplicado o teste de Kruskal-Wallis (Gomes, 1990) quando
da presença de uma curva não normal, utilizando-se programa
de informática (GMC Basic Software, versão 7,1
- Brasil) (Tabela 5.6). As diferenças estatísticas foram
consideradas significantes ao nível de 5% (p £ 0,05).
5.1. Linhagem LMF
Foi desenvolvida a linhagem celular LMF, fibroblastos originados de gengiva humana.
A monitoração do crescimento foi feita macroscopicamente observando-se se havia alteração na coloração e viscosidade do meio de cultivo. A cor do meio, a cada 4 dias tornava-se mais amarelada, significando alto metabolismo celular como conseqüência do consumo de nutrientes do meio. A troca de meio foi feita em média a cada 4 dias.
Também foi feita monitoração por meio de microscópio de observação direta a cada dois dias de forma rotineira, e observou-se que os cultivos alcançavam 100% de confluência a cada 7 dias. O crescimento dos cultivos foi uniforme e não foi verificado nenhum tipo de irregularidade nem contaminação (Tabela 5.1).
Tabela 5.1: Média da contagem celular para os diferentes grupos controles.
|
|
||||
| GRUPO |
|
|
|
|
|
|
|
|
|
|
| B |
|
|
|
|
| C |
|
|
|
|
Tabela
5.2: Diferença entre médias do número de células
viáveis (x 103) obtidas nos dias 2, 4 e 6 que não
receberam irradiação, pelo teste de Kruskal-Wallis.
|
|
|
|
||||||||
|
|
Período
Grupo |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
S
= estatisticamente significante
NS
= não significante
A figura 5.1 apresenta as curvas de crescimento de células LMF cultivadas em meio DME com diferentes concentrações de soro fetal bovino e que não receberam irradiação (Grupos controles A1, B1 e C1). Nos grupos com SBF a 5%, a diminuição da concentração reduziu significativamente o crescimento celular a partir do quarto dia (p = 5%). Nos grupos com SBF a 0%, a falta de nutrientes levou à morte celular a partir do 2° dia (p = 5%).
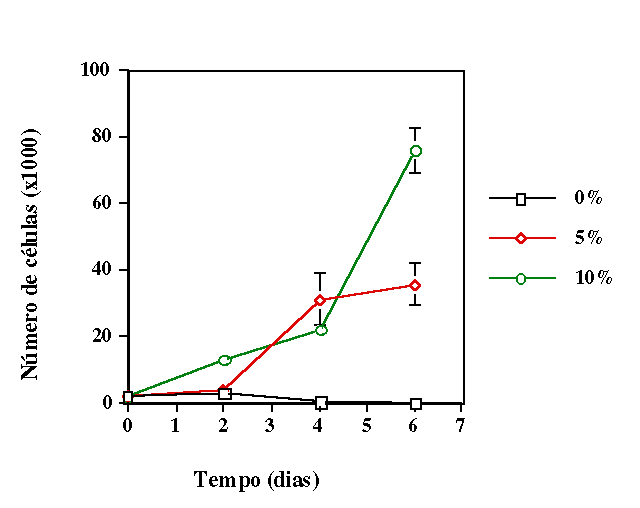
Figura 5.1: Observamos o crescimento celular das células LMF em meio DME com diferentes concentrações de soro fetal bovino.
Como
modelo de estudo foi proposto o estabelecimento de uma linhagem primária
de fibroblastos de gengiva humana. A morfologia das células obtidas
a partir de fragmentos de gengiva foi similar a do fibroblasto, apresentando-se
como células fusiformes ou estreladas conforme observa-se na figura
5.2.
Figura 5.2: Microscopia de fase onde podemos observar o aspecto de um cultivo controle em meio DME com 10% de soro fetal bovino. Células estão dispersas em pequeno número. Células em divisão são observadas (x 200).
A figura 5.3 apresenta a morfologia e distribuição de células LMF nos grupos irradiados após 96 horas, depois da primeira irradiação.
Figura 5.3: Grupo com DME e 5% de soro fetal bovino irradiado aos 4 dias apresentando várias células em divisão celular (x 100).
Figura 5.4: Grupo com DME e 10% de soro fetal bovino irradiado aos 6 dias. Observa-se grande tendência a formação de feixes paralelos (x 200).
5.2. Experimento 1
A tabela 5.3 apresenta os números de células viáveis para diferentes tempos dos cultivos de células LMF irradiados com os lasers de l = 670nm (L1) e l = 780nm (L2) e também para os controles não irradiados. Neste caso, para ambos os lasers utilizamos a mesma fluência.
Tabela 5.3: Média da contagem celular para os diferentes grupos
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SFB = soro fetal bovino
Tabela
5.4: Diferença entre médias do número de células
viáveis (x 103) obtidas nos dias 4 e 6 após a
irradiação, pelo teste de Kruskal-Wallis.
|
|
|
||||||
|
|
Período
Grupo |
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
As curvas de crescimento referentes aos experimentos realizados com os lasers L1 e L2 estão representadas nas figuras de 5.5 a 5.9, segundo a tabela 5.4.
A figura 5.5 apresenta as curvas de crescimento de células LMF cultivadas em meio DME sem soro fetal bovino. Os cultivos que não receberam irradiação (controles) apresentaram diminuição do número de células viáveis a partir da irradiação, culminando na morte de todas as células aos 4 dias após a primeira irradiação. Quando irradiados pelo laser L1 houve uma manutenção do número de células viáveis até 4 dias após irradiação e morte de todas as células aos 6 dias. O laser L2 produziu um aumento significativo (p = 0,1%) do número de células viáveis atingindo 7,33 x 103 ± 1,76 células no quarto dia após irradiação, porém aos 6 dias quase a totalidade das células morreram (1,33 x 103 ± 0,66).
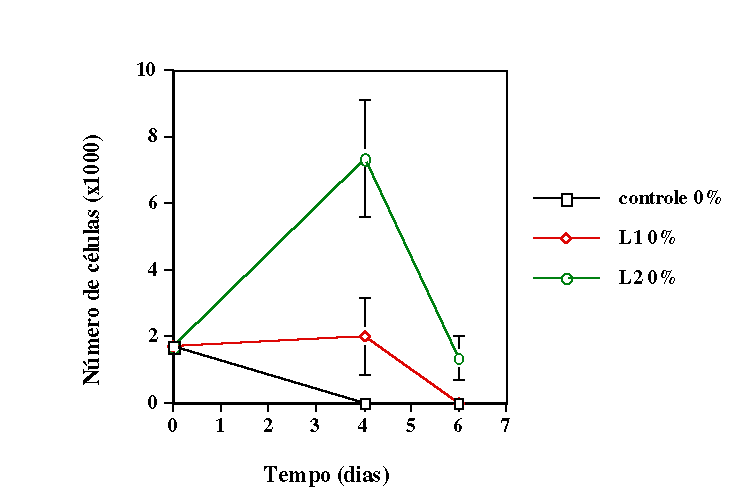
Figura 5.5: Crescimento de células LMF viáveis cultivadas em meio DME sem soro fetal bovino e irradiadas com os lasers L1 e L2.
A figura 5.6 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo 5% de soro fetal bovino. Os cultivos não irradiados (controles) apresentaram aumento do número de células viáveis atingindo 27 x 103 ± 4,66 células aos 6 dias após irradiação. Quando irradiados pelo laser L1 houve um aumento significativo (p = 0,1%) do número de células viáveis em relação ao controle atingindo 40,66 x 103 ± 1,33 aos 6 dias após irradiação. O laser L2 também produziu aumento significativo (p = 0,1%) do número de células viáveis atingindo 48,66 x 103 ± 3,71 aos 6 dias. Houve diferença significativa (p = 1%) aos 4 dias e aos 6 dias (p = 1%) entre as curvas de crescimento das culturas irradiadas.
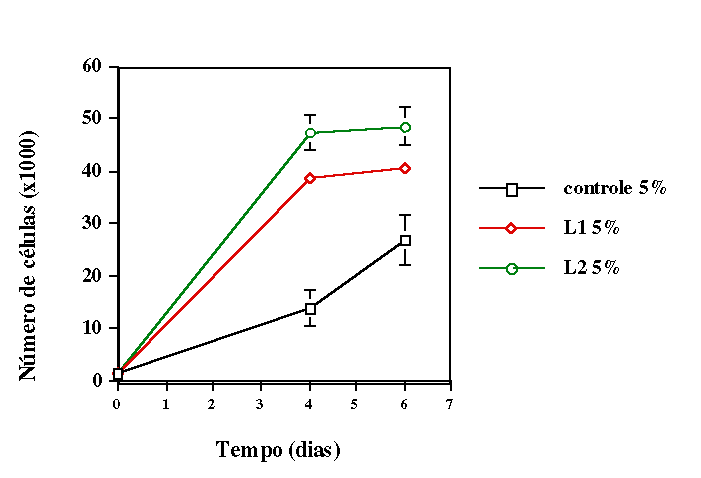
Figura 5.6: Crescimento de células LMF viáveis cultivadas em meio DME contendo 5% de soro fetal bovino e irradiadas com os lasers L1 e L2.
A figura 5.7 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo 10% de soro fetal bovino. Os cultivos que não receberam irradiação (controles) apresentaram aumento do número de células viáveis atingindo 72 x 103 ± 13,53 células aos 6 dias após irradiação. Quando irradiados pelo laser L1 houve um aumento significativo do número de células viáveis em relação ao controle até o quarto dia (35,33 x 103 ± 3,71) e até o 6° dia (100,66 x 103 ± 5,92) após a irradiação. A irradiação com o laser L2 também produziu aumento significativo do número de células viáveis em relação ao controle até o quarto dia (37 x 103 ± 4,72) e até o 6° dia (96 x 103 ± 8,08) após a irradiação. Os lasers L1 e L2 promoveram praticamente o mesmo crescimento celular não havendo portanto diferença significativa entre as curvas de crescimento das culturas irradiadas.
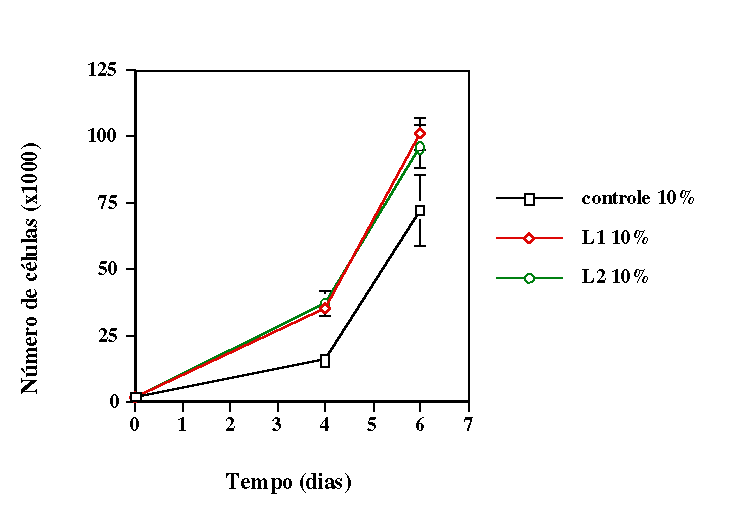
Figura 5.7: Crescimento de células LMF viáveis cultivadas em meio DME contendo 10% de soro fetal bovino e irradiadas com os lasers L1 e L2.
A figura 5.8 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo diferentes concentrações de soro fetal bovino as quais receberam irradiação com o laser L1. Os grupos que estavam em DME sem soro fetal bovino apresentaram manutenção inicial do número de células viáveis até 4 dias após irradiação, e morte entre 4 e 6 dias. Os grupos que estavam em DME com 5% de soro fetal bovino apresentaram aumento linear do número de células viáveis entre o primeiro e o quarto dia e um pequeno decréscimo da taxa de crescimento entre o 4° e o 6° dia após irradiação. Os grupos que estavam em DME com 10% de soro fetal bovino também apresentaram aumento linear do número de células viáveis entre o 1° e o 4° dia e significativo aumento da taxa de crescimento entre o 4° e o 6° dia após irradiação. Até o 4° dia os grupos irradiados com qualquer concentração de soro fetal bovino apresentaram crescimento similar, sendo que os grupos com 5% de SFB atingiram 38,66 x 103 + 1,76 células e os grupos com 10% de SFB atingiram a quantidade de 35,33 x 103 ± 3,71 células, não havendo portanto diferença significativa entre estes dois grupos neste período. Entre o 4° e o 6° dia, o primeiro grupo (5%) continuou crescendo atingindo 47,33 x 103 ± 1,33 células, enquanto que o segundo grupo (10%) atingiu 100,66 x 103 ± 5,92 células no sexto dia.
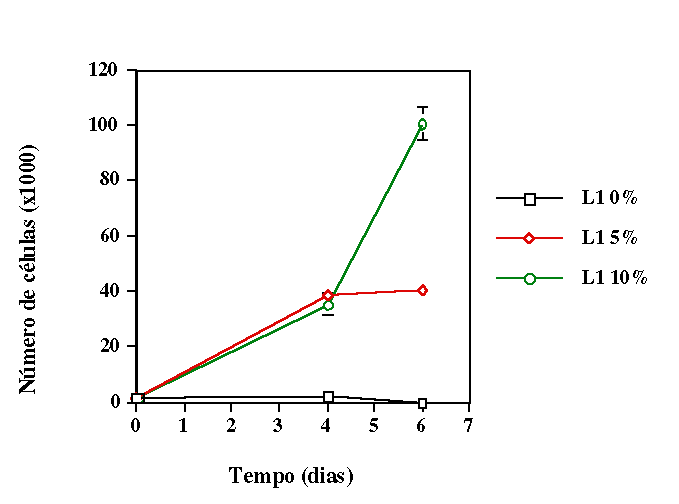
Figura 5.8: Crescimento de células LMF viáveis cultivadas em meio DME contendo diferentes concentrações de soro fetal bovino e irradiadas com o laser L1.
A
figura 5.9 apresenta as curvas de crescimento de células LMF cultivadas
em meio DME contendo as diferentes concentrações de soro
fetal bovino as quais receberam irradiação com o laser L2.
As curvas de crescimento apresentadas neste gráfico são similares
às do gráfico da figura 5.8, exceto pela diferença
significativa apresentada no 4° dia entre os grupos com 5% e 10% de
SFB.
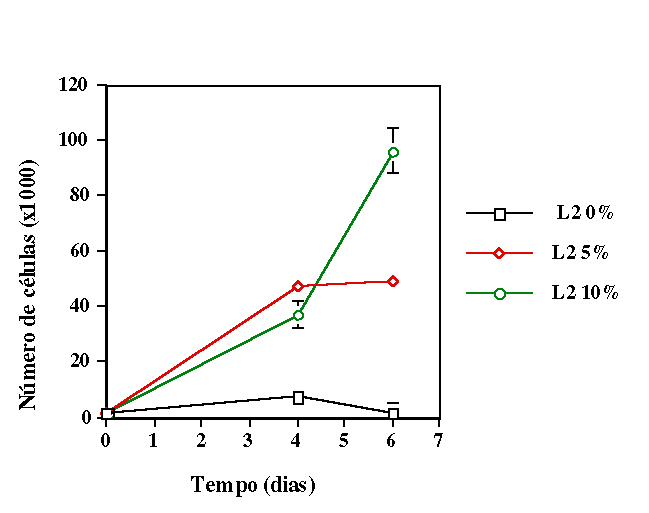
Figura 5.9: Crescimento de células LMF viáveis cultivadas em meio DME contendo diferentes concentrações de soro fetal bovino e irradiadas com o laser L2.
5.2. Experimento 2
A tabela 5.5 apresenta os números de células viáveis para diferentes tempos dos cultivos de células LMF irradiados com os lasers de l = 692nm (L3) e l = 786nm (L4) e também para os controles não irradiados. Neste caso a potência óptica de saída dos lasers foram iguais, assim como a fluência e a irradiância aplicada sobre as amostras.
Tabela 5.5: Média da contagem celular para os diferentes grupos.
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabela
5.6: Diferença entre médias do número de células
viáveis obtidas nos dias 2, 4 e 6 após a irradiação,
pelo teste de Tukey.
|
|
|
|
||||||||
|
|
Período
Grupo |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
As curvas de crescimento referentes aos experimentos realizados com os lasers L3 e L4 são apresentadas nas figuras 5.10 à 5.14, segundo a tabela 5.6.
A figura 5.10 apresenta as curvas de crescimento de células LMF cultivadas em meio DME sem soro fetal bovino. Os cultivos não irradiados (controles) apresentaram desde o tempo zero, diminuição do número de células viáveis culminando na morte de todas as células aos 4 dias após a irradiação. Quando irradiados pelo laser L3, pôde-se observar no segundo dia um aumento significativo do número de células viáveis (15,33 x 103 ± 1,76), quando comparado ao grupo controle (2,67 x 103 ± 0,67. Após este valor máximo, o número de células decresceu atingindo 8,67 x 103 ± 2,4 no 4° dia e 2,67 x 103 ± 0,67 no 6° dia. O laser L4 provocou um aumento, porém não significativo do número de células viáveis quando comparado ao grupo controle, chegando a atingir 7,33 x 103 ± 1,76. Aos 4 dias observou-se um decréscimo do número de células viáveis, atingindo 4 x 103 ± 1,15 e aos 6 dias a morte da quase totalidade das células (1,33 x 103 ± 0,67). Não houve diferença significativa entre os grupos irradiados com diferentes comprimentos de onda.
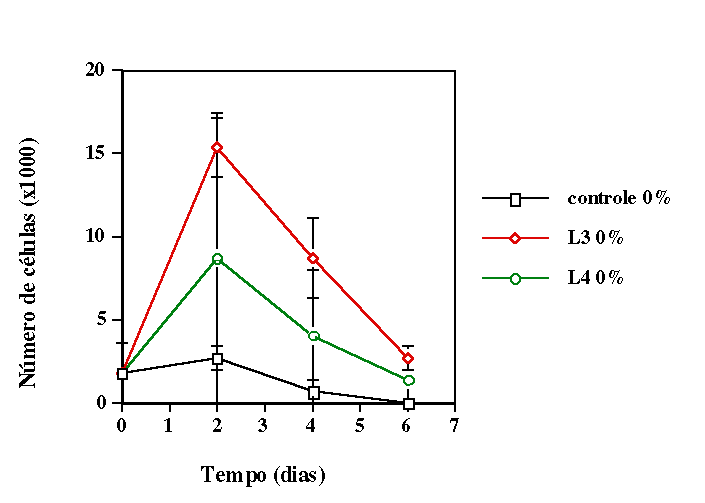
Figura 5.10: Crescimento de células LMF viáveis cultivadas em meio DME sem soro fetal bovino e irradiadas com os lasers L3 e L4.
A figura 5.11 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo 5% de soro fetal bovino. Os cultivos não irradiados (controles) apresentaram aumento do número de células viáveis atingindo 22 x 103 ± 2,31 células aos 6 dias após irradiação. Quando irradiadas pelo laser L3 houve um aumento significativo do número de células viáveis em relação ao grupo controle atingindo 70 x 103 ± 6,11células aos 6 dias após irradiação. O laser L4 também provocou aumento significativo do número de células viáveis atingindo 54,67 x 103 ± 4,67 células aos 6 dias. Houve diferença significativa entre as curvas de crescimento das culturas irradiadas.
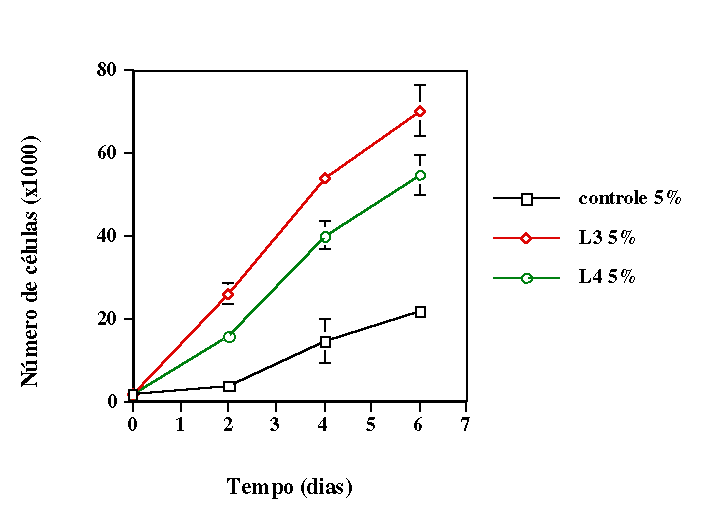
Figura 5.11: Crescimento de células LMF viáveis cultivadas em meio DME contendo 5% de soro fetal bovino e irradiadas com os lasers L3 e L4.
A figura 5.12 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo 10% de soro fetal bovino. Os cultivos não irradiados (controles) apresentaram aumento do número de células viáveis atingindo 78,67 x 103 ± 6,36 células aos 6 dias após irradiação. Quando irradiados pelo laser L3 não houve aumento significativo do número de células viáveis em relação ao grupo controle atingindo aos 6 dias, 88 x 103 ± 6,11 células. O laser L4 também não provocou aumento significativo do número de células viáveis em relação ao controle, atingindo aos 6 dias 86 x 103 ± 5,03 células. Não houve diferença estatisticamente significativa entre as curvas de crescimento dos grupos irradiados em relação ao grupo controle, nem entre os grupos irradiados com diferentes comprimentos de onda.
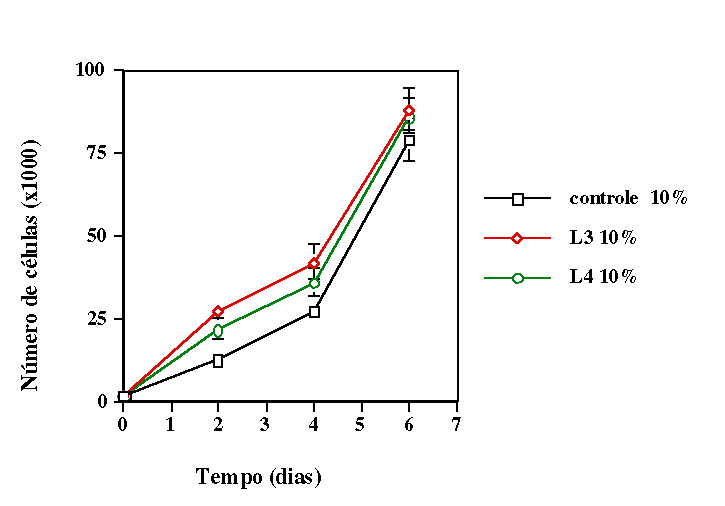
Figura 5.12: Crescimento de células LMF viáveis cultivadas em meio DME contendo 10% de soro fetal bovino e irradiadas com os lasers L3 e L4.
A figura 5.13 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo diferentes concentrações de soro fetal bovino as quais foram irradiadas com o laser L3. Os grupos em DME sem soro fetal bovino apresentaram aumento do número de células viáveis aos 2 dias atingindo 15,33 x 103 ± 1,76 células, após esse valor máximo, o número de células decresceu atingindo no 6° dia seu valor mínimo com 2,67 x 103 ± 0,67 células. Os grupos em DME com 5% de soro fetal bovino apresentaram aumento do número de células viáveis entre o 1° e o 6° dia após irradiação, com pequena redução da taxa de crescimento entre o 4° e o 6° dia. Os grupos em DME com 10% de soro fetal bovino apresentaram aumento do número de células viáveis entre o 1° e o 6° dia após irradiação, com aumento da taxa de crescimento após o 4° dia. Os grupos com SFB apresentaram número de células similares até o 2° dia; entre o 2° e o 5° dia a taxa de crescimento do grupo com 5% de SFB foi maior, sendo superado pelo grupo com 10% de SFB após este período. Não houve diferença significativa entre as curvas de crescimento das culturas irradiadas com SFB. Houve diferença significativa entre os grupos com SFB e sem SFB aos 6 dias.
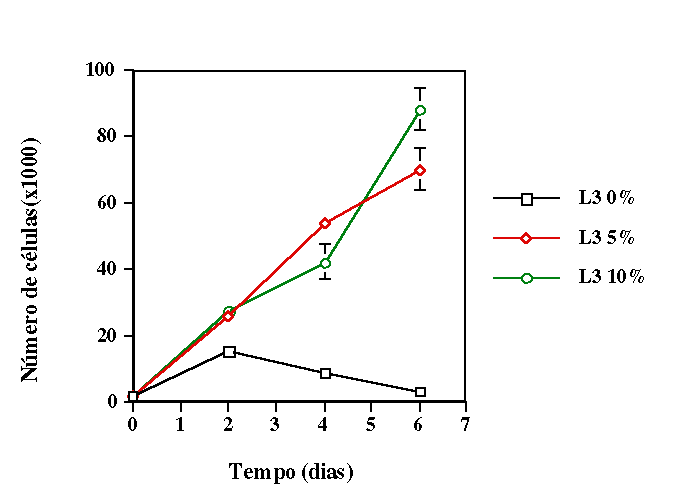
Figura 5.13: Crescimento de células LMF viáveis cultivadas em meio DME contendo diferentes concentrações de soro fetal bovino e irradiadas com o laser L3.
A figura 5.14 apresenta as curvas de crescimento de células LMF cultivadas em meio DME contendo diferentes concentrações de SFB, as quais receberam irradiação com o laser L4. Os grupos em DME sem soro fetal bovino apresentaram pequeno aumento do número de células viáveis aos 2 dias atingindo 8,67 x 103 ± 1,76 células, após esse período o número decresceu, atingindo aos 6 dias 1,33 x 103 ± 0,67 células. Os grupos em DME com 5% de SFB apresentaram aumento do número de células viáveis aproximadamente constante entre o 1° e o 6° dia após irradiação. Os grupos em DME com 10% de soro fetal bovino apresentaram aumento do número de células viáveis quase constante até o 4° dia, e após este período um aumento na taxa de crescimento. Os grupos com concentração de SFB não apresentaram diferença significativa entre si até o quarto dia sendo que no final deste período, o grupo com 5% de SFB apresentou 40 x 103 ± 3,46 células e o grupo com 10% de SFB, 36 x 103 ± 4,16 células. Aos 6 dias o grupo com 5% de SFB apresentou menor número de células, atingindo 54,67 x 103 ± 4,67, enquanto que o grupo com 10% de SFB apresentou número significativamente maior, atingindo 86 x 103 ± 5,03 células. Houve diferença significativa entre os grupos com SFB e sem SFB aos 6 dias.
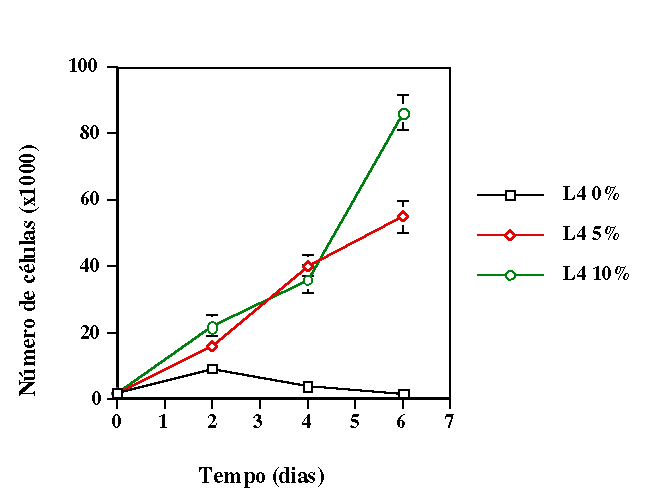
Figura
5.14 Crescimento de células LMF viáveis cultivadas em meio
DME contendo diferentes concentrações de soro fetal bovino
e irradiadas com o laser L4.
6.1. Aspectos Gerais do Laser de Baixa Potência
A bioestimulação com laser de baixa potência começou na Hungria com MESTER (1966) e a partir daí até a década de 80, foram reportados vários experimentos in vivo que visavam a estimulação do processo de cicatrização de feridas e estudos em modelos usando feridas e queimaduras em pele e mucosa de animais (BIHARI et al., 1989; ABERGEL et al., 1988; MESTER e MESTER, 1989). Os primeiros estudos foram feitos in vivo e concluíam que o laser de baixa potência afetava o processo metabólico celular e aumentava o potencial regenerativo dos tecidos biológicos (DYSON e YOUNG, 1982; TRELLES e MESTER, 1984; ABERGEL et al., 1987; TERRIBILE et al., 1988; YEW et al., 1989), tinha efeito antiinflamatório e sobre o sistema linfático (LIEVENS, 1986; 1988; TRELLES et al., 1988; 1989a; 1989b; EL SAYED et al., 1990), analgésico (WALKER, 1983; HERRERO, 1988; HANSSON, 1989) e vasodilatador (BENEDICENTI, 1982; TRELLES, 1983; MAYAYO e TRELLES, 1984; MIRÓ et al., 1984; KUBOTA e OHSHIRO, 1989).
Muitos desses trabalhos demonstravam os efeitos do laser de baixa potência e o reconheciam como terapêutico, entretanto, os autores ainda não conseguiam explicar completamente sua ação, sobretudo quando lhe atribuíram uma importante ação sistêmica (MESTER, 1977; WALKER, 1983; TRELLES et al., 1983; RUFFOLO, 1985; ANNEROTH et al., 1988; ROCHKIND et al., 1989).
Havia a necessidade, todavia, de serem feitos experimentos onde se trabalhassem com modelos mais específicos como células, ou grupo delas, isoladamente dentro de um determinado processo complexo, como é a cicatrização por exemplo, e assim se pudesse chegar a resultados mais conclusivos. Foi quando começaram a aparecer trabalhos in vitro, com modelos em cultura de células, buscando dessa forma maior facilidade para fixação de parâmetros e limitação de variáveis nesses experimentos (POURREAU-SCHNEIDER et al., 1989; 1990; YOUNG et al., 1990; KARU et al., 1991a; 19991b; 1991c; 1991d; BOLTON et al., 1991; 1992; FUNK et al., 1992; LUBART et al., 1992a; 1993; 1995).
À partir do final da década de 80, muitos autores e suas equipes como KARU e LUBART, passaram a buscar exaustivamente explicações para a elucidação dos mecanismos de ação do laser de baixa potência (KARU, 1985; 1987; 1988; 1989; 1990; 1991a; 1991b; 1991c; 1991d; FRIEDMAN e LUBART, 1992; 1996; LUBART et al., 1992b; 1993; 1995; 1996; 1997).
Sabia-se que clinicamente esses lasers não apresentavam ação quando aplicados em órgãos em condição de normalidade, e estudos in vivo demonstraram que não havia alteração significativa nos resultados obtidos em tecidos em homeostase quando irradiados (EL SAYED e DYSON, 1990).
A partir do início dessa década, pode-se concluir que em modelos de estudo onde se estabeleceu condição de homeostase, não houve efeito significativo do laser (NARA et al., 1991; HEIN et al., 1992; WEI YU et al., 1994; Rigau, 1996; POGREL et al., 1997; ALMEIDA-LOPES et al., 1998b).
Os lasers emitindo na região do visível foram os mais utilizados na terapia de cicatrização de feridas, desde MESTER (1966), mas com o advento dos diodos lasers semicondutores os clínicos começaram a trabalhar principalmente com comprimentos de onda emitidos no infravermelho próximo, devido ao baixo custo desses equipamentos. KARU, em 1988, sugeriu um mecanismo de ação diferente para os comprimentos de onda emitidos no visível e no infravermelho próximo, já que alguns autores tinham observado in vitro diferenças significativas quando trabalharam com ambos (ABERGEL et al., 1986; LAN et al., 1986). Com o passar do tempo, essas diferenças de resultados foram confirmadas in vitro por outros grupos de pesquisadores (YOUNG et al., 1989; NARA et al., 1992; LUBART et al., 1992a; 1995; LOEVSCHALL e ARENHOLT-BINDSLEV, 1994; ALMEIDA-LOPES et al., 1998b), e in vivo em modelos animais (AL-WATBAN e ZHANG, 1996), ainda que alguns autores não tenham observado variação nos resultados quando estudos clínicos em pacientes foram feitos (ALMEIDA-LOPES et al., 1999; RODRIGUES et al., 1999).
É claramente observado nos dados da literatura que os efeitos do laser foram dose-dependentes (GIMENEZ e CASADO, 1985; SHIROTO et al., 1989; CHIO et al., 1990; YOUNG et al., 1990; GROSS e JELKMANN, 1990; FUNK et al., 1992; LUBART et al., 1992a; KARU et al., 1995; 1996; 1997). Parâmetros de irradiação, como fluência e irradiância foram altamente relevantes para a obtenção de bons resultados. Os efeitos do laser de baixa potência dependeram da fluência in vitro (RICEVUTI et al., 1989; LUBART et al., 1992a; VAN BREUGEL e bär, 1992; KARU et al., 1996; KARU et al., 1997) e in vivo (AL-WATBAN e ZHANG, 1994; OSTUNI et al., 1994; SKINNER et al., 1996; LUBART et al., 1992b; 1996; 1997) e sua influência dependeu da fase do crescimento celular e do estado fisiológico em que a célula encontrava-se no momento da irradiação (NARA et al., 1991; HUG e HUNTER, 1991; STEINLECHNER e DYSON, 1993; KARU et al.,1995; RIGAU, 1996; GROSSMAN et al., 1998), bem como da freqüência e número de irradiações (POURREAU-SCHNEIDER et al., 1989; SKINNER et al., 1996), já que uma única irradiação não mostrou ser suficiente para a obtenção de algum efeito celular (POGREL et al., 1997).
A fluência administrada, 2 J/cm2, para reparação e cicatrização de feridas em pele e mucosa comprovou-se eficaz em diferentes trabalhos clínicos e laboratoriais (Mester, 1986; 1989; Trelles, 1989a; WEI Yu, 1994; BOLTON et al., 1991; 1992; 1995; SKINNER et al., 1996; WEBB et al., 1998; Almeida-Lopes, 1998b; ALMEIDA-LOPES, 1999) e que em nosso caso corrobora os resultados obtidos.
Fluências muito mais altas que a preconizada pela literatura inibiram a proliferação celular (OHTA et al., 1987; WEI YU et al., 1994; AL-WATBAN e ZHANG, 1995; BOLTON et al., 1995; LOWE et al., 1998; OCAÑA-QUERO et al., 1998) enquanto que fluências muito baixas não apresentaram nenhum tipo de ação (NARA et al., 1992; BOLTON et al., 1995; IN DE BRAEKT et al., 1991; HALL et al., 1994; CHELYSHEV e KUBITSKY, 1995; LOWE et al., 1998).
Para a obtenção de uma ação terapêutica do laser de baixa potência, não foi necessária a irradiação direta do tecido alvo, em muitos estudos in vivo apresentados (WAN et al., 1981; RODRIGO et al., 1985; TRELLES e MAYAYO, 1987; ROCHKIND et al., 1989), já que a irradiação do laser, ainda que local, comprovadamente induz à importantes efeitos sistêmicos.
O efeito estimulativo do laser de baixa potência na proliferação de células in vitro e na cicatrização tecidual in vivo não foi significativo quando células e tecidos encontravam-se em condições ideais de crescimento e manutenção, já que o tempo fisiológico do ciclo celular foi respeitado (HEIN et al., 1992; NARA et al., 1991; HEIN et al., 1992; LOEVSCHALL e ARENHOLT-BINDSLEV, 1994; Ocaña-Quero et al., 1998).
Trabalhos com células in vitro submetidas a algum tipo de condição de estresse, por exemplo déficit nutricional, evidenciaram proliferação significativa nos grupos irradiados com algum tipo de laser de baixa potência (RYHANEN et al., 1982; NARA et al., 1991; STEINLECHNER e DYSON, 1993; ALMEIDA-LOPES et al., 1998b).
O mecanismo de ação do laser no processo de reparação e cicatrização tecidual ainda não está totalmente esclarecido, entretanto, não há dúvida que a radiação laser aumenta o Ca2+ intra-celular (YOUNG et al., 1990; KARU, 1991d; FRIEDMAN e LUBART, 1992; 1996; LUBART et al., 1992b; 1996; 1997; GROSSMAN et al., 1998; LAVIE et al., 1999).
6.2. o Experimento com Células lmf
Estabelecemos uma linhagem a partir de cultivo primário de fibroblastos de gengiva humana, denominada LMF. Para simular condição de estresse celular, propusemos um modelo onde o cultivo estivesse privado parcialmente de nutrientes, ou seja, estivesse em meio DME com quantidade insatisfatória de fatores de crescimento. Observamos durante o crescimento do cultivo que, em condições ideais de nutrição (DME+ 10% de SFB), a divisão celular realizou-se em condições ótimas; então nos grupos irradiados o efeito estimulativo dos lasers utilizados, com a fluência administrada, foi baixo e não significativo. Por outro lado, com os cultivos em condições insuficientes de nutrição (DME + 5% de SFB), a divisão celular ocorreu em condição de estresse, aqui demonstramos que a irradiação com laser produziu um efeito bioestimulativo. Na condição de extrema desnutrição (DME + 0% de SFB) era esperado óbito celular em 48 horas, porém isso aconteceu somente nos grupos controle. Verificamos ainda que, quando os parâmetros de irradiação foram diferentes a resposta celular foi igualmente diferente. Observamos que, mesma fluência e irradiância diferente, com conseqüente diferença no tempo de irradiação entre os grupos irradiados, aumentou a proliferação celular com diferença estatisticamente significativa para ambos os grupos em relação ao controle, com resultados mais efetivos para radiação no infravermelho.
Irradiações de células em cultivo com parâmetros idênticos (mesma fluência e irradiância), evidenciou proliferação celular tanto para comprimento de onda no visível como no infravermelho, com resultados mais efetivos para radiação no visível.
Nossos resultados são corroborados por outros estudos in vivo que usaram como modelo mucosa animal (KUSAKARI et al., 1992; GÓMEZ-VILLAMANDOS et al., 1995; 1997; CRESPI et al., 1997) ou mucosa humana (ALMEIDA-LOPES et al., 1999; RODRIGUES et al., 1999) e estudos in vitro (PORREAU-SCHNEIDER et al., 1989; 1990; LOEVSCHALL e ARENHOLT-BINDSLEV, 1994; Almeida-Lopes, 1998b). Ressalta-se ainda, que os demais trabalhos não foram realizados com fibroblastos de origem oral, que têm comportamento diferente daqueles de origem cutânea.
Obtivemos uma linhagem celular através do método de dispersão enzimática de tecido gengival normal. As células cultivadas foram analisadas por meio de métodos morfológicos e funcionais e caracterizados como fibroblásticas diferenciadas, ou fibroblastos.
A formação da linhagem celular, denominada LMF, foi originada a partir de cultivo primário de fragmentos de gengiva humana normal e livre de enfermidade. Podemos afirmar que a linhagem foi obtida uma vez que houve um aumento do número total de células através de diversas gerações e a população celular predominante apresentou grau de uniformidade (FRESHNEY, 1990).
Os fibroblastos crescem e desenvolvem-se optimamente in vitro quando estão em condições ideais de temperatura, pressão e fatores nutricionais e de crescimento em seu meio de cultivo ideal para fibroblastos é aquele cuja concentração de soro fetal bovino seja de 10% (PAUL, 1993). Tratamos então todos os grupos em condições ideais de temperatura, pressão e umidade e variamos a condição nutricional dos meios de 4 cultivos. Havia um grupo controle com meio DME com 10% de soro fetal bovino, que seria o grupo em condições ideais. Propusemos um modelo de estudo cujos cultivos estivessem com meios em diferentes condições nutricionais, ou seja, diferentes concentrações de soro fetal bovino. Um grupo foi tratado com meio DME com 5% de soro fetal bovino, simulando uma condição de estresse; e outro grupo com meio DME sem soro fetal bovino, simulando uma condição de absoluta deficiência nutricional. A diminuição da concentração de soro fetal bovino no meio diminuiu significativamente o crescimento celular. Nos grupos sem soro fetal bovino o controle não apresentou crescimento algum.
A utilização de meio com concentração de 5% de soro fetal bovino mostrou ser um modelo ideal para a análise da ação do laser de baixa potência, já que o crescimento celular diminui proporcionalmente à concentração de soro. A utilização de meio sem soro fetal bovino mostrou ser um modelo não ideal para análise da ação do laser de baixa potência, já que em 144 horas todos os cultivos morreram, controles e irradiados.
Experimento 1
Os grupos irradiados contendo 10% de soro fetal bovino não apresentaram diferença significativa entre si.
Para os grupos em condições de déficit nutricional com 5% de soro fetal bovino, observamos diferença significativa no número total de células entre os grupos irradiados e entre os irradiados e o controle. Houve maior proliferação celular nos grupos irradiados com o laser emitindo radiação no infravermelho próximo.
De forma a manter a mesma fluência (2J/cm2) para os dois lasers, o laser operando em 670 nm com potência nominal de 4 mW, irradiou os cultivos por um período de 8,3 minutos, enquanto que o laser operando em 780 nm e potência nominal de 50 mW, irradiou os cultivos por um período de 0,7 minutos.
Para os grupos em condição de déficit nutricional absoluto, sem soro fetal bovino, observamos diferença significativa no número total de células entre os grupos irradiados e entre os irradiados e o controle até os 4 dias; depois desse período não houve diferença significativa, já que todos morreram.
Experimento 2
Os grupos irradiados contendo 10% de soro fetal bovino não apresentaram diferença significativa entre si e entre os irradiados e os controle.
Para os grupos em condições de déficit nutricional com 5% de soro fetal bovino, observamos diferença significativa no número total de células entre os grupos irradiados e entre os irradiados e o controle. Houve maior proliferação celular nos grupos irradiados com o laser emitindo radiação no visível.
Neste caso como as potências nominais dos dois lasers utilizados (l = 692 nm e 786 nm) eram iguais a 30 mW, para manter a fluência igual a 2J/cm2, utilizamos tempo de exposição igual a 1,1 minutos, para ambos lasers.
Para os grupos em condições de déficit nutricional absoluto, sem soro fetal bovino, observamos diferença significativa no número total de células entre os grupos irradiados e entre os irradiados e o controle até os 4 dias; depois desse período não houve diferença significativa, já que todos morreram.
Experimento 1 e 2
No modelo proposto com condição de déficit nutricional parcial (5% SFB) a aplicação de laser induziu a proliferação celular, comprovando ser um modelo viável. O mesmo não podemos dizer do modelo com condição de déficit nutricional total (sem SFB) uma vez que a maioria das células em todos os grupos estavam mortas após 4 dias do início do experimento.
Quando observamos as curvas de crescimento dos grupos irradiados com concentração de 5% de soro fetal bovino irradiados verificamos que esses grupos atingiram o mesmo número de células que os grupos controle em meio com 10% de soro fetal bovino, sobretudo após 96 horas, que era o crescimento normal. Este aumento pode ter sido induzido pela produção de fatores autócrinos de crescimento, que são fatores que a própria célula sintetiza e que age sobre ela mesma (ALBERTS et al.,1989). O que ratifica que o laser de baixa potência atua como potencializador das funções celulares quando em condições adversas. Nos grupos sem soro fetal bovino os controles não apresentaram crescimento algum enquanto que os irradiados apresentaram crescimento significativamente maior, provavelmente porque a proliferação celular induzida pelo laser produziu a reposição de fatores de crescimento no meio de cultura.
Tendo em vista que as células utilizadas apresentam praticamente a mesma absorção para os dois lasers emitindo radiação nos comprimentos de onda de 670 nm e 692 nm (apêndices 2.a e 2.b), podemos considerar que os resultados obtidos na faixa do visível dependeram fundamentalmente das variações da fluência e irradiância a que foram submetidas as amostras. Esta assertiva é também válida para os lasers emitindo radiação em 780 nm e 786 nm, uma vez que a absorção destes comprimentos de onda pelas células é também praticamente o mesmo (apêndices 2.a e 2.b).
Analisando a curva de crescimento da figura 5.11 (mesma fluência e irradiância), temos que o laser emitindo radiação em 692 nm, induziu maior proliferação celular que o laser emitindo em 786 nm. Comparando o resultado acima com o da figura 5.6 podemos observar que no segundo caso o melhor efeito foi obtido com o laser emitindo na região do infravermelho, levando-nos a inferir que tempos de exposição à radiação muito longos podem levar as células em cultura a uma condição de estresse.
Pudemos observar uma tendência ao alinhamento dos fibroblastos dos grupos irradiados (Fig. 5.4), já citado na literatura por ENWEMEKA et al. em 1990, e inferido pelo trabalho de TANG et al., em 1997. Poderia ser ainda uma das explicações da qualidade estética superior das cicatrizes formadas clinicamente nos pacientes submetidos a essa terapia.
6.3. Discussão Final
Em linhas gerais são numerosos os estudos que se vêm realizando sobre a ação do laser de baixa potência na cicatrização de tecidos e reparação de feridas, principalmente enfocando lesões cutâneas, sobretudo aquelas relacionadas à prática médica (úlceras, queimaduras, feridas cirúrgicas) onde se demonstra aceleração e melhora estética das lesões tratadas. Entretanto, observa-se uma escassez de trabalhos científicos em lesões superficiais de mucosa, e estudos in vitro utilizando fibroblastos de mucosa, talvez devido ao fato de que não exista uma casuística clínica muito extensa, ou a que as complicações do tipo cicatricial não sejam tão freqüentes ou tão graves em odontologia como em dermatologia ou outras especialidades médicas. De qualquer forma, em odontologia existem lesões na mucosa oral, sobretudo aquelas que se apresentam após cirurgias extensas de pacientes imunodeprimidos, sendo a infecção a mais grave delas. Como se observou nos estudos clínicos, existe uma ação terapêutica do laser de baixa potência muito significativa sobretudo na aceleração e qualidade da cicatrização conforme demonstraram diversos resultados encontrados na literatura. A aceleração da cicatrização tecidual fica justificada por resultados obtidos por trabalhos de autores como ABERGEL et al., 1986; POURREAU-SCHNEIDER et al., 1990; TSUCHIDA et al., 1991; VAN BREUGEL et al., 1992; BOLTON et al., 1992; KUSAKARI et al., 1992; NOGUEROL et al., 1994) e outros autores que demonstraram aumento da capacidade mitótica celular e incremento na proliferação de fibroblastos bem como incremento da síntese de colágeno (ABERGEL et al., 1986; LAM et. al., 1989; ENWEMEKA et al., 1990; KERT e ROSE, 1989; HUBACEK et al., 1991; SKINNER et al., 1996). Igualmente TRELLES e MESTER, 1984; KAMEYA et al., 1995; WEI YU et al., 1997a e REDDY, et al., 1998, indicaram que a radiação laser favorece a formação precoce de tecido de granulação bem como da vascularização local (KUBOTA e OHSHIRO, 1989; MAIER et al., 1990, WEI YU et al., 1997a).
Portanto, à vista da bibliografia compulsada, parece ser um princípio fundamental aplicar-se o laser de baixa potência nas primeiras 24 horas após a injúria, pois é nessa fase que se observa, nas áreas irradiadas, uma maior afluência de elementos defensivos e um elevado número de mitoses das células do estrato germinativo. Tudo isso provocará a retirada precoce de detritos tissulares da lesão, favorecendo a formação de tecido de granulação nas sessões seguintes à irradiação e, em conseqüência, aceleração do processo de cicatrização, como se evidencia nos resultados macroscópicos relatados na literatura. Observamos que naqueles trabalhos onde a irradiação com laser foi realizada alguns dias após a injúria, não foi observada alteração significativa do tempo do processo cicatricial (SMITH et al., 1992).
Por outro lado, o número de brotos vasculares encontrados nas áreas de mucosa irradiada aumenta a reabsorção de restos celulares e aporte de elementos de defesa, contribuindo também para a aceleração do processo cicatricial das lesões, como indicam EL SAYAD e DYSON, 1990; VAN BREUGEL e BÄR, 1992; LUBART et al., 1997; WEBB et al., 1998.
Sabemos ainda que a infecção constitui talvez o motivo mais importante do atraso e inclusive do fracasso na cicatrização de feridas, queimaduras, úlceras, entre outras lesões, motivo pelo qual se presta especial atenção à administração de antibioticoterapia preventiva nesses pacientes. Observamos nos dados da literatura que o laser tem ainda uma ação direta que favorece a prevenção de infecção em nível local (LIEVENS, 1991; FILONENKO, 1995; GÓMEZ-VILLAMANDOS et al., 1997; SASAKI e OHSHIRO , 1997). Esta ação deve-se a vários fatores, entre eles sua ação sobre a microcirculação local, originando maior aporte sangüíneo na região irradiada com conseqüente aumento de elementos defensivos humorais, assim como efeito sobre o trofismo local que provoca um incremento na capacidade fagocitária pelo aumento de macrófagos na zona afetada (HUBACEK et al., 1985; KARU et al., 1989; YOUNG et al., 1989; SILVEIRA et al., 1991).
Como conclusão, estes trabalhos evidenciaram claro efeito terapêutico nas lesões irradiadas com laser, efeito que se traduziu em cicatrização antecipada e ausência de sinais de infecção, tanto microscopicamente como macroscopicamente.
Nossos resultados substanciam esta ação e sugerem que, em fibroblastos de mucosa oral, a ação se dará da mesma maneira. Por outro lado, levam-nos a inferir que pacientes com algum comprometimento do processo de reparação são os que deverão ter maior benefício quando submetidos a esse tipo de terapia.
O laser de baixa potência possibilita um tratamento fácil e de baixo custo, podendo substituir ou complementar diversas terapias tanto na clínica médica como na odontológica.
Apesar
de diversos trabalhos corroborarem o efeito bioestimulador do laser de
baixa potência, são necessárias mais pesquisas e comprovações
clínicas com a finalidade de determinar suas ações
sobre a particularidade de cada quadro patológico. Faz-se também
necessário uma padronização rigorosa quanto à
variação de parâmetros de irradiação
tais como comprimento de onda, fluência, irradiância e número
de sessões de aplicação de forma a obter-se resultados
reproduzíveis.
Para fibroblastos de gengiva humana em cultura podemos concluir que:
A:
Angström
As-Ga:
Arsenieto de gálio
As-Ga-Al:
Arsenieto de gálio-alumínio
ATP:
Adenosina-trifosfato
ADP:
Adenosina-difosfato
C:
Centígrado
cél:
Célula
cels:
Células
cm:
Centímetro
cm2:
Centímetro quadrado
l:
Comprimento de onda
CO2:
Dióxido de carbono
DE:
Densidade de Energia
DP:
Densidade de Potência
DME:
Eagle modificado por Dulbecco
DMSO:
Di-metil sulfóxido
DNA:
Ácido desoxirribonucléico
EDTA:
Ethylenediamine-tetraacetic acid = Ácido etilenodiamino tetraacético
EGF:
Epidermal
Growth Factor = Fator de crescimento epidérmico
EGF-R:
Receptor de EGF
f:
Freqüência
FAF:
Fibroblast Activating Factor = Fator ativador de fibroblasto
aFGF:
Acid
Fibroblast Growth Factor = Fator de crescimento ácido do fibroblasto
bFGF:
Basic
Fibroblast Growth Factor = Fator de crescimento básico do fibroblasto
FGF-R:
Receptor de FGF
F:
Diâmetro do feixe laser
g:
Grama
Ga:
Gálio
h:
Horas
He-Cd:
Hélio Cádmio
HeLa:
Células de linhagem HeLa
He-Ne:
Hélio Neônio
Hz:
Hertz
IGF
I: Insulin-like Growth Factor = Fator de crescimento semelhante
à insulina I
IGF
II: Insulin-like Growth Factor = Fator de crescimento semelhante
à insulina II
IL-1:
Interleukin-1
= Interleucina-1
IL-6:
Interleukin-6
= Interleucina-6
IL-8:
Interleukin-8
= Interleucina-8
J:
Joules
Kg:
Kilograma
m:
Metro
M:
Mol
mg:
Miligramo
min:
Minutos
mks:
Sistema metro-kilogramo-segundo
ml:
Mililitro
ml:
Microlitros
mm:
Milímetro
mM:
Milimol
m/s:
Minutos por segundo
mrad:
Miliradiano
mW:
Miliwatts
mm:
Micrômetro
N2:
Nitrogênio
nm:
Nanômetros
O2:
Oxigênio
P:
Potência
PBSA:
Phosphate
Buffer Saline = Solução tampão fosfato-salina
sem cálcio e magnésio
pH:
Potencial hidrogeniônico
PM:
Peso molecular
RNA:
Ácido ribonucléico
RNAm:
Ácido ribonucléico mensageiro
s:
Segundo
SFB:
Soro fetal bovino
TEM:
Transversal
Eletromagnetic Mode = Modo eletromagnético transversal
TEMoo:
Gaussian
Laser Beam = Raio laser gaussiano
TGFa
: Transforming Growth Factor alfa = Fator de crescimento transformante
alfa
TGFb
: Transforming Growth Factor beta = Fator de crescimento transformante
beta
TNF-a
: Tumor Necrosis Factor-alfa = Fator de necrose tumoral-alfa
W:
Watts
°C:
Graus Celsius
x
100 = Aumento de 100 vezes
x
200 = Aumento de 200 vezes