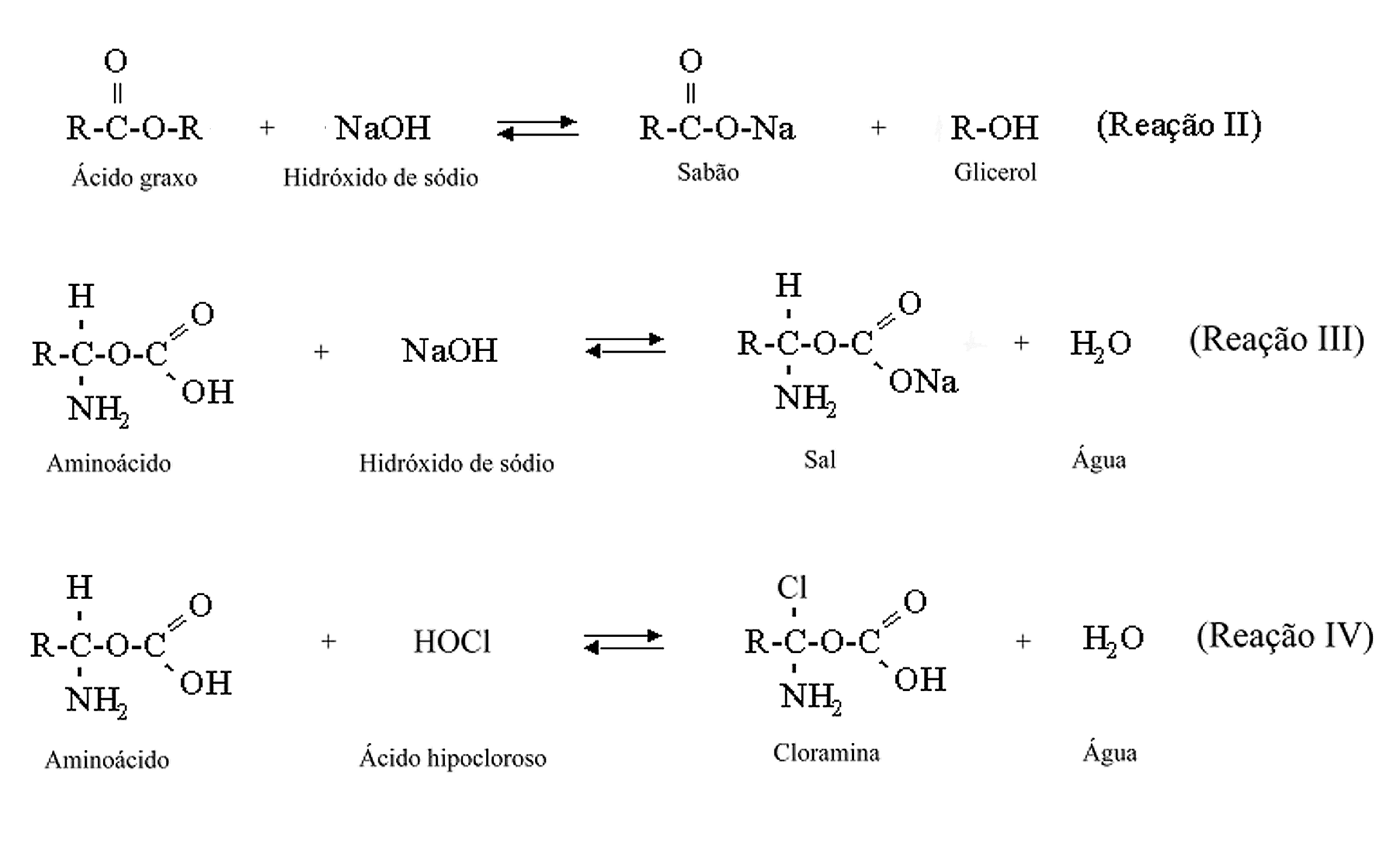
Equação
I: ![]()
ESTUDO
"IN VITRO" DAS PROPRIEDADES FÍSICO-QUÍMICAS
DAS
SOLUÇÕES DE HIPOCLORITO DE SÓDIO, EM DIFERENTES CONCENTRAÇÕES,
ANTES E APÓS A DISSOLUÇÃO DE TECIDO PULPAR BOVINO.
Dissertação
de mestrado apresentada em Ribeirão Preto no dia 25 de junho de
1999
Banca
Examinadora:
Prof.
Dr. Jesus Djalma Pécora, Prof. Dr. Luis Fernado Guimarães
e Prof. Dr. Ricardo Gariba Silva
SPANO, J.C.E. Estudo "in vitro" das propriedades físico-químicas das soluções de hipoclorito de sódio, em diferentes concentrações, antes e após a dissolução de tecido pulpar bovino. Ribeirão Preto, 1999, 96p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
Estudou-se, "in vitro", a dissolução do tecido pulpar bovino promovida pela solução de hipoclorito de sódio nas concentrações de 0,5, 1,0, 2,5 e 5,0 por cento e analisou-se, também, o potencial hidrogeniônico, a tensão superficial, a condutividade iônica e o teor de cloro, antes e depois da utilização dessas soluções no processo de dissolução.
Secionava-se um fragmento da porção central da polpa de incisivos centrais inferiores de bovinos e os seus pesos foram anotados.
Para a realização do teste de dissolução, confeccionou-se um dispositivo conectado a uma bomba peristáltica, que promovia a agitação da solução. Assim que o fragmento pulpar era colocado no interior desse dispositivo, ligava-se a bomba peristáltica e acionava-se um cronômetro.
O tempo de dissolução era tido como o tempo decorrido entre a colocação do fragmento de polpa nas soluções e o seu total desaparecimento (dissolução). Com base no tempo de dissolução da polpa e de sua respectiva massa, calculava-se a velocidade de dissolução. Após a dissolução, o líqüido remanescente era submetido à análise do potencial hidrogeniônico, da tensão superficial, da condutividade iônica e do cloro remanescente.
Os dados obtidos foram submetidos ao tratamento estatístico e, de acordo com a metodologia empregada e com os resultados obtidos, é lícito concluir que: a) a velocidade de dissolução dos fragmentos de polpa bovina é diretamente proporcional à concentração da solução de hipoclorito de sódio, ou seja, quanto maior a concentração, mais rápida é a dissolução; b) a variação porcentual do potencial hidrogeniônico das soluções de hipoclorito de sódio testada, após a dissolução, é inversamente proporcional à concentração inicial da solução, ou seja, quanto maior a concentração inicial das soluções de hipoclorito de sódio, tanto menor será a redução de seu potencial hidrogeniônico; c) as soluções de hipoclorito de sódio nas concentrações estudadas apresentaram redução dos valores da condutividade iônica após o processo de dissolução do tecido pulpar bovino, com diferenças estatisticamente não-significantes entre elas; d) o estudo da tensão superficial das soluções, antes e após a dissolução tecidual, evidenciou que essa propriedade varia de modo diretamente proporcional à concentração, ou seja, quanto maior a concentração inicial da solução de hipoclorito de sódio, maior será a redução da tensão superficial; e) o teor de cloro remanescente das soluções de hipoclorito de sódio após o processo de dissolução do tecido pulpar bovino, apresentou-se de modo diretamente proporcional em relação à concentração, ou seja, quanto maior a concentração de cloro inicial, tanto maior será a concentração de cloro remanescente.
No final do século passado, já era clara, para os profissionais e pesquisadores que se dedicavam ao tratamento dos canais radiculares, a necessidade de se obter a limpeza, a desinfecção e a modelagem do canal radicular para sua posterior obturação (KIRK25, 1893; CALLAHAN6, 1894).
Assim, para a realização desse objetivo, há a necessidade de se utilizarem instrumentos (limas, alargadores e brocas), bem como de se usarem soluções químicas auxiliares da instrumentação e preparo dos canais radiculares.
O sucesso do tratamento endodôntico repousa no completo respeito às diferentes fases: preparo biomecânico, controle da desinfecção e obturação dos canais radiculares (MACHTOU29, 1980).
Esse paradigma (metodologia) estabelece que a biomecânica, fase que consiste na ação de instrumentos e soluções químicas no interior do canal radicular, constitui uma das etapas de máxima importância no tratamento endodôntico e foi minuciosamente estudada por muitos pesquisadores, dentre os quais podemos citar: CALLAHAN6 (1894), GROSSMAN17 (1943), STEWART52 (1955), INGLE & ZELDOW23 (1958), GROSSMAN18 (1960), NICHOLLS39 (1962), SCHILDER47 (1974), WEINE62 (1976), PAIVA & ANTONIAZZI40 (1988), DEUS12 (1992) e LEONARDO & LEAL28 (1991).
Como as variações da anatomia interna do canal radicular dificultam a ação dos instrumentos em todas as suas paredes, faz-se necessária a utilização de uma solução química que auxilie nessa tarefa.
Dessa forma, a biomecânica envolve uma fase mecânica e uma fase química, que não são separadas, mas acontecem simultaneamente. Enquanto a ação mecânica atua preparando, modelando e alargando o canal radicular, a química atua sobre os componentes presentes no interior do sistema de canais radiculares, de modo a realizar a dissolução de tecidos orgânicos, vivos ou necrosados, remover "débris" e eliminar microrganismos.
Portanto, as soluções auxiliares devem apresentar propriedades físico-químicas que as qualifiquem para esses atos.
Desde o início do atual paradigma endodôntico, inúmeras soluções químicas auxiliares da instrumentação têm sido defendidas e empregadas. Muitas delas não são mais utilizadas, ficando apenas registradas na literatura especializada, e outras ainda estão em uso.
Dentre as soluções auxiliares utilizadas atualmente, as soluções de hipoclorito de sódio, em diferentes concentrações, são as mais usadas, e mundialmente aceitas pelas suas propriedades de clarificação, dissolução de tecido orgânico, saponificação, transformação de aminas em cloraminas, desodorização e ação antimicrobiana.
Segundo PUCCI43 (1945), a introdução de uma solução de hipoclorito de sódio no arsenal terapêutico data de 1792 com o nome de água de Javelle. Em 1820, o químico francês Labaraque introduziu o hipoclorito de sódio a 2,5%, que ficou conhecido com o nome de licor de Labaraque.
Em 1915, durante a primeira grande guerra, o químico americano H. D. DAKIN realizou um estudo com as soluções de hipoclorito de sódio e ressaltou seu valor antisséptico, salientando, porém, a sua capacidade de irritar tecidos vivos, em virtude de sua alta concentração de hidroxila. Assim, propôs uma solução de hipoclorito de sódio a 0,5% com potencial hidrogeniônico próximo ao neutro. A redução do potencial hidrogeniônico foi realizada com a adição do ácido bórico. Essa solução ficou conhecida como solução de Dakin em sua homenagem.
Logo em seguida, em 1917, BARRETT5 salientou o valor terapêutico da solução de Dakin na Odontologia e divulgou seu uso parra diversas ações terapêuticas.
Os estudos de WALKER61 (1936), GROSSMAN & MEIMAN16 (1941) e GROSSMAN17 (1943) na pesquisa de soluções auxiliares atestaram o valor da solução de hipoclorito de sódio a 5,0% de cloro ativo, e essa solução passou a ser amplamente difundida como solução irrigante de canais radiculares.
Para observar a ação do hipoclorito de sódio sobre a limpeza, desinfecção, dissolução de tecido, biocompatibilidade, aumento de permeabilidade dentinária, dentro do pequeno ambiente radicular, inúmeros trabalhos foram realizados e, dentre eles, podem citar-se: MARSHALL31 (1960), STEWART et al.53 (1969), SHIH50 (1970), SENIA et al.49 (1971), ROBAZZA44 (1973), NERY et al.38 (1974), MARTIN32 (1975), McCOMB & SMITH33 (1976), TREPAGNIER et al.58 (1977), HAND et al.20 (1978), CUNNINGHAM & BALEKJIAN (1980), WENNBERG63 (1980), CUNNINGHAN & JOSEPH10 (1980), ABOU-RASS & PICCININO2 (1982), MOORER & WESSELINK35 (1982), PÉCORA41 (1985), FOGEL & PASHLEY13 (1990), CHEUNG & STOCK7 (1993), SAVIOLI et al.46 (1993), BARBOSA et al.4 (1994) e PEREZ et al.42 (1996).
Assim, o hipoclorito de sódio, em diferentes concentrações, tem aplicação em Endodontia de modo seguro e aceito internacionalmente.
Observam-se, porém, poucas investigações quanto à capacidade do hipoclorito de sódio em dissolver o tecido pulpar e, em especial, não há informação sobre as condições físico-químicas dessa solução após realizar sua ação solvente.
Na tentativa de obter uma solução irrigante ideal, um grande número de pesquisadores têm proposto e estudado, desde o século passado, as mais diversas soluções auxiliares da instrumentação.
Assim, KIRK25 (1893) difundiu o uso do dióxido de sódio para a irrigação dos canais radiculares. Essa solução não só limpava o canal radicular como clarificava a dentina, por ser um potente agente oxidante.
SCHREIER48 (1893) preconizava a aplicação do sódio e potássio metálicos para a limpeza e desinfecção dos canais radiculares. Essas substâncias, ao entrarem em contato com a umidade do canal radicular, formavam o hidróxido e sódio e o hidróxido de potássio, respectivamente.
CALLAHAN6 (1894) propôs a utilização do ácido sulfúrico a 40% para a irrigação dos canais radiculares. Essa solução era neutralizada, a seguir, com uma solução de bicarbonato de sódio.
HARLAN21 (1900) indicava a papaína como solução irrigante dos canais radiculares por ser um excelente solvente de matéria orgânica. Essa teoria não teve defensores e, até hoje, merece ser estudada.
BARRETT5 (1917) difundiu o uso da solução de Dakin para a irrigação de canais radiculares e relatou a eficiência dessa solução como antisséptico.
TAYLOR & AUSTIN55 (1918) mostraram a ação solvente da solução de Dakin sobre tecido não vital e observaram, ainda, que essa solução é pouco irritante aos tecidos normais.
COOLIDGE8 (1929) já concluía que o ato de limagem, irrigação e aspiração são artifícios mecânicos que retiram parte dos restos pulpares, raspas de dentina, tecidos necróticos e microrganismos. No entanto, necessita-se de um auxílio químico para melhorar a limpeza e a desinfecção do canal radicular.
A solução de hipoclorito de sódio tem sido empregada há muito tempo na instrumentação dos canais radiculares, mas sua grande divulgação ocorreu em 1936, quando WALKER publicou um artigo sobre a capacidade de limpeza promovida pelo hipoclorito de sódio a 5% na desinfecção de canais necrosados.
WALKER61 (1936) propôs o uso de uma solução de hipoclorito de sódio a 5,0 por cento (soda clorada) para a instrumentação dos canais radiculares de dentes despolpados. Em seu trabalho, esclareceu que essa solução fora utilizada após a indicação feita pelo Dr. Blass, da Universidade de New York. Quanto à parte experimental, o autor deu ênfase à complexidade da terapêutica endodôntica ao explicar que esse procedimento é especializado e, assim, exige uma atenção especial para todos os detalhes, como por exemplo a esterilização dos instrumentos, a manipulação dos canais radiculares e a proteção do paciente e do operador, pois o canal radicular infectado aloja microrganismos de ação contaminante.
Com base no trabalho de WALKER61 (1936), GROSSMAN & MEIMAN16 (1941) investigaram a ação de diversas soluções irrigantes sobre a capacidade de dissolução de tecido orgânico, e concluíram que o hipoclorito de sódio a 5% (soda clorada) era o mais efetivo.
GROSSMAN17 (1943), com base nos trabalhos de WALKER61 (1936) e GROSSMAN & MEIMAN16 (1941), preconizou uma técnica de irrigação de canais radiculares que utilizava o uso alternado do hipoclorito de sódio a 5% com o peróxido de hidrogênio a 3%. A reação química entre essas duas soluções dá como resultado final a formação de água, cloreto de sódio e oxigênio nascente. A reação é efervescente e favorece a eliminação dos resíduos do interior do canal radicular.
SENIA et al.49 (1971) observaram que o hipoclorito de sódio a 5% era eficiente na limpeza do canal radicular, exceto nos 3 milímetros apicais. Esses autores citaram três fatores responsáveis pelos seus achados: pouca superfície de contato, pouco volume de solução e pouca circulação do líqüido no local.
TREPAGNIER et al.58 (1977) estudaram, "in vitro", os efeitos das várias concentrações e tempo de reação da solução de hipoclorito de sódio a 5,0% como solvente de tecido, utilizando a mensuração do conteúdo de hidroxiprolina para verificar a eficiência da solução. Concluíram que o hipoclorito de sódio a 5,0% é um potente solvente de tecido, e que a diluição dessa solução com água, em partes iguais, não afeta apreciavelmente sua ação solvente.
HAND et al.20 (1978) verificaram que a diluição de uma solução de hipoclorito de sódio de 5% diminuía sua capacidade de dissolução de tecido necrótico, salientando ainda que quanto maior a área de superfície de contato entre o tecido e a solução de hipoclorito de sódio, melhor é a dissolução.
ROSENFELD et al.45 (1978) dissolveram polpa dental com hipoclorito de sódio a 5 e 2,5% e concluíram que a solução atua muito efetivamente em polpa fora da câmara pulpar e que a solução tinha pouca efetividade para dissolver polpa que estava confinada no canal radicular.
THÉ56 (1979) dissolveu tecido necrosado em hipoclorito de sódio e verificou que o tempo de contato, o volume e a concentração da solução eram parâmetros importantes na dissolução tecidual.
THÉ et al.57 (1980) estudaram as reações do tecido conjuntivo subcutâneo de Guineas pig expostos à solução salina fisiológica estéril, ao hipoclorito de sódio, nas concentrações de 0,9; 2,1; 4,1 e 8,4 por cento, e ao formocresol (fórmula de Buckley), com o objetivo de determinar qual concentração de hipoclorito de sódio deveria ser utilizada em procedimentos clínicos. Os autores concluíram que a determinação da concentração clínica ideal do hipoclorito de sódio não deve ser determinada pelo tipo e intensidade de resposta inflamatória do tecido conjuntivo, mas sim pela ação solvente desses hipocloritos, bem como pelo seu efeito antimicrobiano.
MACHTOU29 (1980) relatou que o sucesso da terapia endodôntica repousa sobre a tríade preparo biomecânico, controle da infecção e obturação dos canais radiculares. Esse autor salientou, de modo enfático, que se deve eliminar todos os resíduos e os microrganismos do interior dos canais radiculares e relatou que a ação da solução irrigante depende de dois fatores: o contato entre a solução e os resíduos e o tempo de ação.
CUNNINGHAN & BALEKJIAN9 (1980) estudaram a dissolução de colágeno pela ação do hipoclorito de sódio e constataram que o hipoclorito de sódio a 2,6% a 37ºC era tão efetivo quanto o hipoclorito de sódio a 5% à temperatura ambiente. A elevação da temperatura potencializava a ação solvente de tecido.
KOSKINEN et al.26, 27 (1980) verificaram que o hipoclorito de sódio dissolvia a pré-dentina das paredes do canal radicular e, estudando a dissolução do tecido pulpar bovino promovida pelo hipoclorito de sódio, observaram a eficácia da concentração a 5 e 2,5% na dissolução. Porém, salientaram que a solução de hipoclorito de sódio a 0,5% não era eficiente. Esses autores observaram que 3 mililitros de hipoclorito de sódio eram uma quantidade excessiva para dissolver 100 miligramas de tecido.
ABOU-RASS & OGLESBY1 (1981) verificaram que o aumento da temperatura da solução de hipoclorito de sódio promove aumento de sua capacidade de dissolução.
GORDON et al.15 (1981) estudaram o efeito solvente de soluções de hipoclorito de sódio nas concentrações de 1,0; 3,0 e 5,0 por cento sobre o tecido pulpar bovino vital e não vital. Os autores observaram que, quanto maior a concentração da solução de hipoclorito de sódio, tanto menor seria o tempo de solvência dos tecidos vivos como, também, necróticos.
MOORER & WESSELINK35 (1982) estudaram o fluxo líqüido, o potencial hidrogeniônico e a área de contato, na capacidade de dissolução da solução de hipoclorito de sódio. Observaram que o princípio ativo do hipoclorito de sódio dependia da quantidade de moléculas de HOCl não dissociados. Esse ácido é responsável pela forte cloraminação e oxidação de matérias orgânicas, tais como tecido e microrganismos. O HOCl (ácido hipocloroso) é consumido na interação com matéria orgânica.
NAKAMURA et al.37 (1985) estudaram a ação solvente do hipoclorito de sódio a 2,0, 5,0 e 10 por cento sobre o colágeno do tendão, a polpa de dentes e a gengiva de bovinos, nas temperaturas de 4, 22 e 37°C. Esses autores concluíram que o hipoclorito de sódio a 10%, à temperatura de 37°C, foi o mais eficiente em dissolver todos os tecidos estudados; os hipocloritos de sódio a 5,0 e a 2,0% mostraram diferenças estatisticamente não significantes a 4°C, 22°C e a 37°C; e que a ação de dissolução do hipoclorito de sódio sobre tendão bovino foi mais forte do que sobre a gengiva bovina.
HASSELGREN et al.22 (1988) avaliaram, "in vitro", os efeitos do hidróxido de cálcio e do hipoclorito de sódio, separadamente ou associados, na dissolução de tecido muscular necrosado. Observaram que o hidróxido de cálcio é capaz de dissolver tecido orgânico e que o efeito de dissolução tecidual do hipoclorito de sódio é grandemente aumentado com o pré-tratamento com hidróxido de cálcio.
MORGAN et al.36 (1991) analisaram o efeito do hidróxido de cálcio, utilizado isolado ou em combinação com o hipoclorito de sódio a 2,6%, sobre a dissolução do tecido pulpar bovino, com período de atuação de 32 minutos. Os autores relataram que não houve diferença significante entre o hidróxido de cálcio utilizado em combinação com o hipoclorito de sódio e o hipoclorito de sódio isolado, e que esses dois grupos foram significantemente mais efetivos em dissolver tecido pulpar bovino do que o hidróxido de cálcio e a solução salina.
MILANO et al.34 (1991) analisaram alguns aspectos do uso do hipoclorito de sódio em Endodontia. Um dos aspectos analisados por eles foi o tempo médio em que uma polpa é dissolvida pela solução de hipoclorito de sódio em diferentes concentrações. Os autores concluíram que as soluções de hipoclorito de sódio apresentam capacidade de dissolução do tecido pulpar na razão direta de suas concentrações.
ANDERSEN et al.3 (1992) estudaram a solubilidade do tecido pulpar humano em hidróxido de cálcio e hipoclorito de sódio, a uma temperatura constante de 37°C, concluindo que o uso combinado do hipoclorito de sódio e de um curativo provisório com hidróxido de cálcio apresentava bom potencial para a remoção do tecido pulpar.
JOHNSON & REMEIKIS24 (1993) relataram que as propriedades solventes e antimicrobianas do hipoclorito de sódio são devidas aos seguintes fatores: a) capacidade do hipoclorito de sódio em oxidar e hidrolisar proteínas celulares; b) liberar gás cloro e c) capacidade osmótica de retirar fluidos celulares.
YANG et al.64 (1995), utilizando fragmentos de polpa bovina, testaram a capacidade de dissolução do hidróxido de cálcio em solução aquosa e hipoclorito de sódio a 2,5% em ambiente anaeróbio e aeróbio. Salientaram que ambas as soluções dissolveram o tecido pulpar em ambiente anaeróbio, e que elas atuaram nos dois ambientes.
SÓ et al.51 (1997) avaliaram a habilidade de dissolução tecidual de soluções de hipoclorito de sódio de diferentes fabricantes, concluindo que a capacidade de dissolução tecidual é diretamente proporcional à concentração da solução de hipoclorito de sódio, e que o hipoclorito de sódio a 0,5% apresenta limitada capacidade de dissolução tecidual.
TÜRKÜN & GENGIZ59 (1997) estudaram os efeitos do hipoclorito de sódio e do hidróxido de cálcio, isolados ou combinados, com e sem a utilização de ultra-som, sobre a dissolução tecidual e sobre a limpeza do canal radicular. Os autores concluíram que o pré-tratamento com hidróxido de cálcio seguido pela utilização do hipoclorito de sódio a 0,5% juntamente com o ultra-som foi tão eficaz quanto o hipoclorito de sódio a 5,0% na dissolução tecidual e limpeza do canal radicular.
GUERISOLI et al.19 (1998) investigaram a ação das soluções de hipoclorito de sódio nas concentrações de 0,5; 1,0; 2,5 e 5,0 por cento sobre a estrutura dentinária mineralizada e desmineralizada, pelo tempo de uma hora. Esses autores constataram que a dentina mineralizada apresenta perda de massa tecidual de modo estatisticamente semelhante para todas as concentrações das soluções estudadas. Porém, a dentina desmineralizada (colágeno) sofria perda de massa de modo diretamente proporcional à concentração da solução, ou seja, quanto maior a concentração da solução de hipoclorito de sódio, tanto maior a perda de massa da dentina desmineralizada.
WADACHI et al.60 (1998) estudaram a dissolução do tecido mole das paredes do canal radicular promovida pelo hidróxido de cálcio, hipoclorito de sódio e pela associação hidróxido de cálcio/hipoclorito de sódio, à luz da microscopia eletrônica de varredura. Concluíram que o hipoclorito de sódio, usado isoladamente, apresentou menos resíduos do que a associação hidróxido de cálcio/hipoclorito de sódio e do hidróxido de cálcio, sozinho.
A retrospectiva da literatura elucida que a ação de dissolução tecidual promovida pela solução de hipoclorito de sódio é devido ao ácido hipocloroso (HOCl) não dissociado e aos ions hipoclorito (OCl-) os quais atuam sobre as proteínas, realizando a hidrólise e a cloraminação (MOORER & WESSELINK35, 1982), e também depende de vários outros fatores, tais como: concentração, temperatura, potencial hidrogeniônico, volume, tempo de contato, superfície de contato e estado da polpa (McCOMB & SMITH33, 1976; HAND et al.20, 1978; TREPAGNIER et al.58, 1977; SVEC & HARRISON54, 1981; CUNNINGHAN & BALEKJIAN9, 1980; ABOU-RASS & OGLESBY1, 1981; GORDON et al.15, 1981 e MOORER & WESSELINK35, 1982).
Assim,
o hipoclorito de sódio vem sendo utilizado na Endodontia há
várias décadas, mas ainda há muito para se estudar
sobre as suas propriedades físico-químicas.
O objetivo do presente trabalho é verificar, "in vitro", a dissolução do tecido pulpar bovino, promovida pela solução de hipoclorito de sódio, com a observância dos seguintes itens:
b. Analisar as variações do potencial hidrogeniônico, da condutividade iônica e da tensão superficial das soluções de hipoclorito de sódio entre o início e o fim dos processos de dissolução pulpar;
c.
Examinar a quantidade de cloro remanescente nas soluções
de hipoclorito de sódio resultantes do processo de dissolução
pulpar.
PREPARO
DAS SOLUÇÕES DE HIPOCLORITO DE SÓDIO
As soluções de hipoclorito de sódio, nas concentrações de 0,5; 1,0; 2,5 e 5,0 por cento, foram aviadas no Laboratório de Pesquisa em Endodontia a partir de uma solução de hipoclorito de sódio concentrada (a 10%).
O teor de cloro de cada solução foi avaliado por meio da titulometria (iodometria).
Após
a titulação, as soluções de hipoclorito de
sódio foram armazenadas em recipientes de vidro âmbar (1 litro),
dotados de tampa e batoque, e conservados em refrigerador (9ºC) até
o dia do experimento. No momento de utilização, as soluções
eram colocadas fora do refrigerador até que atingissem a temperatura
ambiente de 22 ± 2°C.
OBTENÇÃO
DAS POLPAS BOVINAS
Obtiveram-se 20 polpas frescas de incisivos centrais inferiores de bovinos adultos abatidos em frigorífico.
Imediatamente após o abate, a mandíbula bovina era coletada e, no próprio frigorífico foram realizadas as exodontias, após o qual, os dentes eram armazenados em soro fisiológico resfriado e transportados para o Laboratório de Pesquisa em Endodontia.
No Laboratório, prepararam-se canaletas transversais na região cervical dos dentes incisivos centrais inferiores, por meio de uma peça de mão de alta rotação sob refrigeração. A seguir, os dentes eram presos em uma morsa pela sua porção radicular e, por meio de um martelo cirúrgico, aplicava-se uma pancada na porção coronária do dente. As canaletas tinham a função de determinar um ponto de fragilidade no dente de modo que a fratura promovia um corte transversal ao longo eixo do dente na região cervical.
Por tração manual, separava-se a porção coronária da porção radicular do dente, de modo a expor a polpa coronária.
Com um instrumento endodôntico K File da marca Maillefer, de procedência Suíça, número 10, realizava-se o descolamento da polpa dental das paredes dentinárias.
Novamente, por tracionamento manual, retirava-se a polpa do canal radicular.
Procedia-se ao embalamento das polpas bovinas em filme plástico, da marca Magipak, e, a seguir, eram congeladas.
Para
a realização dos testes, as polpas eram removidas de -9°C
para temperatura ambiente, e permaneciam nessa temperatura por 90 minutos,
necessários para o descongelamento.
PREPARO
DAS POLPAS BOVINAS
Da porção central de cada polpa bovina, retirava-se, mediante cortes transversais ao longo eixo e realizados com bisturi, um fragmento com 10 milímetros de comprimento, desprezando-se as extremidades, para padronização da superfície externa de cada fragmento pulpar.
Previamente
à realização do teste de dissolução,
o fragmento a ser utilizado era pesado em balança da marca MLW,
de procedência alemã.
REAÇÃO
DE DISSOLUÇÃO
Para o teste de dissolução da polpa bovina, adaptou-se a extremidade de encaixe da agulha de uma seringa Luer Look a uma mangueira de uretane. A seguir, esta mangueira foi conectada à entrada de uma bomba peristáltica da marca Implant Pulp/Adiel e a saída da bomba foi colocada na outra extremidade da seringa.
Nesse sistema, colocavam-se 15 mililitros da solução a ser testada que, por intermédio da bomba peristáltica, circulava no sistema fechado com um fluxo constante de 64 mililitros por minuto.
No interior da seringa Luer, foi colocada uma rede de nylon para sustentar o fragmento de polpa bovina suspensa na mesma posição, a fim de ter sua superfície totalmente banhada pela solução irrigante.
No momento da imersão do fragmento de polpa na solução a ser testada, disparava-se o cronômetro. O fragmento pulpar era mantido na solução a ser testada sob circulação constante até a sua total dissolução. Finda a dissolução da polpa, o tempo gasto era anotado. Considerava-se como o momento da dissolução total do fragmento aquele em que a polpa não era mais visível com auxílio de uma lupa marca Ramsor, com aumento de dezesseis vezes, de procedência brasileira. A Figura 1 mostra o dispositivo montado para que fosse possível a realização do teste de dissolução.
Figura 1. Dispositivo montado para os testes de dissolução, acoplado à bomba peristáltica.
Testes preliminares realizados com água destilada e deionizada revelaram que essa substância não era capaz de realizar a dissolução do tecido pulpar bovino
AVALIAÇÃO DO POTENCIAL HIDROGENIÔNICO (pH)
Para avaliar o potencial hidrogeniônico das soluções, antes e após o experimento, utilizou-se um pH-meter (Digimed de procedência brasileira).
AVALIAÇÃO DA CONDUTIVIDADE IÔNICA
A condutibilidade iônica das soluções, antes e após o experimento, foi mensurada por meio de um condutivímetro marca Analion modelo C-701 de procedência brasileira.
AVALIAÇÃO DA TENSÃO SUPERFICIAL
A tensão superficial foi mensurada por meio de um tensiômetro marca Fisher Scientific, de procedência norte-americana, antes e depois do teste de dissolução total dos fragmentos de polpa bovina.
AVALIAÇÃO DO CLORO REMANESCENTE
Para avaliar o teor de cloro presente nas soluções após a dissolução do tecido pulpar bovino, realizou-se a titulometria (iodometria). Os dados foram expressos em porcentagem de cloro remanescente nas soluções de hipoclorito de sódio resultantes do processo de dissolução pulpar.
Os testes foram realizados no Laboratório de Pesquisa em Endodontia, em condições ambientais de umidade relativa do ar de 65 ± 5 por cento e temperatura de 22 ± 2°C.
AVALIAÇÃO DA CAPACIDADE DE DISSOLUÇÃO
O modelo matemático do experimento envolvia um único fator de variação, denominado concentração das soluções de hipoclorito de sódio, formado por quatro elementos, a saber: soluções de hipoclorito de sódio nas concentrações 0,5; 1,0; 2,5 e 5,0%.
Realizaram-se 5 repetições para cada teste, o que totalizou uma amostra com 20 dados numéricos de tempo de dissolução total do fragmento de polpa bovina, medidos em segundos, reunidos na Tabela I.
Tabela I. Tempo de dissolução total dos fragmentos de polpa bovina, em segundos.
Pesaram-se os fragmentos de polpa bovina anteriormente aos testes de dissolução total para a obtenção, dessa forma, da massa dos fragmentos para cálculos posteriores. A Tabela II exibe os valores de massa em miligramas (mg).
Tabela II. Massa dos fragmentos de polpa bovina em miligramas.
Por meio da Equação I, vista abaixo, obteve-se a velocidade de dissolução dos fragmentos de polpa bovina, expressa em miligramas por segundo (mg . s-1). Tais valores podem ser vistos na Tabela III.
Equação
I: ![]()
na qual "v" é a velocidade de dissolução, "m" é a massa do fragmento pulpar e "t" é o tempo gasto para a sua total dissolução.
Tabela III. Velocidade da reação de dissolução dos fragmentos de polpa bovina, em miligramas por segundo.
Obtidos os valores de velocidade de dissolução total do fragmento de polpa bovina, iniciaram-se os testes estatísticos por meio do software GMC 7.5 idealizado e elaborado pelo Prof. Dr. Geraldo Maia Campos.
A análise do conjunto de resultados obtidos mediante o teste de normalidade, e o teste de homogeneidade de Cochran para as variâncias envolvidas no experimento levou à conclusão de que a distribuição dos erros amostrais era não-normal, e que as variâncias envolvidas no teste eram heterogêneas, o que contra-indicava a realização de testes estatísticos paramétricos.
Optou-se, então, pela utilização do teste de Kruskal-Wallis o qual apresentou valor H de 17,8706, valor do Qui quadrado para 3 graus de liberdade igual a 17,87 e probabilidade de igualdade para esse valor de 0,05%, indicando significância ao nível de 1%.
As comparações entre as médias dos postos das amostras de soluções de hipoclorito de sódio indicaram diferenças estatisticamente significantes entre todas as soluções ao nível de 1 por cento, a quais podem ser observadas na Tabela IV.
Tabela IV. Comparações entre as médias dos postos das amostras das soluções de hipoclorito de sódio.
Para
verificar se a velocidade de dissolução pulpar variava proporcionalmente
as concentrações de hiploclorito de sódio, realizou-se
o teste de regressão e correlação entre os valores
referentes dessas duas variáveis que indicou relação
diretamente proporcional, ou seja, quanto maior a concentração
da solução de hipoclorito de sódio, maior a velocidade
de dissolução. Observa-se na Figura 2 a expressão
gráfica da linha de regressão da abscissa na ordenada.
Figura
2. Gráfico da correlação entre as concentrações
das soluções de hipoclorito de sódio e a velocidade
de dissolução.
AVALIAÇÃO DO POTENCIAL HIDROGENIÔNICO (pH)
Cada solução de hipoclorito de sódio teve seu potencial hidrogeniônico previamente quantificado, e os valores podem ser vistos na Tabela V.
Tabela V. Potenciais hidrogeniônicos quantificados anteriormente aos testes de dissolução.
A Tabela VI mostra os potenciais hidrogeniônicos das soluções de hipoclorito de sódio mensurados após o teste de dissolução total dos fragmentos de polpa.
Tabela VI. Potenciais hidrogeniônicos das soluções de hipoclorito de sódio após os testes de dissolução total do tecido pulpar bovino.
Com os valores originais da Tabela V e as médias dos valores da Tabela VI, traçou-se o gráfico da Figura 3, que representa o potencial hidrogeniônico antes e depois do teste de dissolução total da polpa bovina.
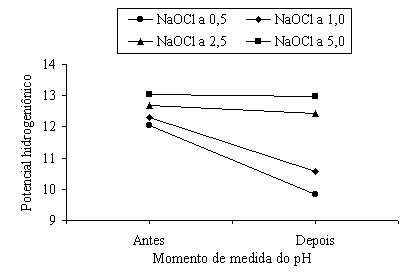
Figura 3. Gráfico representativo do potencial hidrogeniônico antes e depois do teste de dissolução do fragmento de polpa bovina.
O gráfico da Figura 3 mostra que houve um decréscimo nos potenciais hidrogeniônicos das soluções de hipoclorito de sódio após o teste de dissolução.
Para que fosse possível comparar os potenciais hidrogeniônicos das soluções de hipoclorito de sódio antes e depois dos testes de dissolução dos fragmentos de polpa bovina, optou-se pela variável denominada variação porcentual do potencial hidrogeniônico (Anexo D).
A Tabela VII mostra os valores da variação porcentual do potencial hidrogeniônico (que no caso poderia ser denominada de porcentual de perda do potencial hidrogeniônico) das soluções de hipoclorito de sódio testadas.
Tabela VII. Variação porcentual (porcentual de perda) do potencial hidrogeniônico das soluções de hipoclorito de sódio.
De posse dos valores de variação porcentual (porcentual de perda) do potencial hidrogeniônico, iniciaram-se os testes estatísticos.
Pela análise do conjunto de resultados obtidos mediante o teste de normalidade e o teste de homogeneidade das variâncias (Cochran) observou-se que a distribuição dos erros amostrais era não-normal, apesar de a distribuição das variâncias ser homogênea, o que contra-indica a realização de testes estatísticos paramétricos.
Realizou-se, então, o teste de Kruskal-Wallis, que indicou valor H de 17,8571, valor de Qui quadrado para 3 graus de liberdade igual a 17,86 e probabilidade de igualdade (H0) para esse valor de 0,05%.
A Tabela VIII mostra as comparações entre as médias dos postos das amostras da variação porcentual do potencial hidrogeniônico das soluções de hipoclorito de sódio. Indicou diferença estatisticamente significante ao nível de 1% entre todas as soluções testadas.
Tabela VIII. Comparações entre as médias dos postos das amostras das soluções de hipoclorito de sódio.
Realizou-se o teste de regressão e correlação entre a concentração das soluções de hipoclorito de sódio e variação porcentual do potencial hidrogeniônico das soluções de hipoclorito de sódio após a dissolução total do fragmento de polpa bovina, que indicou relação inversamente proporcional, ou seja, quanto maior a concentração da solução de hipoclorito de sódio, menor a variação porcentual do potencial hidrogeniônico (Anexo G). A Figura 4 mostra a linha de regressão entre a variação porcentual do potencial hidrogeniônico (ordenada) e a concentração das soluções de hipoclorito de sódio (abscissa).
Figura 4. Linha de regressão entre a concentração das soluções de hipoclorito de sódio (abscissa) e a variação porcentual do potencial hidrogeniônico (ordenada).
AVALIAÇÃO DA CONDUTIVIDADE IÔNICA
A Tabela IX mostra os valores de condutividade iônica das soluções de hipoclorito de sódio, mensurados anteriormente aos testes de dissolução pulpar, na unidade miliSiemens.
Tabela IX. Condutividade iônica quantificada anteriormente aos testes de dissolução (mS).
A Tabela X mostra os valores de condutividade iônica das soluções de hipoclorito de sódio mensurados após o teste de dissolução total dos fragmentos de polpa bovina.
Tabela X. Valores de condutividade iônica das soluções de hipoclorito de sódio após os testes de dissolução total do tecido pulpar bovino (mS).
Pela observação das Tabelas IX e X, percebe-se que houve um pequeno decréscimo na condutividade iônica das soluções de hipoclorito de sódio após o teste de dissolução.
Da mesma forma que para o teste de potencial hidrogeniônico, realizou-se uma mudança de variável. A variável escolhida foi a variação porcentual da condutividade iônica (queda da condutividade iônica, expressa em porcentagem de queda em relação aos respectivos valores iniciais), vista na Tabela XI.
Tabela XI. Valores da variação porcentual da condutividade iônica das soluções de hipoclorito de sódio.
De posse dos valores de variação porcentual da condutividade iônica, realizaram-se os testes estatísticos.
A análise do conjunto de resultados obtidos mediante o teste de normalidade e o teste da homogeneidade das variâncias envolvidas no experimento (Cochran) levou à conclusão de que a distribuição dos erros amostrais era normal e a distribuição das variâncias, homogênea. Tal situação facultava a realização de testes estatísticos paramétricos.
Dando prosseguimento à análise estatística, o modelo matemático experimental apresentava-se compatível com a análise de variância para fatores independentes com fator de variação único, a qual mostrou uma probabilidade de igualdade (H0) alta (9,508%), o que indicou que não houve diferença estatisticamente significante entre as variações porcentuais da condutividade iônica das soluções de hipoclorito de sódio, ou seja, todas as soluções tiveram suas condutividades iônicas reduzidas de forma semelhante.
Procedeu-se,
também, ao teste de regressão e correlação
entre a concentração das soluções de hipoclorito
de sódio e a variação porcentual da condutividade
iônica, o qual mostrou que não há correlação
entre os fatores testados.
AVALIAÇÃO
DA TENSÃO SUPERFICIAL
A
Tabela XII mostra a tensão superficial das soluções
de hipoclorito de sódio mensurados anteriormente aos testes de dissolução.
Tabela XII. Tensão superficial das soluções de hipoclorito de sódio quantificada anteriormente aos testes de dissolução, expressa em dinas por centímetro.
A Tabela XIII mostra os valores de tensão superficial das soluções de hipoclorito de sódio, obtidos após o teste de dissolução total dos fragmentos de polpa.
Tabela XIII. Tensão superficial, em dinas por centímetro, das soluções de hipoclorito de sódio após os testes de dissolução total do fragmento de polpa bovina.
Com os valores originais da Tabela XII e as médias dos valores da Tabela XIII, traçou-se a Figura 5, que representa a tensão superficial antes e depois do teste de dissolução total da polpa bovina.
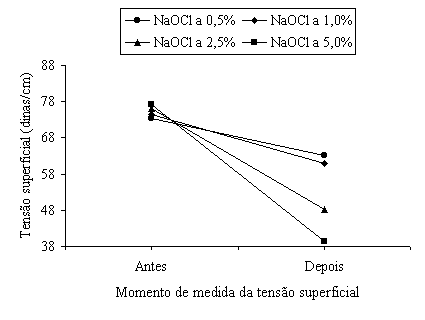
O gráfico da Figura 5 mostra que houve um decréscimo nas tensões superficiais das soluções de hipoclorito de sódio após o teste de dissolução.
A comparação entre os valores de tensão superficial medidos antes e depois dos testes de dissolução total da polpa só foi possível por meio de uma mudança de variável. A variável escolhida foi a variação porcentual da tensão superficial das soluções de hipoclorito de sódio. Tais valores podem ser vistos na Tabela XIV.
Tabela XIV. Valores da variação porcentual da tensão superficial das soluções de hipoclorito de sódio.
De posse dos valores de variação porcentual da tensão superficial, iniciaram-se os testes estatísticos.
A análise do conjunto de resultados obtidos mediante o teste de normalidade e o teste da homogeneidade das variâncias envolvidas no experimento (Cochran) levou à conclusão de que a distribuição dos erros amostrais era não-normal e a distribuição das variâncias, homogênea. Este fato impedia a realização de testes estatísticos paramétricos.
Realizou-se, então, o teste de Kruskal-Wallis, que indicou valor H de Kruskal-Wallis de 17,8571, valor de Qui quadrado para 3 graus de liberdade igual a 17,86 e probabilidade de igualdade (H0) para esse valor de 0,05 por cento, sendo significante ao nível de 1 por cento.
A Tabela XV exibe as comparações entre as médias dos postos das amostras da variação porcentual da tensão superficial das soluções de hipoclorito de sódio.
Tabela XV. Comparações entre as médias dos postos das amostras das soluções de hipoclorito de sódio.
A comparação entre as médias dos postos das amostras das soluções de hipoclorito de sódio evidenciou que houve diferença estatisticamente significante ao nível de 1 por cento entre todas as soluções de hipoclorito de sódio utilizadas no experimento.
Realizou-se o teste de regressão e correlação entre a concentração das soluções de hipoclorito de sódio e a variação porcentual da tensão superficial após a dissolução total do fragmento de polpa bovina, que indicou uma relação diretamente proporcional, ou seja, quanto maior a concentração da solução de hipoclorito de sódio, maior a variação porcentual da tensão superficial. A Figura 6 exibe o gráfico resultante do teste de regressão e correlação.
Figura
6. Gráfico da correlação entre a concentração
das soluções de hipoclorito de sódio e a variação
porcentual da tensão superficial.
AVALIAÇÃO DE CLORO REMANESCENTE
A Tabela XVI mostra o teor de cloro das soluções de hipoclorito de sódio mensurado anteriormente aos testes de dissolução.
Tabela XVI. Concentrações de cloro das soluções de hipoclorito de sódio quantificadas anteriormente aos testes de dissolução (valores em %).
A Tabela XVII mostra os valores de teor de cloro das soluções de hipoclorito de sódio obtidos após o teste de dissolução total dos fragmentos de polpa.
Tabela XVII. Concentrações de cloro das soluções de hipoclorito de sódio mensuradas após os testes de dissolução total (valores em %).
Pela simples observação das Tabelas XVI e XVII, percebe-se que todas as soluções de hipoclorito apresentaram redução de cloro após o teste de dissolução do fragmento de polpa bovina.
Para que fosse possível comparar a variação da concentração de cloro antes e depois da utilização da solução no teste de dissolução, fez-se a mudança da variável. Esta mudança de variável partiu do princípio de que a concentração inicial das soluções utilizadas era a porcentagem máxima (100%) de cloro presente na solução e que o teor de cloro remanescente era uma fração desta porcentagem. Assim sendo, passou-se a utilizar o porcentual de cloro remanescente como variável, valores que podem ser vistos na Tabela XVIII.
Tabela XVIII. Porcentual de cloro remanescente das soluções de hipoclorito de sódio.
De posse dos valores porcentuais de cloro remanescente, iniciaram-se os testes estatísticos.
A análise do conjunto de resultados obtidos mediante o teste de normalidade e o teste da homogeneidade das variâncias envolvidas no experimento (Cochran) levou à conclusão de que a distribuição dos erros amostrais era não-normal e a distribuição das variâncias, homogênea. Tal situação impedia a realização de testes estatísticos paramétricos.
Realizou-se, então, o teste de Kruskal-Wallis, que indicou valor H de Kruskal-Wallis de 15,6950, valor de Qui quadrado para 3 graus de liberdade igual a 15,70 e probabilidade de igualdade (H0) para esse valor de 0,13%.
A Tabela XIX mostra as comparações entre as médias dos postos das amostras do porcentual de cloro remanescente das soluções de hipoclorito de sódio.
Tabela XIX. Comparações entre as médias dos postos das amostras das soluções de hipoclorito de sódio.
Pela análise da Tabela XIX, percebe-se que as soluções de hipoclorito de sódio a 0,5 e 1,0 por cento não apresentaram diferença estatisticamente significante entre si. As soluções a 2,5 e 5,0 por cento não apresentaram diferença estatisticamente significante e que as demais comparações apresentaram diferença estatisticamente significante ao nível de 1%, ou seja, as soluções de hipoclorito de sódio a 0,5 e 1,0 por cento apresentaram variação da porcentagem de cloro remanescente de forma semelhante, o mesmo ocorrendo com as soluções de concentração 2,5 e 5,0%.
Realizou-se o teste de regressão e correlação entre a concentração das soluções de hipoclorito de sódio e o porcentual de cloro remanescente, que indicou uma relação diretamente proporcional, ou seja, quanto maior a concentração da solução de hipoclorito de sódio, maior porcentagem de cloro remanescente. A Figura 7 mostra o gráfico de correlação entre a porcentagem de cloro remanescente e a concentração da solução de hipoclorito de sódio.
Figura
7. Gráfico da correlação entre a concentração
das soluções de hipoclorito de sódio e o porcentual
de cloro remanescente.
A solução de hipoclorito de sódio, em diferentes concentrações, é sem dúvida a mais utilizada das soluções auxiliares da biomecânica, em todo o mundo.
Entre as propriedades que a solução de hipoclorito possui, a capacidade de dissolver tecido orgânico, quer necrótico ou não, é uma das mais importantes.
Essa ação de dissolução tecidual tem sido estudada e HAND et al.20 (1978), THÉ56 (1979), CUNNINGHAN & BALEKJIAN9 (1980), GORDON et al.15 (1981) e MOORER & WESSELINK35 (1982) estabeleceram vários fatores importantes, que estão aqui agrupados e são os seguintes: a) relação entre a quantidade de solução e massa de tecido orgânico; b) superfície de contato; c) tempo de ação; d) volume da solução; e) temperatura da solução; f) agitação mecânica e g) concentração da solução.
Assim, quanto maiores forem os valores desses fatores, maior será a capacidade de dissolução do hipoclorito de sódio sobre os tecidos orgânicos, necróticos ou não.
A capacidade de dissolução tecidual promovida pelo hipoclorito de sódio faz com que pedaços sólidos da polpa sejam liqüefeitos e, assim, facilita sua remoção do interior do sistema de canais radiculares.
Nenhum autor investigou as propriedades físico-químicas da solução de hipoclorito de sódio após ter promovido a dissolução de tecido orgânico.
O hipoclorito de sódio não existe no estado de pó, só existindo em solução aquosa. Neste estado, encontra-se dissociado em hidróxido de sódio e ácido hipocloroso (uma base forte e um ácido fraco). Então, o hipoclorito de sódio pode ser representado pela seguinte equação:
NaOCl + H2O Û NaOH + HOCl (Reação I)
Estas reações químicas entre hipoclorito de sódio e os tecidos orgânicos, necróticos ou não, promovem a dissolução desses tecidos.
Os testes de dissolução do tecido pulpar bovino, realizados neste trabalho, evidenciaram uma relação diretamente proporcional entre a concentração da solução de hipoclorito de sódio e a velocidade de dissolução, isto é, quanto maior a concentração da solução de hipoclorito de sódio, tanto mais rapidamente o tecido orgânico é dissolvido. Tais achados estão em conformidade com os de GROSSMAN & MEIMAN16 (1941), HAND et al.20 (1978), KOSKINEN et al.27 (1980), GORDON et al.15 (1981), MOORER & WESSELINK35 (1982) e NAKAMURA et al.37 (1985).
Quando se fala em dissolução de tecido orgânico promovida pelo hipoclorito de sódio, deve-se pensar que as reações II, III e IV ocorrem simultaneamente, todas elas confluindo para a liqüefação do referido tecido, facilitando sua remoção do interior do canal radicular.
Quando uma reação química ocorre, ligações dos reagentes são rompidas e novas reações se desencadeiam no meio e a velocidade das reações, portanto, depende da natureza e da quantidade de ligações envolvidas. As reações químicas ocorrem pela colisão entre partículas (átomos, ions e moléculas).
O potencial hidrogeniônico das soluções de hipoclorito de sódio, antes dos testes de dissolução do fragmento pulpar apresentava-se acima de 12 para todas as soluções. Tais achados estão de acordo com os dados dos trabalhos de MARCHESAN et al.30 (1998) e GAMBARINI et al.14 (1998).
Esses elevados potenciais hidrogeniônicos devem-se à forte alcalinidade do hidróxido de sódio, que é uma base forte, tornando o meio repleto de hidroxilas.
O estudo do líqüido resultante após ter ocorrido a dissolução tecidual (polpa bovina) indicou um decréscimo dos valores de potencial hidrogeniônico. Esse fato deve-se à interação do hidróxido de sódio (NaOH) com a matéria orgânica, segundo as reações II e III, vistas anteriormente.
A reação II ilustra os ácidos graxos (óleos e gorduras) presentes na matéria orgânica, suas reações com o hidróxido de sódio, de modo a formar sais de ácidos graxos (sabão) e glicerol.
Os ions OH- (hidroxilas), presentes no meio e responsáveis pelo elevado potencial hidrogeniônico, reagiram na formação de glicerol (álcool).
O glicerol e os sais de ácidos graxos, por serem compostos moleculares, proporcionaram a diminuição da concentração de hidroxilas e promoveram redução do potencial hidrogeniônico. Desse modo, a solução resultante tornou-se menos alcalina.
A reação III também é responsável pela redução do potencial hidrogeniônico da solução resultante, pois é uma reação de neutralização, na qual um ácido (aminoácidos das proteínas) reage com uma base forte (NaOH) e forma sal e água.
Assim, as reações II e III são responsáveis pela retirada de hidroxilas do meio, o que promove a redução do potencial hidrogeniônico do líqüido residual.
Os achados desse trabalho evidenciaram uma relação inversamente proporcional entre a concentração da solução de hipoclorito de sódio e a variação porcentual do potencial hidrogeniônico após a dissolução tecidual. Isto pode ser expresso de outra maneira, ou seja, quanto maior for a concentração inicial de uma solução de hipoclorito de sódio, tanto menor será a alteração do potencial hidrogeniônico da solução resultante após a dissolução tecidual. É claro que uma solução mais concentrada de hipoclorito de sódio apresenta maior disponibilidade de hidroxilas no meio e, assim, mantém o potencial hidrogeniônico elevado.
A condutividade iônica expressa o número de ions presentes em uma solução, pois os ions são capazes de conduzir eletricidade. As medidas de condutividade iônica, anteriores aos testes de dissolução do tecido pulpar, mostraram que, quanto maior a concentração da solução de hipoclorito de sódio, tanto maior era a condutividade iônica. Isso parece lógico porque, quanto maior a concentração de uma solução, tanto maior é a oferta de ions.
Após a utilização da solução de hipoclorito de sódio nos testes de dissolução do tecido pulpar, todas as soluções apresentaram variação porcentual da condutividade iônica estatisticamente semelhantes, ou seja, a condutividade iônica se reduziu de forma semelhante em todas as soluções de hipoclorito de sódio. Essa redução da condutividade iônica pode ser explicada em virtude de dois fatores: a) quando o hipoclorito de sódio reage com o material orgânico (reações II, III e IV), produzem-se compostos moleculares e, assim, os ions são retirados do meio e b) quantidades padronizadas de tecido pulpar bovino foram colocadas em solução para o processo de dissolução.
Os estudos preliminares evidenciaram que todas as soluções de hipoclorito de sódio recém preparadas apresentavam tensões superficiais que variavam de 73 a 78 dinas/cm (Tabela XII). Observa-se que, quanto maior a concentração dessas soluções, tanto mais elevada é sua tensão superficial.
Após os experimentos de dissolução do tecido pulpar bovino, constatou-se decréscimo da tensão superficial em todas as soluções resultantes (Tabela XIII). Observou-se que, quanto maior era a concentração inicial da solução de hipoclorito de sódio, tanto maior foi a redução da tensão superficial da solução final.
Este achado pode ser explicado pelo fato de que a solução de maior concentração de cloro ativo, e portanto de maior concentração de hidróxido de sódio, deve propiciar maior formação de sais de ácidos graxos (sabões), como pode ser visto na reação II. Os sabões formados reduziram a tensão superficial da solução resultante.
Analisando-se a porcentagem de cloro remanescente das soluções de hipoclorito de sódio após os testes de dissolução do tecido pulpar, observou-se que, quanto maior a concentração de cloro inicial das soluções, tanto maior foi a quantidade de cloro remanescente.
Quando se utilizava uma solução de hipoclorito de sódio com concentração inicial de cloro de 0,5%, restava, após o teste de dissolução tecidual, uma concentração de cloro remanescente de aproximadamente 0,3%; ocorria, portanto, um consumo de 0,2% em média. A solução de hipoclorito de sódio com concentração inicial de cloro de 5,0% após o teste de dissolução tecidual apresentou pequena perda de cloro e ficou, em média, com concentração aproximada de 4,3%. Considerando os valores em termos de porcentagem, pode-se dizer que a solução de hipoclorito de sódio a 0,5% apresentou, após o teste de dissolução, quantidade de cloro em torno de 65% da quantidade inicial e a solução de hipoclorito de sódio a 5,0% apresentou, em média, 86,4% da quantidade de cloro inicial.
Tal fato sugere que, nas soluções de hipoclorito de sódio menos concentradas, houve maior interação do ácido hipocloroso (HOCl) com a matéria orgânica (reação IV) e que, nas soluções mais concentradas, houve maior interação do hidróxido de sódio com a matéria orgânica (reação II), fato esse que é corroborado pela maior redução da tensão superficial das soluções de hipoclorito de sódio de maior concentração.
No intuito de elucidar a ação do hidróxido de sódio (NaOH) no mecanismo de dissolução do tecido orgânico, realizou-se um experimento, utilizando-se a mesma metodologia empregada neste trabalho. Assim, determinou-se a velocidade de dissolução tecidual de quatro soluções de hipoclorito de sódio, a saber: solução de hipoclorito de sódio a 0,5% com pH 11,6 e com pH 9 e solução de hipoclorito de sódio a 0,36% com pH 11,6 e com pH 7,0. Tal redução do potencial hidrogeniônico foi conseguida pela adição de ácido bórico, segundo a proposta de DAKIN11 (1915). Os resultados desses experimentos estão expressos nos gráficos das Figuras 8 e 9.
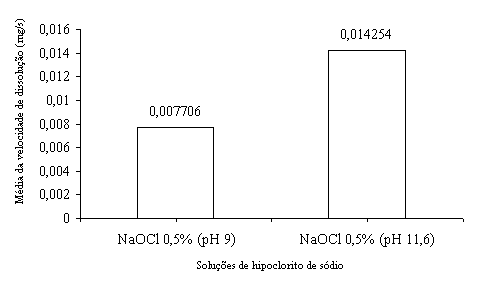
Figura
8. Gráfico ilustrativo das médias das velocidades de dissolução
do tecido pulpar bovino das soluções de hipoclorito de sódio
a 0,5% com pH 9 e com pH 11,6.
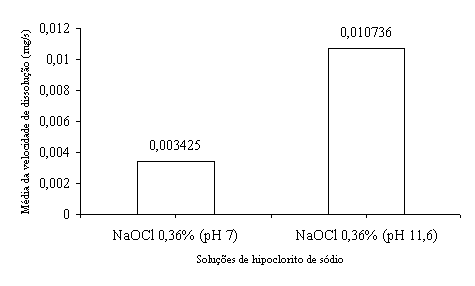
Pela análise dos gráficos das Figuras 8 e 9, observa-se que o hipoclorito de sódio com potencial hidrogeniônico reduzido gastou muito mais tempo para realizar a dissolução da polpa bovina. Tal fato confirma que a redução do potencial hidrogeniônico das soluções de hipoclorito de sódio reduz a velocidade de dissolução do tecido pulpar.
A redução da velocidade de dissolução tecidual observada, em ambos os casos, pode ser explicada pela adição de ácido bórico (H3BO3) ao hipoclorito de sódio, com objetivo de reduzir o potencial hidrogeniônico.
A adição de ácido bórico promove reação de neutralização com o hidróxido de sódio (NaOH), e forma sal, borato de sódio (Na3BO3) e água, segundo a reação:
3NaOH + H3BO3 ÛNa3BO3 + 3H2O
Assim, essa reação de neutralização deixa a solução de hipoclorito de sódio pouco alcalina, no caso da solução com pH 9, ou neutra, no caso da solução com pH 7, sendo que nesta as concentrações de hidroxilas (OH-) e de hidroxônio (H+) estão numericamente iguais. A redução da concentração de hidroxilas (OH-) e do ion sódio (Na+) promove diminuição da reação de saponificação (reação II) e da reação de neutralização dos aminoácidos (reação III).
Como as reações II e III ficam reduzidas, a dissolução tecidual fica em função da ação do ácido hipocloroso sobre as proteínas.
Cumpre salientar que, apesar de ter ocorrido a reação de neutralização entre o hidróxido de sódio e o ácido bórico, estas substâncias ainda ficam em solução e atuam interferindo no processo de dissolução tecidual.
Realizou-se, ainda, um outro experimento com a mesma metodologia do teste de dissolução do tecido pulpar, a fim de estudar a ação do hidróxido de sódio no processo de dissolução tecidual. Dessa vez, testou-se a capacidade de dissolução do hidróxido de sódio (NaOH) a 15%. Após seis horas do início de tal experimento, o hidróxido de sódio não foi capaz de dissolver o tecido pulpar, o qual apresentou alterações cromáticas (do vermelho para o amarelo palha) e de sua consistência, a qual passou de uma consistência tecidual firme, antes do experimento, para uma consistência gelatinosa. Assim, pode-se concluir que o hidróxido de sódio, sozinho, não realiza a dissolução total da polpa bovina.
Desta forma, a dissolução do tecido pulpar se dá pelo efeito combinado entre o hidróxido de sódio e o ácido hipocloroso, cada um reagindo com determinados componentes da polpa dental.
Tais eventos, relacionados com a cinética química da reação entre o hipoclorito de sódio e o material orgânico, merecem estudos mais aprofundados.
Optou-se pela utilização do tecido pulpar bovino por este apresentar maior semelhança com o tecido pulpar humano (KOSKINEN et al.26, 27, 1980).
Não se utilizaram polpas de dentes humanos pela dificuldade de obtenção e pelo reduzido tamanho.
A realização deste trabalho abre perspectivas para novos estudos para sanar algumas dúvidas surgidas, como por exemplo: a) a influência da adição de tensoativos à solução de hipoclorito de sódio sobre a capacidade de dissolução do tecido pulpar, b) o efeito do aumento da temperatura de utilização da solução de hipoclorito de sódio sobre a dissolução do tecido pulpar e c) como seria a variação das propriedades físico-químicas dos líqüidos remanescentes.
Com
base na metodologia empregada e nos resultados obtidos, pode-se concluir
que:
1.
A velocidade de dissolução dos fragmentos do tecido pulpar
bovino é diretamente proporcional à concentração
das soluções de hipoclorito de sódio, ou seja, quanto
maior a concentração das soluções de hipoclorito
de sódio, tanto mais rápido se processa a dissolução
do tecido pulpar;
2.
Após a dissolução do tecido pulpar, o tamanho da variação
porcentual do potencial hidrogeniônico das soluções
de hipoclorito de sódio é inversamente proporcional à
concentração inicial dessas soluções, ou seja,
quanto maior a concentração inicial das soluções
de hipoclorito de sódio, tanto menor será a redução
de seu potencial hidrogeniônico;
3.
Em todas as concentrações testadas, as soluções
de hipoclorito de sódio apresentam redução dos valores
da condutividade iônica após o processo de dissolução
do tecido pulpar bovino;
4.
Após a dissolução do tecido pulpar bovino, a magnitude
da variação porcentual da tensão superficial das soluções
de hipoclorito de sódio é diretamente proporcional à
concentração, ou seja, quanto maior for a concentração
do hipoclorito de sódio, maior será a redução
da tensão superficial;
5. Após o processo de dissolução da polpa bovina, o porcentual de cloro remanescente das soluções de hipoclorito de sódio apresenta relação diretamente proporcional com a sua concentração inicial da solução, ou seja, quanto maior a concentração de cloro inicial de uma solução de hipoclorito de sódio, tanto maior a porcentagem de cloro remanescente;
5.1. As soluções de hipoclorito de sódio nas concentrações de 0,5 e 1,0 por cento apresentam variações porcentuais de cloro remanescente de modo estatisticamente semelhante entre si, o mesmo ocorrendo com as soluções de hipoclorito de sódio a 2,5 e 5,0 por cento, formando, assim, as duas primeiras e estas duas últimas, dois grupos distintos.
The dissolution of bovine pulp tissue by sodium hypochlorite (0.5, 1.0, 2.5, 5.0%) was studied in vitro and the pH, surface tension, ionic conductivity and chlorine level were analyzed before and after the use of sodium hypochlorite in the process of dissolution.
Fragments of fresh pulp of bovine mandibular central incisors were obtained and weighed.
An apparatus was made connected to a peristaltic pump which agitated the solution to evaluate dissolution. The peristaltic pump was turned on and a chronometer was activated when the pulp fragment was placed in this apparatus.
Time of dissolution was recorded as the time from the placement of the pulp fragment in the solution until its total disappearance. Based on the time of pulp dissolution and its respective mass, the speed of dissolution was calculated. After dissolution, the remaining liquid was analyzed for pH, surface tension, ionic conductivity and remanenscent chlorine.
The
data were submitted to statistical analysis and in accordance with the
methodology and the results, it is concluded that: a) the speed of dissolution
of bovine pulp fragments was directly proportional to the concentration
of sodium hypochlorite, or in other words, the greater the concentration,
more rapid is the dissolution; b) the percent variation of pH of the sodium
hypochlorite solutions, after dissolution, was inversely proportional to
the initial concentration of the solution, or in other words, the greater
the initial concentration of the sodium hypochlorite solutions, the smaller
was the reduction of its pH; c) at the concentrations studied, the solutions
of sodium hypochlorite reduced the values of ionic conductivity after the
process of dissolution of bovine pulp tissue in a statistically similar
manner; d) evaluation of the surface tension of these solutions, before
and after tissue dissolution, showed that this property varied in a directly
proportional manner to concentration, or in other words, the greater the
initial concentration of the solution of sodium hypochlorite, the greater
was the reduction of surface tension; e) the level of remanescent chlorine
in the solutions of sodium hypochlorite, after the process of pulp dissolution,
was directly proportional to concentration, or in other words, the greater
the initial concentration of chlorine, the greater was the concentration
of remanescent chlorine.
Esta página foi elaborada com apoio do Programa Incentivo à Produção de Material Didático do SIAE - Pró - Reitorias de Graduação e Pós-Graduação da Universidade de São Paulo