|
Faculdade de Odontologia de Ribeirão Preto
Ribeirão Preto 2008 |
|
Versão
(PDF) para impressão ou leitura "off line" Melhor visualizado no Adobe Reader configurado como segue: Menu Principal - Visualizar
- Exibição da página - Duas ou mais Formatado para impressão frente e
verso |
|
Eduardo Luiz Barbin ANÁLISE QUÍMICA DA CLOREXIDINA MISTURADA OU NÃO AO
HIDRÓXIDO DE CÁLCIO Tese de Doutorado apresentada à Faculdade de Odontologia de Ribeirão Preto
da Universidade de São Paulo para a obtenção do grau de Doutor em Odontologia
na Área de Odontologia Restauradora, subárea de Endodontia. Orientador: Prof. Dr. Paulo César Saquy Ribeirão Preto 2008 |
|
Autorizo a reprodução e divulgação total ou parcial deste trabalho, por qualquer meio convencional ou eletrônico, para fins de estudo e pesquisa, desde que citada a fonte. |
|
Defesa Pública da Tese de Doutorado Data e horário da defesa: sexta-feira, dia 15 de
fevereiro de 2008, com início as 09:00 horas. Banca Examinadora Prof.
Dr. Carlos Estrela Professor Titular do Departamento de Ciências
Estomatológicas da Universidade Federal de Goiás. Prof.
Dr. Luiz Fernando Lopes Guimarães Professor Doutor do Departamento de Física e Química da Faculdade de Ciências Farmacêuticas de Ribeirão Preto da Universidade de São Paulo. Prof. Dr. Paulo
César Saquy Professor Associado do Departamento de Odontologia Restauradora da Faculdade de Odontologia de Ribeirão Preto da Universidade de São Paulo. Prof. Dr. Jesus
Djalma Pécora Professor Titular do Departamento de Odontologia Restauradora da Faculdade de Odontologia de Ribeirão Preto da Universidade de São Paulo. Prof. Dr. Manoel
Damião de Sousa Neto Professor Associado do Departamento de Odontologia Restauradora da Faculdade de Odontologia de Ribeirão Preto da Universidade de São Paulo. Avaliação Aprovado. |
|
Barbin, Eduardo Luiz Análise química da clorexidina misturada ou não ao hidróxido de cálcio. Ribeirão Preto, 2008. 116 p.: il.; 28 cm Tese de Doutorado, apresentada à Faculdade de Odontologia de Ribeirão Preto da Universidade de São Paulo (FORP-USP). Área de concentração: Odontologia Restauradora, subárea Endodontia. Orientador Saquy, Paulo César. 1. Hidróxido de cálcio. 2. Clorexidina. 3. Medicação intracanal. 4. Espectrometria de massas. 5. Cromatografia líquida. |
|
|
|
|
Este trabalho de pesquisa foi realizado no Laboratório de Pesquisa em Endodontia do Departamento de Odontologia Restauradora da Faculdade de Odontologia de Ribeirão Preto da Universidade de São Paulo. |
|
|
Dedicatória À Stella Alves da Silva Barbin, por ter encaminhado seus filhos apesar de tantas adversidades. Ao Alcyr Barbin, in memoriam, por ter tido um caráter que, de tão forte e positivo, ainda se mantém como um exemplo para seus filhos. Ao professor Paulo César Saquy, por ter me acolhido como seu orientado. Ao professor Jesus Djalma Pécora, por ter sido fundamental para a minha capacitação profissional. Ao professor Geraldo Maia Campos, in memoriam, pela influência positiva que exerceu na minha formação acadêmica. À Cláudia Regina Alves Bueno e à nossa filha Lauren Bueno Barbin, como um tributo aos períodos que estive ausente. Ao Alcyr, à sua esposa Sílvia Renata, ao filho Alcyr Neto e às filhas Marcela e Marina, por manterem o vínculo fraterno. Ao Antônio, à sua esposa Vitória e ao filho Pedro, pelos momentos nos quais fizeram a diferença. À Maria Amélia, ao seu marido Carlos Henrique e aos filhos Tiago e Artur, por terem estado presentes em momentos decisivos. Ao João, à sua esposa Adriana e ao filho Gabriel, pelo bem querer. Ao Fausto e à sua esposa Lourdes, pelo respeito e carinho a mim dedicados. Ao Júlio, à sua esposa Helena e aos filhos Cáio, Maria Fernanda e Enzo, por terem me acolhido em sua família. |
|
Agradecimentos A Deus, que ao dispor os desafios da vida, permite que nos reinventemos na busca de superá-los.Ao meu orientador, Prof. Dr. Paulo César Saquy, pelas oportunidades oferecidas
a mim que contribuíram para a minha formação profissional.
Ao Prof.
Dr. Jesus Djalma Pécora, pelo
entusiasmo para com este projeto.
Ao
Prof.Dr. Manoel Damião de Sousa Neto, pelo incentivo no desenvolvimento deste projeto.
Aos Prof. Dr. Luis Pascoal Vansan, pelo apreço que demonstra ter por mim e pelas tardes e noites de debates e discussões sobre Endodontia, Pedagogia, ensino em Odontologia e aspectos da vida que contribuíram para a minha formação como Professor de Endodontia. Ao Prof. Dr. Fernando Mandarino, pela confiança depositada em meu trabalho como docente do Curso de Especialização em Dentística da FORP-USP. À Profa. Dra. Débora Fernandes Costa Guedes, pelos seus esforços, trabalho e reflexões os quais foram fundamentais para a realização e finalização desta pesquisa científica. Aos Profs(as). Drs(as). Wanderley Ferreira da Costa, Ricardo Gariba Silva, Izabel Cristina Fröner e Ricardo Novak Savioli, pelos conhecimentos compartilhados. Aos
Profs(as). Drs(as). Juliana Machado Barroso, Laíse Daniela Carrasco, Danilo
Mathias Zanello Guerisoli e aos Profs. Júlio César Emboava Spanó e Alexandre
Capelli, membros da
primeira turma de Pós-Graduação em Odontologia Restauradora, subárea
Endodontia, em nível de Doutorado, da Faculdade de Odontologia de Ribeirão
Preto da Universidade de São Paulo, pelo companheirismo durante o curso de
Pós-Graduação.
À Profa. Dra. Melissa Andréia Marchesan e sua mãe Sarah Osmond Marchesan, por estarem sempre prontas a
auxiliar na realização e publicação das pesquisas científicas, inclusive
deste trabalho.
À Vice-Reitora, Profa. Melânia
Dalla Torre, ao Diretor do
Instituto de Ciências da Saúde
|
|
"Terra,
não é isto que queres: ressurgir invisível em nós? Não é o teu sonho, uma vez, se
transformar em invisível? Oh
Terra, tu invisível." "Nós
te construímos com as mãos trêmulas. E nós elevamos as tuas torres,
átomo sobre átomo. Mas quem te pode completar? Oh
Catedral!" de Rainer Maria Hilke por José Leite Lopes |
Resumo
BARBIN, E. L. Análise química da clorexidina misturada ou não ao hidróxido de cálcio. 2008. 116 p. Tese (Doutorado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 2008.
O sucesso da terapia endodôntica depende da limpeza, anti-sepsia, escultura e obturação hermética dos canais radiculares, no entanto, o preparo biomecânico não gera redução microbiana suficiente na totalidade dos casos. Devido à inconfiabilidade inerente ao tratamento, parte dos casos ainda resulta em insucesso. As pastas de hidróxido de cálcio vêm sendo empregadas com a finalidade de ampliar a eficiência anti-séptica do tratamento dos canais radiculares além de estimular a recuperação dos tecidos afetados pela infecção endodôntica. O digluconato de clorexidina tem sido empregado na endodontia devido ao amplo espectro de ação principalmente contra "Enterococcus faecalis" e "Candida albicans" e vem sendo adicionado às pastas de hidróxido de cálcio uma vez que as virtudes de um complementam as deficiências do outro. No entanto, devido à estrutura molecular da clorexidina e aos níveis elevados de pH promovidos pelo hidróxido de cálcio, há indícios de risco sistêmico na sua utilização por causa da provável decomposição da clorexidina em radicais livres e para-cloroanilina que está classificada como possível agente carcinogênico em humanos pela IARC. O presente estudo teve como objetivo investigar quimicamente, por meio da Espectrometria de Massas (ESI-TOF-MS) e Cromatografia Líquida (HPLC), a solução de digluconato de clorexidina a 0,2% isolada ou misturada ao hidróxido de cálcio. As análises foram realizadas logo em seguida ao preparo das amostras e após os períodos de 7 e 14 dias de armazenamento à temperatura de 36,5 ºC. Constatou-se que a solução de digluconato de clorexidina isolada foi decomposta em diferentes subprodutos, inclusive em para-cloroanilina oferecendo riscos sistêmicos. Em contato com o hidróxido de cálcio, a decomposição da clorexidina é total com formação de diferentes compostos. Apesar de não ter sido demonstrada a presença de para-cloroanilina na pasta medicamentosa, o elevado número de espécies reativas possui alto potencial de dano sobre o material genético das células do paciente afetadas pela medicação intracanal. É imperativo estabelecer vínculos diagnóstico-terapêuticos precisos por meio do desenvolvimento de protocolos clínicos que restrinjam o uso dessas medicações intracanais a quadros clínicos com infecção endodôntica disseminada e periodontites apicais persistentes. É necessário desenvolver estratégias mais eficientes que utilizem processos biomecânicos de maior eficácia e medicações intracanais efetivas que não ofereçam riscos locais e sistêmicos para que se contemplem os objetivos do tratamento dos canais radiculares com previsibilidade e segurança.
Palavras-chave: Hidróxido de cálcio. Clorexidina. Medicação
intracanal. Espectrometria de massas. Cromatografia líqüida.
BARBIN, E. L. Chemical analysis of chlorhexidine mixed or not with calcium hydroxide. 2008. 116 p. Thesis (Doctoral) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 2008.
The success
of endodontic therapy depends upon root canal cleanliness, antisepsis,
sculpture, and hermetic obturation. However, biomechanical preparation does not
always provide an adequate microbial reduction. Due to the inherent
unreliability of the treatment, some cases still are unsuccessful. Calcium
hydroxide pastes have been used with the aim to improve antisepsis
effectiveness in root canal treatments, in addition to stimulating the recovery
of tissues affected by endodontic infection. Chlorhexidine digluconate has been
used in endodontics due to its broad action spectrum, mainly against
"Enterococcus faecalis" and "Candida albicans", and has
been added to calcium hydroxide pastes so that the advantages of one would
compensate for the other’s deficiencies. However, the structure of the
chlorhexidine molecule in addition to the high pH values promoted by calcium
hydroxide pose a systemic risk in its use due to the likely decomposition of
chlorhexidine into free radicals and para-chloroaniline,
which International Agency for Research on Cancer (IARC) has classified as a
possible carcinogenic agents in humans. The purpose of the present study was to
perform a chemical analysis of chlorhexidine digluconate at 0.2%, isolated or
mixed to calcium hydroxide, using Mass Spectrometry and High-Efficiency Liquid
Chromatography. The analyses were performed shortly after the samples were
prepared, and after 7 and 14 days of storage at 36.5 ºC. It was found that the
isolated chlorhexidine digluconate solution formed different byproducts,
including para-chloroaniline, posing
systemic risks. In contact with calcium hydroxide, chlorhexidine decomposes
completely and forms different compounds. Though the study did not demonstrate
the presence of para-chloroaniline in
the medication paste, the high number of reactive species poses a high risk
over the genetic material of the host cells affected by intracanal medication.
It is mandatory to establish a precise diagnostic-therapeutic relation by
developing clinical protocols that would restrict the use of these intracanal
medications to clinical conditions with disseminated endodontic infection and
persistent apical periodontitis. There is a need for more efficient strategies
that use more effective biomechanical processes and intracanal medications that
do not offer any local or systemic risk so root canal treatment goals can be
considered with predictability and safety.
Keywords: Calcium hydroxide. Chlorhexidine. Intracanal medication. Mass spectrometry. Liquid chromatography.
Sumário
Resumo
Abstract
1 Introdução................................................................................................... 12
2 Retrospecto da
Literatura.......................................................................... 40
3 Proposição.................................................................................................. 69
4 Materiais
e Métodos................................................................................... 70
5 Resultados................................................................................................... 76
6 Discussão.................................................................................................... 93
7 Conclusões................................................................................................ 104
8 Referências
Bibliográficas........................................................................ 106
![]()
1 Introdução
A ciência e os homens que a desenvolvem devem estar ao serviço da sociedade gerando desenvolvimento para que a condição de vida seja sempre melhorada. Especialmente na área da saúde, o conhecimento produzido é gerado para ser utilizado por aqueles que o colocam em prática na busca de superar a doença, prover saúde e vida digna para o indivíduo e a comunidade.
A doença é, então, o estopim que desencadeia um processo que se inicia com o sofrimento, mas que movimenta pessoas e mentes, envolvendo vários setores da sociedade, na busca de torná-la breve e, assim, reduzir suas conseqüências. Mesmo com todo o conhecimento e tecnologia atual, não se consegue preveni-la com a eficiência desejada o que mantém ativa a busca pelo saber, por novas estratégias de diagnóstico e terapêuticas mais eficazes.
1.1 O
Comprometimento Pulpar e do Periodonto Apical
A integridade dental pode ser afetada pela placa bacteriana crítica e não controlada. O processo patológico geralmente ocorre segundo uma evolução cronológica quando não há intervenção profissional do Cirurgião-Dentista. Nesta evolução, a gravidade das alterações eleva-se com o passar do tempo. As alterações reversíveis, como a desmineralização do esmalte, dão lugar às manchas brancas, cáries incipientes, cáries em dentina de profundidade crescente, comprometimento pulpar reversível e, depois, irreversível, necrose pulpar, gangrena da polpa e envolvimento do periodonto apical podendo incorrer em manifestações sistêmicas (THYLSTRUP; FEJERSKOV, 1995; LEONARDO, 2005).
O comprometimento pulpar possui um caráter infeccioso quando resultante de alterações dentais como a cárie. A partir do momento em que a polpa entra em uma condição de irreversibilidade ou inviabilidade, os agentes infecciosos iniciam a invasão do canal dental pela câmara pulpar à medida que a necrose da polpa ocorre, avançando, gradualmente, da coroa para o forame apical. Assim, segmento após segmento, a polpa sofre a necrose e, em seguida, é modificada pelos microrganismos, processo ao qual se denomina gangrena pulpar. Desta forma, a câmara pulpar é infectada seguida pelo canal radicular e chegando ao sistema de canais radiculares, túbulos dentinários e periodonto apical. Os microrganismos invadem esses compartimentos em estado planctônico, ainda vulneráveis, mas, posteriormente, adsorvem-se e aderem-se às superfícies sólidas como, por exemplo, a parede dentinária, colonizando-as. Mais tarde, passam por processos de sucessão e prosperam formando o biofilme condição que eleva a virulência e a resistência da microbiota de duas a mil vezes ao sistema imunológico do hospedeiro e aos anti-sépticos (CLEGG et al., 2006; SVENSÄTER; BERGENHOLTZ, 2004; TYLER et al., 2006; GUYTON, 1998; PEAKMAN; VERGANI, 1999; TRABULSI, 1999).
A causa mais comum do comprometimento pulpar é a infecção por microrganismos devido à cárie dental. Mesmo a necrose pulpar que ocorre por razões assépticas, cedo ou tarde, acaba sendo infectada. O tecido pulpar necrótico é muito facilmente infectado porque as células e as moléculas do sistema imune do hospedeiro não funcionam em condições teciduais necróticas e as células e moléculas do periodonto apical não conseguem atingir a zona necrótica radicular interna (SIQUEIRA et al., 2002).
A microbiota infectante, ao organizar-se no biofilme, modifica as próprias vias metabólicas de forma a sobreviver a períodos de escassez de nutrientes ou condições menos impróprias ao desenvolvimento. Esses microrganismos sintetizam e excretam, no transcorrer dos processos metabólicos, substâncias com ação antigênica as quais desencadeiam a inflamação no hospedeiro o qual se traduz ora em manifestações clínicas crônicas, ora, em agudas (CLEGG et al., 2006; SVENSÄTER; BERGENHOLTZ, 2004; TYLER et al., 2006; DIAS DE OLIVEIRA et al., 2006; LEONARDO, 2005).
Portanto, além da preocupação com a presença de microrganismos na câmara pulpar, canal radicular, sistema de canais radiculares, túbulos dentinários e periodonto apical há, também, substâncias tóxicas originadas dos microrganismos com ação antigênica presentes nestes compartimentos como, por exemplo, lipopolissacarídio (LPS). O LPS compõe a parede celular das bactérias Gram negativas e é liberado, no meio, durante a divisão, ruptura ou morte celular agindo como toxina (endotoxina) despertando o processo inflamatório que continua atuando mesmo após a morte dessas bactérias. O LPS é reconhecido como antígeno pelo sistema imunológico do organismo humano. Apesar da carga positiva das bactérias Gram negativas atrapalhar a ação fagocitária dos macrófagos, quando isso ocorre, grande quantidade de LPS é liberada nos tecidos afetados do hospedeiro desencadeando uma resposta inflamatória significativa. A presença de LPS no periodonto apical é responsável pelo desenvolvimento e manutenção da reação inflamatória e reabsorção óssea. O ácido lipoteicóico e a mureína (mucopeptídio, mucocomplexo, peptidioglicano ou glicopeptídio) também podem ser reconhecidos como antígenos. A mureína compõe 90% da parede celular das bactérias Gram positivas e menos de 5% das Gram negativas. O ácido lipoteicóico está presente somente na parede celular das bactérias Gram positivas e é, na verdade, um grupo de ácidos com moléculas poliméricas semelhantes de alto peso molecular compostas por glicerol e/ou ribitol (BUCK et al., 2001, DIAS DE OLIVEIRA et al., 2006; GUYTON, 1998; PEAKMAN; VERGANI, 1999; TRABULSI, 1999; HAUSMANN et al. 1975; VIANNA, et al., 2007).
Portanto, além de reduzir ao máximo o número de microrganismos e desprovê-los de substrato, ainda é necessário neutralizar as toxinas por eles produzidas (SOARES et al., 2007).
O estado infeccioso dos dentes com necrose e gangrena pulpar toma proporção crítica quando os microrganismos alastram-se para o sistema de canais radiculares, canalículos dentinários, superfície dentinária externa do periápice radicular e periodonto apical. Tal condição está correlacionada com Periodontites Apicais Crônicas. Com a disseminação da infecção, o emprego de instrumentos e soluções endodônticas pode, não mais, reduzir a população de microrganismos ao nível inferior ao de virulência nem eliminar o biofilme bacteriano e, caso a obturação endodôntica seja realizada neste cenário infeccioso, a possibilidade de se ter um insucesso terapêutico é considerável, uma vez que a cárie, a doença periodontal e as doenças periapicais são causadas por microrganismos comensais e não por aqueles classicamente patogênicos. A virulência surge por um desequilíbrio no ambiente e manifesta-se pelo aumento populacional dos microrganismos (CLEGG et al., 2006; DIAS DE OLIVEIRA et al., 2006; ERCAN et al., 2007, SOARES et al. 2007; SVENSÄTER; BERGENHOLTZ, 2004; LEONARDO et al. 2002, LEONARDO, 2005, NAIR et al. 2005; HAAPASALO et al. 2005; GOMES et al., 2006; De ROSSI et al., 2005).
A infecção endodôntica é reconhecida, há muito tempo, como a etiologia primária no desenvolvimento de lesões ósseas periapicais (KAKEHASHI et al., 1965). É a infecção endodôntica e não os produtos da decomposição do tecido pulpar ou do fluido estagnado no canal radicular com polpa necrosada que causa e mantém as periodontites apicais com destruição óssea (SUNDQVIST, 1994, SIQUEIRA et al., 2002). O biofilme microbiano organizado em áreas inacessíveis como o sistema de canais radiculares, túbulos dentinários e superfície apical radicular externa pode não ser removido, de maneira eficaz, somente pela combinação de instrumentos e soluções irrigantes de uso contemporâneo em apenas uma única sessão. Mesmo recursos de limpeza e escultura agressivos de dentes com lesão assintomática no periodonto apical podem evoluir para o insucesso da terapêutica endodôntica. É extremamente importante lançar mão de todos os meios químicos e mecânicos possíveis de serem aplicados para romper e desorganizar o biofilme e reduzir o número de microrganismos para os níveis mais baixo possíveis para se obter, da terapêutica, previsibilidade e prognóstico favorável a longo prazo (CLEGG et al., 2006; NAIR et al. 2005; TRONSTAD et al. 1990; HAAPASALO et al. 2005, ZAMANY et al., 2003).
1.2 A Medicação
Intracanal
A dificuldade em eliminar microrganismos que permanecem nos sistemas de canais radiculares, túbulos dentinários, superfície apical radicular externa e no periodonto apical, mesmo depois dos procedimentos de limpeza e escultura, demonstra a necessidade de se complementar a terapêutica endodôntica com o emprego de uma medicação intracanal após o preparo biomecânico e antes da obturação endodôntica podendo-se utilizar, para isso, o período de tempo entre sessões. Além disso, a medicação intracanal entre sessões se faz necessária nos casos em que a presença de manifestações clínicas como a dor e a constante exsudação impedem o tratamento em uma única sessão. A utilização da medicação intracanal vem sendo sugerida (BYSTRÖM et al., 1985) e utilizada no estado líqüido, gel ou pasta. A maior viscosidade ocorre pela utilização (1) de ingredientes sólidos que, apesar de moídos, apresentam baixa solubilidade e (2) de aglutinantes ou veículos espessos. O veículo pode possuir caráter aquoso, viscoso ou oleoso, sendo completamente inerte ou possuindo ação terapêutica. Como exemplo de veículos, cita-se água destilada estéril, solução fisiológica, "Ringer's Solution" (8,6 g de cloreto de sódio, 0,3 g de cloreto de potássio, 0,33 g cloreto de cálcio em 1000 mL de água), soluções anestésicas com ou sem vasoconstrictores, detergentes aniônicos em solução aquosa, digluconato de clorexidina, suspensão aquosa de "methylcellulose" ou "carboxymethylcellulose" ("polycarboxymethylether of cellulose"), glicerina, "polyethylene glycol" (C2nH4n+2On+1 - "poly Ethane-1,2-diol"), "propylene glycol" ("propane-1,2-diol"), para-monoclorofenol canforado (PMCC), óleo de oliva, óleo de silicone, cânfora (óleo essencial do PMCC), eugenol, "metacresylacetate" e ácidos graxos como ácido oléico e linoléico e "isostearic acid". As substâncias aglutinadas pelo veículo possuem ação biológica, anti-séptica ou de compósito e, entre outras, tem-se o hidróxido de cálcio, óxido de zinco, sulfato de bário, colofônia, iodofórmio (CHI3), lugol (I2 + KI), para-monoclorofenol canforado, digluconato de clorexidina, corticosteróides e antibióticos. Algumas substâncias podem ser utilizadas ora como veículo, ora como aditivo e, ainda, acumulando as duas funções. A escolha do veículo e dos princípios ativos tem sido motivo de controvérsia (SJÖGREN et al. 1991; ESTRELA et al. 1999, ESTRELA; HOLLAND 2003; FAVA; SAUNDERS, 1999; ROSSI et al., 2005; HAAPASALO et al., 2005; VIANA et al., 2007; YÜCEL et al., 2007).
O veículo ao qual o hidróxido de cálcio é misturado para formar a pasta medicamentosa usada na terapêutica endodôntica afeta as propriedades físicas e químicas da medicação intracanal e, por conseguinte, a sua aplicação clínica. Em geral, veículos viscosos e oleosos prolongam a ação do hidróxido de cálcio comparado com veículos aquosos.
Compilando o que foi relatado até aqui, as razões para a utilização da medicação intracanal são (1) eliminar a infecção endodôntica, (2) neutralizar as endotoxinas, (2) prevenir a proliferação de microrganismos entre sessões e (3) agir como uma barreira mecânica que evita a re-infecção do canal radicular e o aporte de nutrientes para microrganismos remanescentes do preparo biomecânico (SIQUEIRA; UZEDA, 1998; YÜCEL et al., 2007).
1.3 O Hidróxido de
Cálcio
O hidróxido de cálcio deveria ser o princípio ativo de escolha das medicações intracanais em dentes com polpa necrosada e lesões periapicais crônicas (NELSON-FILHO et al., 2002). A medicação intracanal com hidróxido de cálcio pode ser utilizada entre sessões para completar a anti-sepsia do canal radicular. A ação antimicrobiana do hidróxido de cálcio como medicação intracanal entre sessões é superior a do para-monoclorofenol canforado e do fenol canforado (BYSTRÖM et al., 1985). Trope et al., em 1999, relatam que a taxa de sucesso clínico é elevada em 10% com a utilização do hidróxido de cálcio como medicação intracanal. Além disso, acredita-se, em geral, que os microrganismos que sobrevivam ao preparo biomecânico podem ter seu número reduzido pela utilização da medicação intracanal entre sessões (YOLDAS et al., 2004).
1.3.1 Origem e Atributos do Hidróxido de Cálcio
Segundo Fava e Saunders (1999), a primeira referência ao hidróxido de cálcio na Odontologia deve ser atribuída a Nygren que, em 1838, o utilizou no tratamento de fístulas correlacionadas às infecções dentais. Os autores relatam que Codman, em 1851, utilizou o hidróxido de cálcio na preservação do tecido pulpar.
Herman, em 1920, sugeriu a utilização do hidróxido de cálcio para o tratamento da polpa dental. A fórmula proposta por esse autor (Calxyl-Otto & CO, Frankfurt, Germany), apesar de conter a adição de outras substâncias, foi considerada pioneira. O hidróxido de cálcio encontra indicações terapêuticas na Odontologia no capeamento pulpar (proteção pulpar direta) e na pulpotomia pela estimulação da mineralização. É indicado, também, como medicação intracanal devido à ação antimicrobiana, capacidade de neutralizar toxinas e, ainda, manter o selamento temporário do canal além de inibir a ação osteoclástica e estimular a reparação dos tecidos do hospedeiro afetados pela infecção e resposta inflamatória. Há, também, indicações específicas como na reparação de perfurações iatrogênicas, no tratamento de fraturas horizontais, como constituinte de cimentos endodônticos, no tratamento de canais calcificados e reabsorções radiculares (ESTRELA et al. 1999; ESTRELA; HOLLAND, 2003; YÜCEL et al., 2007).
Portanto, o hidróxido de cálcio tem sido usado na Endodontia na manipulação da medicação intracanal em consistência de pasta aglutinado por um veículo líqüido, viscoso ou oleoso, hidrofílico ou hidrofóbico, com a finalidade de (1) permitir a completa obturação do canal pela medicação e (2) selar temporariamente o canal pelo período entre consultas. O veículo da pasta deve permitir a dissociação do hidróxido de cálcio no meio aquoso em hidroxila e íon cálcio e possibilitar a difusão no meio tanto do hidróxido de cálcio quanto dos íons resultantes da sua dissociação (ESTRELA; HOLLAND, 2003; FAVA; SAUNDERS,1999).
A ação da medicação intracanal varia em função da quantidade de medicação empregada e é limitada pelo pequeno volume do canal radicular. Além disso, as medicações em estado líqüido poderiam ter, rapidamente, a concentração das substâncias ativas diminuída pela difusão pelo forame e através do tecido dentinário. A soma desses dois fatores limitaria, criticamente, a quantidade molecular dos agentes terapêuticos diminuindo a ação antimicrobiana e elevando o risco de re-contaminação caso a concentração da medicação atinja níveis inferiores ao inibitório mínimo para o crescimento microbiano (BASRANI et al., 2002).
O mecanismo da ação antimicrobiana do hidróxido de cálcio pode ser creditado à extrema elevação do pH resultante da dissociação, no meio aquoso, em hidroxila e íon cálcio que (1) prejudica as enzimas localizadas na membrana citoplasmática das bactérias as quais participam do crescimento, do metabolismo, da divisão celular, da formação da parede celular, da biossíntese de lipídios, do transporte de elétrons e da fosforilação oxidativa; (2) danifica os fosfolipídios da membrana citoplasmática promovendo sua oxidação degradativa; (3) danifica as enzimas bacterianas com ação de digestão extracelular hidrolisando nutrientes como, carboidratos, proteínas e lipídios e as enzimas intracelulares que possuem atividade respiratória na parede celular das bactérias. Esta somatória de efeitos tóxicos prejudica, significativamente, as células dos microrganismos. Ressalta-se que a manutenção dos níveis elevados de concentração de hidroxilas e, como conseqüência, do pH, está diretamente correlacionado com a velocidade e a eficácia da ação do hidróxido de cálcio (SJÖGREN et al. 1991; ESTRELA et al. 1995; ESTRELA et al. 1999; ESTRELA; HOLLAND 2003; GOMES et al. 2006).
O processo de fosforilação
oxidativa refere-se à fosforilação do ADP (adenosina difosfato) em ATP
(adenosina trifosfato) utilizando energia liberada pelas reações de
óxido-redução que ocorrem pelas transferências de elétrons.
A degradação oxidativa de
lipídios "Lipid peroxidation" é um processo em que radicais
livres roubam elétrons dos lipídios constituintes da membrana celular
resultando em dano à célula. Trata-se de uma reação que pode ocorrer em cadeia
iniciada por uma espécie reativa de oxigênio, como, por exemplo, um íon
hidroxila que é considerado um radical livre. A degradação oxidativa de
lipídios é considerada uma reação de saponificação.
O hidróxido de cálcio também promove modificações no pH interno da bactéria influenciando o metabolismo celular e promovendo alteração na forma, mobilidade, ajuste de transportadores, polimerização de componentes; ativação do crescimento, proliferação celular, transporte através da membrana e volume celular (ESTRELA; HOLLAND 2003).
Os danos às proteínas enzimáticas expostas aos elevados níveis de pH se devem ao processo de desnaturação no qual a proteína perde a sua estrutura tridimensional, ou seja, os níveis elevados de pH podem desenrolar uma proteína fazendo com que ela perca sua suas propriedades como a atividade enzimática ou a participação na integridade da membrana celular a qual faz parte causando, por exemplo, problemas no transporte de nutrientes. No entanto, acredita-se que, se o pH retornar aos níveis mais baixos, níveis estes, ótimos para ação enzimática, estas proteínas poderiam ser reativadas. Seria necessário um longo período de tempo em condições de pH extremamente elevado para fazer com que a desnaturação protéica ocorresse de forma irreversível (ESTRELA et al. 1994).
A medicação intracanal contendo hidróxido de cálcio deveria permanecer no canal radicular pelo período de, no mínimo, sete dias para se atingir os níveis mais elevados de pH (YÜCEL et al., 2007).
Danos na membrana citoplasmática e
parede celular das bactérias que alteram a permeabilidade ou a seletividade do
transporte de substâncias podem deixar a célula bacteriana à mercê da osmose. A
concentração de solutos no citoplasma bacteriano chega a ser mil vezes maior
que a do meio externo e, caso os mecanismos de transporte e permeabilidade
de membrana sejam afetados, as células poderiam sofrer rupturas perdendo
citoplasma para o meio (TRABULSI, 1999).
O hidróxido de cálcio é capaz de neutralizar endotoxinas bacterianas, especialmente, o lipopolissacarídio (LPS) presente na parede celular das bactérias Gram negativas por meio da hidrólise do lipídio que compõe parte da molécula do LPS. Enfatiza-se que o "Lipid A", que é responsável pela ação biológica ou antigênica do LPS, é hidrolisado quando submetido a níveis de pH extremamente elevados como os gerados pelo hidróxido do cálcio em meio aquoso (ESTRELA et al. 1999; ESTRELA et al. 1995; ESTRELA; HOLLAND 2003, BUCK et al. 2001, DIAS DE OLIVEIRA et al., 2006; HAAPASALO et al. 2005; ROSSI et al., 2005; TANOMARU et al., 2003; NELSON-FILHO et al., 2002).
Haapasalo et al., em 2005, relataram que a aplicação da medicação intracanal entre sessões, após o preparo químico e mecânico do canal radicular, deixaria remanescentes teciduais necróticos mais susceptíveis à ação solvente do hipoclorito de sódio aplicado na consulta seguinte. O hipoclorito de sódio também possui ação solvente efetiva no tecido pulpar recentemente desvitalizado (ESTRELA et al., 2002; SPANO et al., 2002; BARBIN, 1999; SANTOS, 1999).
Heithersay, em 1975, relata que os íons cálcio liberados pela dissociação em meio aquoso do hidróxido de cálcio atuam na redução da permeabilidade dos vasos sangüíneos recém formados no tecido de granulação reduzindo a exsudação e a quantidade de líqüido extracelular no tecido inflamado. Isso aumentaria a concentração de fosfatase alcalina como, também, dos íons hidroxila, mantendo o pH elevado e beneficiando o hospedeiro.
A aplicação terapêutica do hidróxido de cálcio produz resultados biológicos que provêem meios de recuperação aos tecidos afetados pela infecção endodôntica, tanto devido à ação anti-séptica e de neutralização de endotoxinas quanto pela recuperação tecidual que se dá pela capacidade do hidróxido de cálcio ativar enzimas do hospedeiro como, por exemplo, a fosfatase alcalina que apresenta efeitos mineralizadores. No entanto, os efeitos do hidróxido de cálcio necessitam de tempo para que ocorram como, também, da manutenção de altas concentrações de hidroxila para que se mantenha o pH em níveis extremamente elevados (ESTRELA; HOLLAND 2003; ESTRELA et al. 1999; SJÖGREN et al. 1991; COOK, et al., 2007; Al-NAZHAN; Al-OBAIDA, 2007; YÜCEL et al., 2007).
Estrela e Holland, em 2003, ressaltaram que (1) é necessário prover tempo para o hidróxido de cálcio manifestar seu potencial antimicrobiano nas infecções endodônticas; (2) é imprescindível manter altas concentrações de hidroxila por um período de tempo adequado para que se afete a atividade enzimática das bactérias ou promovendo sua inativação; (3) as enzimas afetadas pelo hidróxido de cálcio estão situadas na membrana citoplasmática bacteriana; (4) o hidróxido de cálcio apresenta um largo espectro de ação, independentemente das capacidades metabólicas dos microrganismos; (5) o largo espectro de ação antimicrobiana do hidróxido de cálcio se deve á sua atuação na membrana citoplasmática a qual apresenta características similares seja qual for a morfologia, o arranjo, a suscetibilidade aos corantes ou a via respiratória da bactéria. Portanto, o hidróxido de cálcio age nas bactérias de maneira similar em cocos, bacilos, filamentosos ou espiralados; diplococos, tétrades, sarcinas, estreptococos, estafilococos, diplobacilos ou estreptobacilos; aeróbios ou anaeróbios, Gram positivos ou negativos; (6) a medicação intracanal temporária contendo hidróxido de cálcio em consistência de pasta aplicada no período entre sessões age com mais eficiência na recuperação dos tecidos afetados do periodonto apical quando comparado com o tratamento em uma única sessão.
1.3.2 Deficiências do Hidróxido de Cálcio
O hidróxido de cálcio é um eficiente bactericida contra a maioria das bactérias presentes nas infecções endodônticas (BYSTRÖM, et al., 1985) apresentando, associado a diferentes veículos, ação antimicrobiana aplicado diretamente em contato com microrganismos por períodos de ação que variam de 48 horas ("Enterococcus faecalis", "Staphylococcus aureus", "Pseudomonas aeruginosa", "Bacillus subtilis", "Streptococcus mutans" e "Candida albicans") até 72 horas ("Enterococcus faecalis", "Staphylococcus aureus", "Pseudomonas aeruginosa" e "Bacillus subtillis"). No entanto, o hidróxido de cálcio não possui ação à distância contra os mesmos microrganismos citados, ou seja, não age quando não há contato direto e, portanto, quando depende da difusão no meio para ter ação. Este é um sério agravo, uma vez que os sítios mais distantes acabam por não ter uma elevação significativa do pH como a que ocorre no canal principal que se encontra em direto contato com a medicação. Assim, as zonas mais profundas do sistema de canais radiculares e o interior dos túbulos dentinários podem não ser significativamente beneficiados pelos elevados níveis de pH gerados pelo hidróxido de cálcio (ESTRELA et al., 1995; ESTRELA et al., 1999; ESTRELA et al., 2001; ESTRELA; HOLLAND 2003; DOTTO et al., 2006).
A "Enterococcus faecalis" é comumente isolada de amostras clínicas e do trato intestinal humano e apresenta peculiar resistência ao hidróxido de cálcio, em especial, aos níveis elevados de pH resultante da sua dissociação em meio aquoso que libera íons hidroxila (ØRSTAVIK et al., 1999; ESTRELA et al., 1998; ESTRELA et al., 1999; SIQUEIRA et al., 2007 b). O fungo unicelular de brotamento que é a principal espécie patogênica causadora de Candidíase (Monilíase), a "Candida albicans", também se mostra resistente ao hidróxido de cálcio (WALTIMO et al., 1999; WALTIMO et al., 2003; WALTIMO et al., 2004). Ambos são encontrados nas infecções endodônticas, principalmente as persistentes. Devido ao fato do "Enterococcus faecalis" ser considerado um "nonfastidious microbe", ou seja, microrganismo que não requer um meio de cultura especializado com requisitos nutricionais complexos para ser cultivado, ele vem sendo amplamente utilizado em pesquisas microbiológicas (BASRANI et al. 2002).
O "Enterococcus faecalis" apresenta uma prevalência discreta em casos diagnosticados com necrose pulpar incipiente, ou seja, sem comprometimento patológico crônico do periodonto apical. Porém, estabelece alta prevalência nos casos de fracasso terapêutico associado à periapicopatias persistentes, principalmente, sem manifestações clínicas espontâneas, i.e., patologias crônicas do periodonto apical, principalmente, aquelas relacionadas a tratamentos endodônticos fracassados. Além disso, o "Enterococcus faecalis" está correlacionado a uma série de patologias sistêmicas importantes o que indica a priorização do tratamento dessas infecções endodônticas e o retratamento dos casos de insucesso clínico com periapicopatias persistentes (STUART et al., 2006; SCHIRRMEISTER et al., 2007; HOLT et al., 2007; SIQUEIRA et al., 2007 b; ROYAL et al., 2007).
O "Enterococcus faecalis" é uma bactéria Gram positiva que, morfologicamente, é definida como sendo um coco. Geralmente é encontrado isoladamente, mas pode arranjar-se aos pares (diplococos) ou em pequenas cadeias (estreptococos). O "Enterococcus faecalis" exibe grande resistência às defesas do hospedeiro e aos quimioterápicos devido aos seus fatores de virulência, ressaltando-se que (1) apresenta resistência a níveis de pH elevados o que o torna refratário às medicações intracanais contendo hidróxido de cálcio isolado devido à capacidade homeostática relacionada ao pH além de ser auxiliado pela ação degradativa que a dentina e o exsudato exercem sobre o hidróxido de cálcio; (2) suportam ambientes inóspitos, i.e., altas concentrações de sais; (3) suporta escassez nutricional; (4) apesar de não esporularem, são capazes de resistirem ao ressecamento e voltarem ao estado vegetativo clássico quando, por exemplo, banhados pelo líqüido tissular; (5) adere-se à dentina; (6) invade túbulos dentinários; (7) altera a resposta imune do hospedeiro inibindo a ação dos linfócitos; (8) sintetiza "lytic enzymes", "cytolysin", "aggregation substance", feromônios, e ácido lipoteicóico; (9) utiliza o líqüido tissular como fonte nutricional; (10) compete de maneira efetiva com outras bactérias; (11) organiza-se em biofilme; e (12) transfere características de resistência ou virulência aos microrganismos adjacentes, principalmente quando organizado em biofilme. Em conseqüência da abundância de fatores de virulência, o "Enterococcus faecalis" compõe, com freqüência, a única população ou a que predomina dentre um número reduzido de outras populações que compõe a comunidade infectante do canal radicular (STUART et al., 2006; HOLT et al., 2007).
O "Enterococcus faecalis" apresenta especial resistência ao hidróxido de cálcio. Portanto, as medicações intracanais contendo hidróxido de cálcio como único elemento ativo são ineficazes em eliminar o "Enterococcus faecalis" do canal dental sendo, até, menos efetivas que o "Iodine Potassium Iodide", também denominado de Lugol, IPI ou IKI, ou que o iodofórmio (CHI3) veiculado em propilenoglicol (ERCAN et al. 2007; STUART et al., 2006; GOMES et al., 2006; ROSSI et al., 2005; SIQUEIRA et al., 2007 b; DOTTO et al., 2006).
A associação do hidróxido de cálcio com o PMCC vem sendo utilizada com o intuito de ampliar o espectro de ação do hidróxido de cálcio, principalmente contra bactérias facultativas e aeróbicas. Embora se conheça o potencial citotóxico do PMCC, a combinação dessas duas substâncias é eficaz em eliminar bactérias anaeróbias estritas e facultativas localizadas nos túbulos dentinários (LEONARDO et al. 1994; FAVA; SAUNDERS, 1999).
Reitera-se, portanto, que a despeito de haver atividade antimicrobiana do hidróxido de cálcio aplicado em contato direto com os microrganismos (ESTRELA et al., 2001; WALTIMO et al., 2003; WALTIMO et al., 2004), tem sido demonstrado que o hidróxido de cálcio não é efetivo em eliminar microrganismos alojados profundamente nos túbulos dentinários ou no sistema de canais radiculares e que isso estaria, provavelmente, relacionado com a sua baixa solubilidade ou com uma pequena capacidade de difusão no meio (ESTRELA et al., 1999, ERCAN et al. 2007).
A prevalência dos fungos nas infecções endodônticas é, aproximadamente, de 5 a 20 %. Geralmente, à semelhança do "Enterococcus faecalis", os fungos estão discretamente associados à periodontites apicais primárias correlacionadas a dentes com necrose pulpar que ainda não se submeteram à terapêutica endodôntica, mas, principalmente, à periapicopatias secundárias persistentes que ocorrem em dentes com tratamento endodôntico fracassado. A maioria dos fungos isolados em infecções endodônticas pertence ao gênero "Candida" e a "Candida albicans" é a espécie predominante entre as demais ("Candida glabrata", "Candida guilliermondii", "Candida inconspicua" e "Geotrichum candidum"). A "Candida albicans" tem a capacidade de congregar-se com bactérias Gram positivas do gênero "Streptococcus" ("Streptococcus gordonii", "Streptococcus mutans" e "Streptococcus sanguis") facilitando a formação do biofilme que promove meio de sobrevivências para outros microrganismos os quais podem co-habitar ou suceder os microrganismos que chegaram antes ou, até mesmo, iniciaram o biofilme. A "Candida albicans" apresenta vários fatores de virulência importantes como a (1) aderência que permite iniciar a colonização de superfícies sólidas como as dos tecidos duros dentais; (2) formação de hifas que penetram nos túbulos dentinários; (3) tigmotropismo (evolução orientada por meio de contato mecânico) que contribui com a retenção e penetração nos túbulos dentinários; (4) secreção de proteases que permitem a sobrevivência em condições com aporte limitado de nutrientes; (5) alteração do fenótipo que garante adaptação em condições desfavoráveis ao desenvolvimento e (6) utilização da dentina como fonte de nutrientes. A variedade de fatores de virulência permite que a "Candida albicans" adira e penetre nos túbulos dentinários sobrevivendo em ambientes com níveis elevados de pH. Apesar de não haver evidências suficientes que provoquem consenso a respeito da capacidade dos fungos em colonizarem a superfície apical radicular externa como, também, de infectarem as demais estruturas do periodonto apical, a participação no estabelecimento do biofilme em conjunto com bactérias e a resistência à distância ao hidróxido de cálcio são sérios agravos no equilíbrio entre saúde e doença (WALTIMO et al., 2003; WALTIMO et al., 2004).
Salienta-se que há, ainda, alguns fatores que interferem na eficácia dos agentes antimicrobianos correlacionados com (1) a dentina; (2) o "smear layer"; (3) e o biofilme estruturado em uma ou várias camadas apresentado células aglutinadas por matriz extracelular e (4) o exsudato. As proteínas e os minerais da dentina podem se ligar aos anti-sépticos promovendo sua inativação; o "smear layer" e o biofilme agem como barreiras que previne a exposição dos microrganismos às concentrações inibitórias efetivas dos anti-sépticos. No caso do hidróxido de cálcio, qualquer fator que limite o contato direto é crítico para sua ação antimicrobiana. O exsudato dilui o anti-séptico limitando sua capacidade e, as macromoléculas, nele contidas, podem se ligar ao anti-séptico promovendo sua inativação. Além disso, o exsudato pode neutralizar as hidroxilas do meio devido ao mecanismo homeostático de manutenção do pH em níveis ótimos enzimáticos do hospedeiro por meio de substâncias com ação tampão (WALTIMO et al., 2003; WALTIMO et al., 2004; DOTTO et al., 2006).
Levando em consideração que a resolutividade da terapêutica endodôntica não é total exibindo uma freqüência de insucessos que não é desprezível a qual é tão maior quão mais disseminada é a infecção, percebe-se que o hidróxido de cálcio, apesar de reunir uma série ampla de atributos, não provê, por si só, condições para a cura dos tecidos afetados, especialmente, em casos de dentes com periodontites apicais crônicas correlacionadas com polpa necrosada e, principalmente, tratamentos fracassados. Cabe ressaltar a ampla variação na susceptibilidade ao hidróxido de cálcio das populações de microrganismos que compõe a comunidade infectante endodôntica (bactérias anaeróbias estritas, Gram positivas facultativas e cocos, bacilos e filamentos Gram negativos). Enfatiza-se a grande resistência do "Enterococcus faecalis" ao hidróxido de cálcio e a baixa eficiência da ação à distância a qual depende da difusão no meio. Além disso, há alguns aspectos que não estão esclarecidos ou sem unanimidade como (1) o período de ação da medicação intracanal contendo hidróxido de cálcio, (2) o tipo de veículo e (3) a necessidade de se adicionar outro anti-séptico à medicação contendo hidróxido de cálcio com ação terapêutica complementar que atue em conjunto sem inativar suas ações biológicas e antimicrobianas (SOARES et al., 2007; ESTRELA et al., 1995; ESTRELA et al., 1999; ESTRELA et al., 2001; ESTRELA; HOLLAND 2003; DOTTO et al., 2006).
1.4 O Digluconato
de Clorexidina
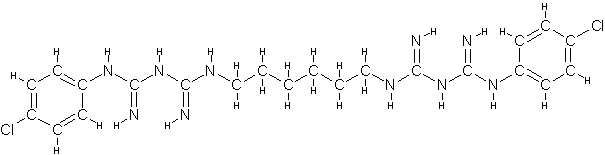
O designação IUPAC ("International Union of Pure and Applied Chemistry") do digluconato de clorexidina é "(1Z) -2- [6-[[amino- [[amino- [(4-chlorophenyl) amino] methylidene] amino] methylidene] amino] hexyl] -1- [amino- [(4-chlorophenyl) amino] methylidene] guanidine; 2,3,4,5,6-pentahydroxyhexanoic acid" com massa molecular de 701,6019 g/mol, massa monoisotópica 700,2615 e fórmula molecular "C28H42Cl2N10O7" (PUBCHEM, 2008). Destaca-se que esta substância ora é chamada de digluconato de clorexidina e ora de gluconato de clorexidina. O prefixo "di", que significa duplo, pode ser confundido com "D-" que designa "dextrorotatory glucose", ou seja, que o íon negativo gluconato originou-se do ácido D-glucônico que, por sua vez, veio da D-glicose. Convencionou-se utilizar digluconato de clorexidina por ser este o que esta presente no rótulo do reagente utilizado na preparação das amostras testadas (digluconato de clorexidina a 20 %, Sigma-Aldrich, WGK, Germany).
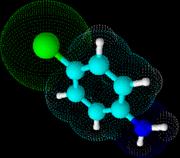
O digluconato de clorexidina é um sal cujo íon positivo é a clorexidina "C22H30Cl2N10" com massa molecular de 505,4460 g/mol, massa monoisotópica de 504,2032 Da (Dalton) e número de registro CAS "55-56-1". Do ponto de vista da farmacocinética, a clorexidina possui uma taxa de 87% de vinculação com proteínas do plasma sanguíneo, ou seja, uma vez no sangue, apenas 13% da clorexidina estaria desvinculada e em condições de ser excretada elevando a meia-vida dessa substância no organismo do paciente (YEUNG et al., 2007; WISHART et al., 2007; PUBCHEM, 2008). A estrutura química da clorexidina pode ser observada na Figura 1.
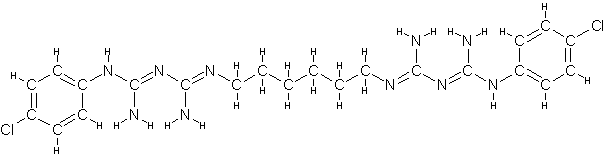
Figura
1. Estruturas
químicas da Clorexidina. Na parte superior, a estrutura mais frequentemente
relatada (PUBCHEM, 2008) e, na parte inferior, uma configuração ressonante.
A
clorexidina possui na sua estrutura molecular grupos funcionais e radicais
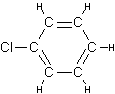
"amino", "phenyl" ("chlorophenyl"),
"methylidene", "hexil" e "guanidine", os quais se
encontram ilustrados na Figura 2.
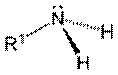
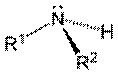
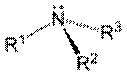
(A) (B) (C)
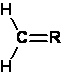

(D) (E)
(F) (G)
Figura
2. Grupos
funcionais (A) amina (amino) primária, (B) amina secundária, (C) amina
terciária, (D) "methylidene", (E) "hexil", (F)
"chlorophenyl" e (G) "guanidine".
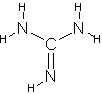
Amino refere-se às aminas ou outro composto
químico contendo o grupo NH2
combinado com um radical orgânico não ácido. Pode ser primária, secundária,
terciária e até mesmo, quaternária.
Fenil faz parte do grupo funcional Aryl derivado
de um anel aromático simples.
"Methylidene" é um radical "CH2="
no qual as valências livres são parte de uma dupla
ligação.
Hexil é o radical hidrocarbono "-C6H13".
A clorexidina foi desenvolvida, em 1940, nos laboratórios de pesquisa da "Imperial Chemical Industries Ltd., Macclesfield, England". Inicialmente projetada para ser utilizada como agente anti-viral, fracassou sendo abandonada pela ineficiência, mas foi redescoberta, anos mais tarde, como agente anti-bacteriano. A clorexidina é uma base forte mais estável na forma de sal. Os sais originalmente produzidos foram "chlorhexidine acetate" e "chlorhexidine hydrochloride", mas ambos apresentam baixa solubilidade em água e, por essa razão, foram substituídos com o passar do tempo, pelo "chlorhexidine digluconate" ou digluconato de clorexidina (ZENDER, 2006; ZAMANI et al., 2003).
O digluconato de clorexidina é categorizado terapeuticamente como substância antimicrobiana, anti-séptico tópico e também na categoria de desinfetante. Há uma grande variedade de produtos que contém digluconato de clorexidina utilizados nas áreas médica, odontológica, veterinária e alimentar, dentre eles, cita-se, "Corsodyl", "Hibiclens", "Hibidil", "Hibiscrub", "Hibitane", "Plac Out", "Plurexid" e "Rotersept".
1.4.1 Origem e Atributos do Digluconato de Clorexidina
A clorexidina vem sendo utilizada na Odontologia no controle da placa bacteriana ou biofilme dental como, também, no tratamento das infecções periodontais principalmente como princípio ativo de enxaguatórios bucais (THYLSTRUP; FEJERSKOV, 1995).
Cervone et al., em 1990, avaliaram a ação antimicrobiana da clorexidina associada a um dispensador gradual vinílico e, mediante os resultados obtidos, sugeriu que sua utilização parecia ser efetiva em áreas localizadas como o canal radicular.
Podbielski et al., em 2000, examinaram a ação antimicrobiana de cones de guta-percha impregnados com clorexidina e óxido de zinco observando grande eficácia.
A adição da clorexidina às pastas medicamentosas contendo hidróxido de cálcio foi sugerida em um Pôster Clínico apresentado por Quillin et al., em 1992, na 49ª Sessão Anual da "American Association of Endodontists" que ocorreu no período de 6 a 9 de maio de 1992 em "San Francisco Hilton, on Hilton Square, San Francisco, CA, United States of America".
A utilização da clorexidina como medicação intracanal vem sendo exaustivamente avaliada (FAVA; SAUNDERS, 1999; GOMES et al., 2003; VIANNA et al., 2007; SOARES et al., 2007; PRADO et al., 2004; FARIA et al., 2007; ZEHNDER, 2006; YESILSOY et al., 1995; SIQUEIRIA; USEDA, 1997; ZAMANI et al. 2003; GOMES et al., 2006; RÖLLA et al., 1970; KOMOROWSKI et al., 2000; BASRANI et al., 2002; GOMES et al., 2006; PAQUETTE et al., 2007; ROSENTHAL, SPANGBERG; SAFAVI, 2004; TYLER et al., 2006).
O digluconato de clorexidina tem mostrado vantagens em relação às outras substâncias usualmente adicionadas às pastas de hidróxido de cálcio, como, por exemplo, o para-monoclorofenol canforado (PMCC) e o iodofórmio. Soares et al., em 2007, constataram maior efeito antimicrobiano residual nas pastas à base de hidróxido de cálcio adicionadas de digluconato de clorexidina a 2,0 % quando comparada com as adicionadas de PMCC. Dotto et al., em 2006, observou que o hidróxido de cálcio pode interferir na capacidade antimicrobiana do iodofórmio descreditando essa associação.
Chang et al., em 1998, observaram ação citotóxica do PMCC em fibroblastos pulpares humanos. O para-monoclorofenol canforado apresentou maior citotoxicidade que o fenol canforado, apesar de ambos não terem exibido ação genotóxica. CHANG et al., em 1999, evidenciaram ação citotóxica do PMCC em células do ligamento periodontal com inibição da viabilidade e proliferação celular sugerindo que o PMCC pode causar dano ao periodonto impedindo a recuperação dos tecidos que compõe o periodonto apical.
O digluconato de clorexidina, em concentrações iguais ou inferiores a 0,25%, é marcadamente menos agressivo exibindo reações inflamatórias mais brandas e não gerando necrose tecidual nem edema persistente, mas, em concentrações iguais ou maiores que 0,5%, produz necrose tecidual e exacerba o processo inflamatório atuando de maneira desfavorável retardando o processo de reparação tecidual do periodonto apical. O digluconato de clorexidina a 0,12% possui ação tóxica tecidual equivalente ao hipoclorito de sódio a 5,25% e na concentração de 2,0 % chega a promover irritação na pele (PRADO et al., 2004; FARIA et al., 2007; ZEHNDER, 2006; YESILSOY et al., 1995).
O digluconato de clorexidina é um potente anti-séptico de amplo espectro e, já há alguns anos, vem sendo amplamente utilizado no controle da placa bacteriana ou biofilme dental em solução aquosa cuja concentração varia entre 0,1 a 0,2 % enquanto que a concentrações de 0,2 a 2,0 % geralmente têm sido empregadas como solução irrigante e medicação intracanal na Endodontia (SIQUEIRIA; USEDA, 1997; ZEHNDER, 2006; ZAMANI et al. 2003; THYLSTRUP; FEJERSKOV, 1995; GOMES et al., 2006).
O digluconato de clorexidina vem demonstrando ter propriedades antimicrobianas de longa duração (ação residual) devido à rara capacidade de se ligar reversivelmente às superfícies dentais, hidroxiapatita e mucinas salivares podendo se desligar dessas estruturas mediante a elevação do gradiente de concentração. Reiterando, a hidroxiapatita é capaz de armazenar moléculas de digluconato de clorexidina e desprendê-las, gradualmente, no meio, estabilizando a concentração do anti-séptico em níveis suficientes para manter uma ação bacteriostática nos compartimentos endodônticos por um período de tempo prolongado. Portanto, o digluconato de clorexidina adsorve-se nos tecidos dentais (hidroxiapatita) e em mucinas salivares sendo liberado quando a concentração no meio se reduz. Esta possibilidade de se formarem reservas de clorexidina na superfície dental da qual a clorexidina é lentamente liberada é capaz, então, de prevenir a colonização bacteriana e o desenvolvimento do biofilme. A capacidade antimicrobiana de longa duração é demonstrada, especialmente, contra o "Enterococcus faecalis" e "Candida albicans". Essa atividade resultante da adsorção e da subseqüente liberação da clorexidina no meio pela dentina é denominada de substantividade e é uma de suas grandes virtudes (RÖLLA et al., 1970; ZAMANY et al., 2003; KOMOROWSKI et al., 2000; BASRANI et al., 2002; SOARES et al., 2007, GOMES et al., 2006).
Salienta-se a relação direta entre o volume da solução de clorexidina que ocupa o canal radicular e a sua adsorção na parede dentinária. O volume do canal radicular após o preparo biomecânico pode variar de 10 a 30 microlitros (PAQUETTE et al., 2007).
A aplicação da solução de digluconato de clorexidina a 2,0% por 10 minutos, previamente à obturação endodôntica, é capaz de penetrar no tecido dentinário radicular e manter a eficiência antimicrobiana por mais de 12 semanas embora a capacidade reduza em função do tempo. A utilização do digluconato de clorexidina a 2,0%, previamente à obturação, pode ser vantajosa em casos com infecção primária. Nos retratamentos, a utilização da clorexidina pode ser ainda mais importante, podendo ser realizada alternadamente durante o preparo químico-mecânico ou como medicação intracanal (ROSENTHAL, SPANGBERG; SAFAVI, 2004).
O digluconato de clorexidina a 1,0% tem a capacidade de difundir-se por todo o volume do biofilme de "Candida albicans", no entanto, essa difusão não é uniforme e parece percorrer micro-canais. A presença de micro-canais sugere que há certa organização no biofilme ou, pelo menos, que o biofilme apresenta uma estrutura complexa, pois os micro-canais poderiam contribuir com a entrada de nutrientes e saída de excretas. A distribuição da clorexidina no interior do biofilme sugere que há uma preferência por determinados sítios de células microbiais (TYLER et al., 2006).
O digluconato de clorexidina exibe amplo espectro de ação sobre linhagens Gram positivas e negativas (HENNESSEY, 1973; EMILSON, 1977), sendo que os cocos Gram positivos apresentam especial sensibilidade (HENNESSEY, 1973). Além disso, os microrganismos do gênero "Staphylococcus", assim como as espécies "Streptococcus mutans", "Streptococcus salivarius" e "Escherichia coli" são afetados pelo digluconato de clorexidina em concentrações reduzidas. Apesar disso, há grande variação na susceptibilidade dos microrganismos que compões a comunidade infectante endodôntica ao digluconato de clorexidina. Destaca-se a potente ação a qual é particularmente efetiva contra a espécie Gram positiva "Enterococcus faecalis" (BASRANI et al., 2002) e ao fungo "Candida albicans" (WALTIMO et al., 1999; PAQUETTE et al. 2007), microrganismos que vem sendo correlacionados com fracassos terapêuticos assim como contra as bactérias anaeróbias facultativas e as do gênero "Enterococcus" (HENNESSEY, 1973; MOLANDER et al., 1998; SUNDQVIST et al., 1998). Porém, registra-se susceptibilidade reduzida das linhagens do gênero "Proteus", "Pseudomonas" e "Klebsiellade" as quais são bactérias Gram negativas. O "Streptococcus sanguis" apresenta susceptibilidade intermediária. E, entre as bactérias anaeróbias mais resistentes, destacavam-se os cocos Gram negativos (EMILSON, 1977), no entanto, estes possuem prevalência reduzida nas infecções endodônticas (VIANNA et al., 2007).
A ação antimicrobiana do digluconato de clorexidina está relacionada à ligação eletrostática entre as moléculas catiônicas do anti-séptico e as cargas negativas da parede celular bacteriana. O digluconato de clorexidina adsorve-se sobre a parede celular microbiana causando alterações no equilíbrio osmótico e perda de componentes intracelulares (DELANY et al., 1982; GOMES et al., 2006). O digluconato de clorexidina a 0,2% pode ser um efetivo agente antimicrobiano quando empregado tanto como solução irrigante quanto medicação intracanal com o objetivo de reduzir a infecção endodôntica no preparo biomecânico ou debelar os microrganismos que resistiram à limpeza e escultura do canal radicular (DELANY et al., 1982). A ação antimicrobiana do digluconato de clorexidina a 0,12% é similar ao do hipoclorito de sódio a 5,25% contra "Streptococcus mutans" (bactéria Gram positiva aeróbia); "Peptostreptococcus micros" (Gram positiva anaeróbia); "Prevotella intermedius" e Porphyromonas gingivalis (bactérias Gram negativas anaeróbias) (YESILSOY et al., 1995).
Com relação às vias metabólicas da clorexidina, quando ingerida, resulta em níveis plasmáticos reduzidos e é excretada nas fezes (90%) e na urina (10%). A freqüência de segmentação metabólica pela ingestão oral também é muito baixa e não há evidências de formação de para-cloroanilina. Quando veiculada na corrente sangüínea de cães, é metabolizada no fígado e nos rins observando-se metabólicos polares e clorexidina intacta na bile (WINROW, 1973).
Portanto, o digluconato de clorexidina exibe uma ampla lista de virtudes como (1) largo espectro de ação antimicrobiana; (2) substantividade; (3) efeito residual; (4) baixa citotoxicidade em concentrações iguais ou menores que 0,25%; (5) ação antibacteriana contra "Enterococcus faecalis" e (6) ação antifúngica contra "Candida albicans" (RÖLLA et al., 1970; ZAMANY et al., 2003; KOMOROWSKI et al., 2000; BASRANI et al., 2002; SOARES et al., 2007; PAQUETTE et al. 2007; WALTIMO et al., 1999). Tais virtudes fizeram com que o digluconato de clorexidina a 1,0% substituísse o timerosal na famosa formulação Merthiolate, anti-séptico tópico indicado para pequenos ferimentos na pele. O timerosal é um composto organomercurial e foi retirado do mercado brasileiro pela Resolução ANVISA (Agência Nacional de Vigilância Sanitária) 528 de 17 de abril de 2001 (PRADO et al., 2004).
1.4.2 Deficiências do Digluconato de Clorexidina
O digluconato de clorexidina isolado aplicado como medicação intracanal na concentração de 2,0% em estado líqüido já se mostrou ineficaz em reduzir a infecção endodôntica. Observou-se que, na sessão seguinte ao período de aplicação da medicação intracanal em estado líqüido, os canais que haviam sido completamente preenchidos estavam vazios, ou seja, a medicação em estado líqüido pode ter escapado pelo forame apical ou difundido pela dentina. (PAQUETTE et al. 2007; BASRANI et al., 2002). Prado et al., em 2004, relataram que o digluconato de clorexidina a 1,0% mostrou-se ineficiente contra a espécie "Pseudomonas aeruginosa".
O digluconato de clorexidina pode ser inativado por compostos aniônicos (PRADO et al., 2004) e não atua, significativamente, na neutralização do LPS bacteriano. A capacidade de neutralização do LPS do digluconato de clorexidina a 0,12%, do hipoclorito de sódio a 2,6% e do EDTA a 15% é semelhante à da água destilada e deionizada (BUCK et al., 2001).
Até mesmo o digluconato de clorexidina a 2,0% não é capaz de neutralizar o LPS bacteriano assim como o hipoclorito de sódio a 1,0; 2,5 e a 5,25%. Em contraste, tanto o hidróxido de cálcio a 0,14% em solução aquosa como na formulação Calen®, quanto a Polimixina B (10000 "unidades" / mL) são eficazes em neutralizar o LPS bacteriano. As soluções foram utilizadas durante a instrumentação em uma única sessão (OLIVEIRA et al., 2006; TANOMARU et al., 2003).
Prado et al., em 2004, relataram que o digluconato de clorexidina causa irritação tecidual, assim como o retardamento do processo de cicatrização e FARIA et al., em 2007, chamaram a atenção para o fato de que o digluconato de clorexidina, em concentrações iguais e maiores que 0,25%, apresenta ação citotóxica e promove necrose tecidual.
O digluconato de clorexidina não soma propriedades que o torne efetivo para o emprego como única medicação intracanal entre sessões ou, até mesmo, como solução irrigante principal ou de primeira escolha pelo fato de (1) ter uma ação menos efetiva contra bactérias Gram negativas em comparação com a atividade que exerce contra as bactérias Gram positivas; as bactérias do gênero "Enterococcus", as quais são susceptíveis ao digluconato de clorexidina, são freqüentes em dentes com lesões periapicais crônicas associadas à necrose pulpar ou obturações endodônticas fracassadas, no entanto, elas são raramente encontradas em infecções endodônticas não disseminadas que possuem uma comunidade polimicrobiana composta, predominantemente, por bactérias Gram negativas anaeróbias e (2) o digluconato de clorexidina não possui ação solvente sobre restos teciduais necróticos (SUNDQVIST, 1994; NAENNI et al. 2004; ZEHNDER, 2006; ZAMANI et al. 2003).
1.5 A Associação do
Hidróxido de Cálcio com o Digluconato de Clorexidina
Uma vez que tanto o hidróxido de cálcio quanto o digluconato de clorexidina não reúnem atributos que os possibilitem dar cabo da infecção endodôntica quando empregados isoladamente como medicação intracanal entre sessões, é natural que se busquem maneiras de se contemplarem os objetivos do tratamento endodôntico, com ênfase na ação antimicrobiana com a aspiração de prover resolutividade com níveis de excelência. Observa-se que as capacidades antimicrobianas do hidróxido de cálcio e do digluconato de clorexidina são complementares, assim como as demais propriedades (as virtudes de um complementam as deficiências do outro). Por esse motivo, a associação dessas duas substâncias na manipulação da medicação intracanal de uso entre sessões é instigadora e parece plausível que um efeito antimicrobiano aditivo ou sinérgico possa resultar dessa associação (EVANS et al., 2003). De fato, a combinação do hidróxido de cálcio com o digluconato de clorexidina na manipulação de medicações intracanais de uso entre sessões vendo sendo, desde há pouco, amplamente analisada e defendida, principalmente, em casos de periodontites apicais persistentes associadas a necroses pulpares ou a obturações endodônticas fracassadas, mesmo com a limitada disponibilidade de informações a respeito dessa associação (HAENNI et al., 2003; ERCAN et al., 2007). Segundo Zerella et al. (2005), a combinação do hidróxido de cálcio com a clorexidina a 2,0% é, pelo menos, tão eficaz quanto o hidróxido de cálcio veiculado em água deionizada estéril com relação à desinfecção ("in vivo") da dentina do canal radicular de dentes com obturação endodôntica fracassada. Os autores relataram que, de fato, a combinação dos dois princípios ativos apresentou melhores resultados, no entanto, a amostra reduzida levou à diferença estatística não-significante entre os dois grupos.
Com relação à elevação dos níveis de pH do meio, a combinação não altera a capacidade do hidróxido de cálcio em dissociar-se em íons hidroxila não reduzindo a capacidade de elevar o pH. Observa-se que a adição de digluconato de clorexidina 0,5% não interfere nessa propriedade (ZERELLA et al., 2005), assim como a adição de IPI (I2 + KI) a 5,0% e hipoclorito de sódio a 1,0%. Ressalta-se que o digluconato de clorexidina 0,5% e o IPI são soluções aquosas que também podem atuar como veículo ou aglutinante para o hidróxido de cálcio. O IPI é manipulado com a associação do iodo (I2) com o iodeto de potássio (KI) em água destilada (85%) que resulta em uma solução com quantidade total de iodo de 130 mg/mL e recebe o nome fantasia de Lugol. O iodeto de potássio torna o iodo solúvel em água (HAENNI et al., 2003). A solução de digluconato de clorexidina a 0,2% quando utilizada como veículo para o hidróxido de cálcio provê, a semelhança da xilocaína, os maiores níveis de pH quando comparado com a solução fisiológica estéril, glicerina, Citanest com Octapressina, e Ultracaína DS (YÜCEL et al., 2007) em valores próximos do hidróxido de cálcio puro. Como o digluconato de clorexidina não altera o pH da medicação com hidróxido de cálcio, presume-se que a sua ação antimicrobiana permaneça inalterada (BASRANI et al., 2004). Em pH elevado, a maior proporção de moléculas de clorexidina encontra-se não ionizada, pois há uma relação inversa entre a dissociação da clorexidina e o pH do meio (ZERELLA et al., 2005).
Não há diferença na radiopacidade nem no tempo de trabalho das medicações intracanais de hidróxido de cálcio com ou sem digluconato de clorexidina de 0,2 a 2,0%. As pastas de hidróxido de cálcio com ou sem digluconato de clorexidina apresentam um caráter reológico pseudoplástico. A combinação do hidróxido de cálcio com o digluconato de clorexidina eleva a viscosidade da medicação intracanal transformando-a em um fluido com um leve caráter não-newtoniano. A elevação da viscosidade e o caráter não-newtoniano poderiam provocar problemas no modo de inserção da medicação dentro do canal radicular quando a sistemática utilizada envolver a injeção através de cânulas ou agulhas (BASRANI et al., 2004).
Um
material pseudoplástico é aquele no qual a viscosidade diminui com o aumento da
freqüência de cisalhamento. A pseudoplasticidade de um fluido pode ser
apreciada pela maneira na qual a agitação de um tubo de ketchup causa a redução
da sua viscosidade.
Um
fluido não-newtoniano é um fluido cuja viscosidade varia de acordo com o grau
de deformação aplicado. Como conseqüência, fluidos não newtonianos podem não
ter uma viscosidade bem definida.
Com relação à capacidade de umectação da medicação intracanal na superfície dentinária, a combinação entre o hidróxido de cálcio e o digluconato de clorexidina, mesmo em concentrações menores, apresenta uma capacidade de molhamento superior às medicações intracanais com hidróxido de cálcio veiculado em água. A maior capacidade de umectação aumenta a superfície de contato da medicação com a parede dentinária do canal radicular e eleva a possibilidade de penetração nos túbulos dentinários e sistemas de canais radiculares. Pode-se presumir que tal comportamento tenda a elevar o potencial anti-séptico da medicação intracanal (BASRANI et al., 2004).
Com relação à ação antimicrobiana, a utilização de medicação intracanal manipulada com a associação do digluconato de clorexidina 0,5% com o hidróxido de cálcio não influenciou a ação do hidróxido de cálcio contra o "Enterococcus faecalis" e a "Candida albicans", mas reduziu, levemente, a ação do digluconato de clorexidina contra os mesmos microrganismos. O hidróxido de cálcio veiculado em gel de digluconato de clorexidina a 2% possui ação antimicrobiana menos efetiva que a do gel de digluconato de clorexidina a 2% isolado em pH 7 (HAENNI et al., 2003; GOMES et al., 2006; BALLAL et al., 2007). Essa redução deve-se, provavelmente, à precipitação da clorexidina causada pelos níveis elevados de pH gerados pelo hidróxido de cálcio em meio aquoso. No entanto, a pasta de hidróxido de cálcio em gel de digluconato de clorexidina age à distância e de maneira mais eficiente que a pasta de hidróxido de cálcio em água esterilizada. A pasta de hidróxido de cálcio em água mostra ação somente pelo contato direto sendo desprovida da capacidade de difusão no ágar. A baixa solubilidade do hidróxido de cálcio, a coagulação protéica e a ação tampão que ocorrem devido ao pH elevado impedem a difusão no ágar. É importante refletir que esses efeitos também podem ocorrer nos compartimentos endodônticos e periodonto apical por se tratarem de (1) ambientes aquosos (2) repletos de proteínas e (3) com mecanismos homeostáticos de ação tampão. O veículo gel utilizado com o digluconato de clorexidina foi o Natrosol ("hydroxyethil cellulose") a 1% (Gomes et al., 2006). A medicação intracanal manipulada com hidróxido de cálcio e clorexidina a 2,0 % foi extremamente mais eficaz que a pasta de hidróxido de cálcio em água estéril contra "Enterococcus faecalis" artificialmente semeados no interior dos túbulos dentinários de dentes bovinos mostrando que a clorexidina contida na pasta de hidróxido de cálcio mantém-se capaz de penetrar e atuar no interior dos túbulos dentinários (EVANS et al., 2003). No entanto, a associação entre hidróxido de cálcio e digluconato de clorexidina a 2,0 % pode se mostrar tão ineficiente quanto aquelas pastas de hidróxido de cálcio em água destilada ou solução fisiológica em reduzir totalmente a quantidade de microrganismos remanescente do preparo químico-mecânico do canal radicular quando aplicadas por um período de, apenas, uma semana (VIANNA et al., 2007; MANZUR et al., 2007). A ação antimicrobiana da clorexidina continua ativa após hidrólise pelo aquecimento em autoclave em pH elevado (JAMINET et al., 1968). HAENNI et al., em 2003, discutiram que o digluconato de clorexidina a 0,5% provavelmente precipita-se na presença de hidróxido de cálcio, mas mantém a ação antimicrobiana contra "Candida albicans".
Com relação ao efeito residual, a associação entre digluconato de clorexidina a 2,0% e o hidróxido de cálcio exibiu elevação da atividade antimicrobiana residual. Ou seja, mesmo depois de 21 dias de utilização no interior de canais radiculares de dentes pré-molares de cães, a combinação foi mais eficiente que o Calen, o Calen adicionado de PMCC e pasta de hidróxido de cálcio em solução anestésica. Salienta-se que, diferentemente do PMCC, a solução de digluconato de clorexidina a 2,0% ampliou, significativamente, a atividade antibacteriana residual do hidróxido de cálcio. Observou-se que não houve alteração da conservação nem da ação antimicrobiana da clorexidina após ter sido hidrolisada pela elevação da temperatura em pH elevado (JAMINET et al., 1968; SOARES et al., 2007; BASRANI et al., 2002).
Em se tratando da capacidade de neutralização do lipopolissacarídios ou LPS bacteriano, a medicação intracanal manipulada com hidróxido de cálcio e digluconato de clorexidina gel a 2,0% (gel de Natrosol "hydroxyethyl cellulose" a 1,0%, pH 7,0) é capaz de neutralizar o LPS bacteriano de maneira similar ou levemente superior à pasta de hidróxido de cálcio convencional agindo da mesma forma com relação à ação antimicrobiana. No entanto, não se tem notado uma ação sinérgica significativa da associação com relação à capacidade desintoxicante em um período de aplicação de, apenas, uma semana (VIANNA et al., 2007).
Com relação às manifestações clínicas do pós-operatório de dentes com periapicopatias persistentes correlacionadas com obturações endodôntica fracassada, com ou sem quadro clínico de dor no pré-operatório, a aplicação de medicação intracanal com hidróxido de cálcio e digluconato de clorexidina em tratamentos realizados em duas sessões reduziu significativamente a ocorrência de "flare-ups" e de sensibilidade dolorosa em comparação com os tratamentos realizadas em apenas uma única sessão sem a aplicação de medicação intracanal (YOLDAS et al., 2004).
Com relação à taxa de sucesso terapêutico, a medicação intracanal manipulada com Calen e digluconato de clorexidina (concentração na pasta de 1,0%) aplicada entre sessão por um período de 15 dias em dentes de cães com periapicopatia crônica associada à necrose pulpar foi mais eficaz. Houve redução das lesões periapicais após 120 dias do tratamento. O rendimento foi mais significativo que os obtidos nos tratamentos executados em apenas uma seção sem medicação intracanal. Nos retratamentos, a utilização da medicação intracanal manipulada com hidróxido de cálcio e digluconato de clorexidina a 1,0% aplicada por um período superior a 6 semanas em dentes com periapicopatias crônicas correlacionadas com obturações endodônticas fracassadas gerou 78% de resolutividade sendo que, em 64% dos casos, houve reparação tecidual total e, em 14%, parcial. Tais resultados mostram a efetividade clínica da associação (DE ROSSI et al., 2005; ERCAN et al., 2007).
1.6 A Toxicologia
da Associação
Compilando os aspectos até aqui relatados, observa-se que não há evidências de cunho endodôntico específico que contra indiquem a associação entre o hidróxido de cálcio e o digluconato de clorexidina nas medicações intracanais de aplicação entre sessões na terapêutica endodôntica com indicações prioritárias para os casos de lesões periapicais associadas às necroses pulpares ou obturações endodônticas fracassadas. Ao contrário, as evidências, recentemente publicadas, com relação às virtudes da associação, tais como, (1) propriedade anti-séptica, (2) capacidade de neutralização do LPS, (3) substantividade e efeito residual, (4) elevada capacidade de umectação, (4) propriedade de elevar o pH do meio, (5) capacidade de difusão no interior dos canalículos dentinários e (6) eficiência contra o "Enterococcus faecalis" e "Candida albicans" apontam para a ampliação do emprego como, também, das investigações a respeito dessa combinação.
No caso da associação entre o hipoclorito de sódio (NaOCl) e o digluconato de clorexidina, há evidências que contra-indiquem essa combinação. Tem sido observado que esta associação causa floculação gerando um precipitado de cor marrom avermelhada em diferentes combinações de concentrações de ambas as substâncias até mesmo nas concentrações mais reduzidas (MARCHESAN et al., 2007; BASRANI et al., 2007).
A floculação é a ação pela qual pequenas partículas existentes numa fase dispersa de um
sistema coloidal, sob certas condições, se juntam formando um precipitado que
pode, eventualmente, flutuar num líqüido.
Em análise
espectrofotométrica, foi observada a presença de cálcio, ferro, magnésio, cobre, zinco e manganês no precipitado. Constatou-se, ainda,
que o ácido acético, em baixas concentrações (vinagre comum) não removia a cor
marrom da solução evidenciando a persistência de substâncias corantes e o risco
para a descoloração dental (MARCHESAN et al., 2007).
Determinou-se, por meio de espectrometria de massas, que a solução resultante da associação entre o hipoclorito de sódio (NaOCl), substância esta de pH elevado, e o digluconato de clorexidina a 2,0% continha para-cloroanilina em quantidades proporcionais à concentração do hipoclorito de sódio (BASRANI et al., 2007).
A para-cloroanilina é um dos subprodutos gerados pela hidrólise da clorexidina em função do tempo, do pH e do aquecimento. A para-cloroanilina é uma amina aromática que tem se mostrado tóxica para humanos provocando hemólise, metahemoglobinemia e cianose. A cianose desencadeia patologias secundárias, principalmente em fetos e neonatos. Estudos toxicológicos em camundongos e ratos têm evidenciado que o sistema hematopoiético é o grande alvo dessa substância com evidências de formação de metahemoglobina acompanhada de anemia hemolítica, hematopoiese extramedular e esplenomegalia. Foi observada ação carcinogênica pela elevação na prevalência de carcinomas hepáticos, sarcomas e hemangiosarcomas no baço. Estudos em peixes Zebra evidenciaram que a para-cloroanilina produzia atraso na eclosão dos ovos e efeitos teratogênicos. Também tem sido reportada severa metahemoglobinemia em neonatos humanos expostos à para-cloroanilina produzida pela degradação de produtos contendo clorexidina pelo calor gerado nas incubadoras (JAMINET et al., 1968; BASRANI et al., 2007).
A
Metahemoglobinemia, também conhecida por "Meta-Hb", é uma desordem
caracterizada pela presença de um nível mais alto do que o normal de
metahemoglobina no sangue. A metahemoglobina é uma forma de hemoglobina que não
se liga ao oxigênio. Quando sua concentração é elevada nas hemácias pode
ocorrer uma anemia funcional e hipóxia dos tecidos. Normalmente, os níveis de
metahemoglobina são menores que 1%, quando medido pelo teste de Co-oximetria.
Níveis elevados de metahemoglobina no sangue são causados quando os mecanismos
que protegem contra o stress oxidativo no interior das hemácias são desarmados
e ocorre a conversão da hemoglobina em metahemoglobina. A formação espontânea
da metahemoglobina é normalmente neutralizada por sistemas de proteção
enzimática. Esse processo patológico pode ser desencadeado por deficiências
enzimáticas congênitas ou pela presença de algumas substâncias tóxicas como a
para-cloroanilina. Uma das manifestações clínicas da metahemoglobinemia é o
aparecimento da cianose e a ocorrência em estágio fetal pode ter efeito teratogênico.
Outro
aspecto, talvez o que gere maiores receios e preocupações, é o fato da para-cloroanilina pertencer ao Grupo 2B da IARC, "International Agency for
Research on Cancer" formado por substâncias que possivelmente possuem ação
carcinogênica em humanos (IARC, 1997b).
Levando-se
em consideração os achados de Haenni et al. (2003), Basrani et al. (2007), Marchesan et al. (2007), Jaminet et al. (1968),
Gomes et al. (2006) e as informações contidas nas monografias da IARC (1997), reitera-se que (1) o gel de
digluconato de clorexidina a 2% isolado em pH neutro possui maior ação
anti-séptica que a medicação intracanal contendo hidróxido de cálcio veiculado
no mesmo gel de digluconato de clorexidina a 2%; (2) que os mesmos autores
deduziram que esta redução deveu-se, provavelmente, à precipitação da
clorexidina causada pelos níveis elevados de pH gerados pelo hidróxido de
cálcio em meio aquoso; (3) que a clorexidina, mesmo depois de hidrolisada,
continua possuindo ação anti-séptica e residual; (4) que a precipitação da
clorexidina ocorre na presença de hipoclorito de sódio, substância de pH
elevado; (5) que se evidenciou a presença de para-cloroanilina na solução resultante da mistura da clorexidina
com o hipoclorito de sódio; (6) que a para-cloroanilina
pode causar Metahemoglobinemia em humanos; (7) que a para-cloroanilina pertence ao Grupo
2B da IARC formado por substâncias que possivelmente possuem ação carcinogênica
em humanos; (8) que a clorexidina degrada-se por hidrólise em para-cloroanilina e (9) que a hidrólise
pode ser exacerbada em pH elevado, formulam-se as hipóteses de que (a) o
digluconato de clorexidina possa estar sendo hidrolisado em pH elevado
provocado pelos íons hidroxila gerados na dissociação, em meio aquoso, do
hidróxido do cálcio; (b) que a hidrólise possa ser parcial ou total; (c) que
deva estar se formando subprodutos da hidrólise da clorexidina e (d) que um
desses subprodutos possa ser a para-cloroanilina.
Considerando-se que a aplicação de uma terapêutica é
justificável quando os malefícios da doença são maiores que os riscos ou
efeitos danosos do tratamento, faz-se premente a investigação química das
medicações intracanais manipuladas com hidróxido de cálcio e digluconato de
clorexidina com o objetivo de entender melhor os possíveis efeitos adversos da
sua presença nas adjacências do periodonto apical.
Nos últimos anos, inúmeros estudos têm sido dedicados ao entendimento dos mecanismos correlacionados com as causas do fracasso terapêutico na Endodontia. Diversas estratégias vêm sendo propostas e investigadas com o objetivo de elevar a taxa de sucesso clínico e a previsibilidade do tratamento dos canais radiculares. Segue, logo abaixo, um retrospecto da literatura que campea por aspectos microbiológicos, terapêuticos e toxicológicos correlacionados à infecção endodôntica bem como seu controle com enfoque nas medicações intracanais, hidróxido de cálcio e digluconato de clorexidina.
2.1 Da Infecção
Endodôntica
Leonardo et al. (2002), utilizando SEM ("Scanning Electon Microscope"), avaliaram a presença de (1) microrganismos, (2) reabsorção cementária e (3) biofilme, ambos na superfície apical externa da raiz de dentes com (a) polpa vital, (b) polpa necrosada sem lesão periapical; e (c) polpa necrosada com lesão periapical. Os autores observaram ausência de microrganismos na superfície radicular externa em (a') dentes com polpa viva e (b') com polpa necrosada sem lesão periapical. No entanto, os microorganismos associados ou não em biofilme e as reabsorções cementárias estavam presentes em todos os (c') dentes com necrose pulpar e lesão periapical radiograficamente visível (cocos, bacilos, filamentosos e biofilme apical). Os autores ressaltaram que o biofilme apical é clinicamente importante porque os microrganismos assim organizados possuem uma resistência contra agentes antimicrobianos inerente a essa condição. Os microrganismos organizados em biofilme não podem ser removidos somente pelo preparo biomecânico podendo causar o fracasso do tratamento endodôntico pela persistência da infecção.
Waltimo et al. (2003) investigaram as evidências contidas na literatura a respeito da participação dos fungos nas periodontites apicais. Os autores observaram que os fungos podem ser isolados em 5 a 20% dos casos com infecção endodôntica. Eles ocorrem isoladamente ou com bactérias. A maioria dos fungos isolados pertence ao gênero "Candida" e a espécie predominante é a "Candida albicans". As espécies isoladas no canal radicular apresentam heterogenicidade geno e fenotípica quando comparados aos presentes na cavidade bucal. Os autores enfatizam os fatores de virulência da "Candida albicans" como a capacidade (I) de sobreviver em ambientes com privação de nutrientes; (II) infectar o sistema de canais radiculares incluindo os túbulos dentinários causando resposta inflamatória no periodonto apical sugerindo um papel patológico nas periodontites apicais. Os fungos estão particularmente associados às infecções endodônticas persistentes que não respondem favoravelmente à terapia convencional, sinalizando para a importância da resistência ao hidróxido de cálcio. Os autores listam alguns fatores inibidores da ação de anti-sépticos como os componentes orgânicos da dentina e exsudato, a barreira física oferecida pelo "smear layer" e biofilme, a elevação da resistência dos agentes etiológicos organizados em biofilme fúngico mono ou polimicrobiano e o fator de diluição de anti-sépticos exercido pelo exsudato. Os autores chamam a atenção para o fato da "Candida albicans" organizada em biofilme mostrar resistência tanto ao hipoclorito de sódio quanto ao digluconato de clorexidina que são muito eficientes contra esse fungo em estado planctônico.
Svensäter e Bergenholtz (2004) realizaram uma revisão da literatura enfocando a infecção endodôntica. Os autores ressaltam que os microrganismos organizados em biofilme estão mais protegidos tanto das defesas do hospedeiro como da ação dos anti-sépticos por serem mais virulentos que aqueles em estado planctônico. O biofilme ocorre na superfície radicular apical externa e evidências apontam para sua existência na parede do sistema canais radiculares. O aumento da virulência se deve a alterações na fisiologia, fenotipagem e metabolismo microbiano devido à organização em biofilme. Desta forma, microrganismos que normalmente estabelecem relação harmônica comensal com o hospedeiro passam para uma relação desarmônica de parasitismo. Assim, a infecção endodôntica não é causada por microrganismos classicamente patogênicos como, por exemplo, o "Clostridium tetani" causador do Tétano, mas, sim, é resultante de um desequilíbrio no ambiente manifestado pelo aumento populacional e organização em biofilme de microrganismos que não são classicamente patogênicos. O autores afirmam que há uma necessidade de se revisar a estimativa da ação dos anti-sépticos analisados em métodos de cultura convencionais com microrganismos não organizados em biofilme.
Waltimo et al. (2004), por meio de uma revisão da literatura, reaveram os aspectos clínicos correlacionados com a infecção endodôntica por fungos com enfoque nos casos de necrose pulpar associados à periodontites apicais primárias e secundárias. Os autores observaram que a "Candida albicans" é o fungo mais freqüentemente encontrado nas infecções endodônticas seguida de outros fungos do gênero "Candida". Geralmente eles ocorrem em pequeno número compondo a comunidade infectante. Não está comprovado se os fungos conseguem se desenvolver nas estruturas do periodonto apical bem como na superfície apical radicular externa. Há evidências de cooperação entre fungos e bactérias Gram positivas ("Streptococcus gordonii", "Streptococcus mutans", "Streptococcus sanguis") no desenvolvimento do biofilme facilitando sua formação o que é um agravo terapêutico. Os fungos são resistentes a pH elevados e há evidências de que possuem resistência ao hidróxido de cálcio, mas sua erradicação não chega a ser um problema uma vez que são sensíveis ao hipoclorito de sódio e ao digluconato de clorexidina. Os autores discutiram o fato do efeito antimicrobiano do hidróxido de cálcio estar correlacionado com seu pH elevado como, também, ao tamponamento alcalino, ou seja, à capacidade de impor uma resistência às variações da concentração tanto do íon hidrogênio quando do íon hidroxila mantendo o pH constante em níveis elevados. Portanto, o hidróxido de cálcio não é efetivo contra microrganismos alcalino resistentes como é o caso da "Cândida albicans", a não ser que estejam em contato direto. Os autores chamaram a atenção para alguns relatos científicos que indicam que a "Candida albicans" tem se mostrado até mais resistente que o "Enterococcus faecalis", ícone da resistência clínica e laboratorial ao hidróxido de cálcio. Ressalta-se, ainda, a capacidade da "Candida albicans" em penetrar (até dois milímetros) e desenvolver-se no interior dos canalículos dentinário, mas de maneira menos efetiva que o "Enterococcus faecalis". A penetração se dá por células fúngicas ovóides e germinais como, também, por hifas o que também confere retenção importante no estabelecimento do biofilme polimicrobiano.
Nair et al. (2005), empregando TEM ("Transmission Electron Microscopy"), verificaram os aspectos da infecção endodôntica no sistema de canais radiculares apicais de raízes mesiais de primeiros molares inferiores humanos com periodontites apicais primárias correlacionadas à necrose pulpar imediatamente após o tratamento endodôntico realizado em uma única sessão. O canal mésio-vestibular foi submetido a instrumentos manuais de aço e o mésio-lingual, a instrumentos rotatórios de níquel-titânio. A irrigação foi realizada com hipoclorito de sódio a 5,25% seguida de irrigação com 10 mL de EDTA a 17%. Os canais foram obturados com guta-percha e cimento à base de óxido de zinco e eugenol. Em seguida, os ápices radiculares foram removidos para análise microscópica. Dos 16 dentes, em 14 deles foram identificadas infecções remanescentes da terapia endodôntica. Os microrganismos acumulavam-se, na maioria, organizados em biofilme, em áreas inacessadas do canal principal pelo preparo químico-mecânico como reentrâncias, divertículos, istmos entre canais e canais acessórios. Os autores concluíram que devido (1) à complexidade da anatomia interna do sistema de canais radiculares apicais das raízes mesiais dos primeiros molares inferiores e (2) a organização da comunidade microbiana em biofilme em áreas inacessíveis, não é possível remover a infecção através dos meios à disposição atualmente somente pelo preparo biomecânico em uma única sessão. Os autores ressaltaram a importância da utilização criteriosa de todos os meios químicos (não-antibióticos) e mecânicos no tratamento de dentes com gangrena pulpar (infecção endodôntica) com o objetivo de desagregar o biofilme e reduzir a carga microbiana para a menor possível e, assim, obter um prognóstico favorável de longo prazo para o tratamento endodôntico.
Stuart et al. (2006), por meio de uma revisão de literatura, (a) formularam um perfil do "Enterococcus faecalis"; (b) citaram pesquisas que implicam o "Enterococcus faecalis" como principal agente etiológico dos insucessos endodônticos; (c) listaram os mecanismos que permitem ao "Enterococcus faecalis" sobreviver e causar periapicopatias persistentes; e (d) discutiram estratégias para eliminar o "Enterococcus faecalis" do sistema de canais radiculares. O "Enterococcus faecalis" apresenta relativa prevalência em casos com diagnóstico de necrose pulpar e elevada prevalência em diagnóstico de fracasso terapêutico associado à periapicopatia, principalmente, com ausência de sintomatologia. O "Enterococcus faecalis" está correlacionado a uma série de patologias sistêmicas importantes o que indica a priorização do retratamento desses casos. O "Enterococcus faecalis" exibe grande resistência imunológica e quimioterápica, pode transferi-las a outros microrganismos, principalmente quando organizado em biofilme; com freqüência, é o único ou o mais predominante de um número reduzido de populações infectantes; apresenta resistência ao hidróxido de cálcio; é susceptível ao digluconato de clorexidina a 2% e ao hipoclorito de sódio a 6% ou a 3% utilizado copiosamente e renovado com grande freqüência. Citam-se, como fatores de virulência do "Enterococcus faecalis", os seguintes: suporta privação nutricional; adere-se à dentina; invade túbulos dentinários; altera a resposta imune do hospedeiro inibindo a ação dos linfócitos; sintetiza "lytic enzymes", "cytolysin", "aggregation substance", feromônios, e ácido lipoteicóico; utiliza o líqüido tissular como fonte nutricional; resiste a medicações intracanais contendo hidróxido de cálcio por possuir um mecanismo homeostático relacionado ao pH e ser auxiliado pela ação degradativa da dentina sobre o hidróxido de cálcio; compete de maneira efetiva com outras bactérias e organiza-se em biofilme. Devido à grande resistência (imunológica e quimioterápica) do "Enterococcus faecalis", torna-se imperativo implementar, na terapêutica endodôntica, estratégias para prevenir, reduzir e/ou erradicá-lo do canal dental, tais como: anti-sepsia pré-operatória por meio de bochecho com solução contendo digluconato de clorexidina a 0,12%, pré-desinfecção do dente, grampo operatório e lençol de borracha, preparo químico-mecânico adequado com ênfase na ampliação do terço apical e irrigação com hipoclorito de sódio a 6%, EDTA a 17%, digluconato de clorexidina a 2%; medicação intracanal com gel de digluconato de clorexidina a 2% ou pasta de hidróxido de cálcio em gel de digluconato de clorexidina a 2%; obturação hermética com desinfecção prévia dos cones de guta-percha com hipoclorito de sódio, utilização de cimento de Grossman ou AH Plus® e restauração coronária com vedação hermética.
Schirrmeister et al. (2007) utilizaram o cultivo de microrganismos e o seqüenciamento genético com amplificação por meio de PCR ("Polymerase Chain Reaction") com o objetivo de determinar a presença de microrganismos em amostras microbianas colhidas durante o retratamento endodôntico de dentes associados a lesões periapicais com ênfase no "Enterococcus faecalis". A prevalência de infecção foi de 60 (cultura) a 65% (PCR) e o "Enterococcus faecalis" estava presente em 31% das amostras. A irrigação padrão com hipoclorito de sódio a 2,5% associada ao EDTA a 17% (5 mL por 1 minuto) resultou em amostras com ausência de microrganismos (meio de culturas e PCR). Devido ao sucesso da irrigação durante o preparo biomecânico, tanto a irrigação com digluconato de clorexidina (10 mL) como a medicação intracanal com hidróxido de cálcio (em água) não puderam melhorar a anti-sepsia dos canais radiculares. Os autores observaram re-contaminação em dois casos após a aplicação da medicação intracanal entre sessões ressaltando que o intervalo entre as consultas pode recontaminar o canal dental mesmo repleto de pasta contendo hidróxido de cálcio.
2.2 Do Hidróxido de
Cálcio
Estrela
et al. (1995), em uma brilhante revisão da literatura, discutiram os mecanismos
da ação do hidróxido de cálcio no tratamento das infecções endodônticas. Os
autores ressaltaram que o efeito do hidróxido de cálcio está ligado à elevação
do pH resultante da dissociação, em meio aquoso, em íons hidroxila e íons
cálcio. O hidróxido de cálcio atua na ativação de enzimas teciduais do
hospedeiro como a fosfatase alcalina que participa da recuperação dos tecidos
mineralizados afetados pela infecção endodôntica. Nas bactérias, age alterando
a integridade de sítios essenciais promovendo a inativação de enzimas da
membrana citoplasmática interferindo, desta forma, em processos metabólicos,
homeostáticos, crescimento e divisão celular. As ações do hidróxido de cálcio
ocorrem, portanto, em duas frentes, (1) biológica, favorecendo os mecanismos de
defesa e a reparação dos tecidos afetados do hospedeiro, como, também, (2)
bacteriológica, por meio da ação antimicrobiana. Tais ações terapêuticas dão ao
hidróxido de cálcio um lugar de destaque entre os princípios ativos das
medicações intracanais, no entanto, apesar da particular eficiência na ação por
contato direto no canal principal, sua influência no pH do interior dos túbulos
dentinários e na região do cemento não é tão significativa caracterizando uma
deficiência.
Fava e
Saunders (1999) realizaram uma ampla revisão da literatura extremamente
completa e detalhada a respeito das medicações intracanais contendo hidróxido
de cálcio relacionando informações sobre os diferentes veículos utilizados, bem
como, aditivos com ação terapêutica e de melhoria das propriedades
físico-químicas, formulações sugeridas pela literatura, produtos comerciais e
avaliações científicas de suas propriedades. Ressaltaram-se as características
necessárias a essas pastas medicamentosas como (1) serem compostas
principalmente por hidróxido de cálcio o qual pode estar associado com outras
substâncias com a finalidade de melhorar propriedades físico-químicas como
radiopacidade, fluidez e consistência; (2) não solidificar, tomar presa ou
endurecer dentro dos canais radiculares; (3) poder se solubilizar ou ser
reabsorvida nos tecidos vitais vagarosa ou rapidamente dependendo do veículo ou
aglutinante e outros componentes; (4) poder ser preparada no momento da
consulta ou adquirida comercialmente; (5) ser empregada no interior do sistema
de canais radiculares somente como medicação intracanal temporária e não como
material obturador definitivo. Os autores destacam que a adição de outros
produtos deve ser realizada com a finalidade de (a) manter a consistência de
pasta e não permitir o endurecimento, presa ou solidificação, (b) melhorar a
fluidez, (c) manter o pH elevado, (d) melhorar a radiopacidade, (e) fazer com
que a utilização clínica seja facilitada e (f) não alterar as excelentes
propriedades biológicas do hidróxido de cálcio. Com relação ao veículo ou
aglutinante, os autores destacaram que (I) devem promover liberação gradual e
lenta do hidróxido de cálcio nos fluidos tissulares permitindo sua dissociação
em íons cálcio e hidroxila; (II) devem garantir a difusão lenta do hidróxido de
cálcio nos tecidos reduzindo sua solubilidade no líqüido tecidual; e (III) não
promover efeito adverso na indução e deposição de tecidos duros pelo organismo
do hospedeiro. Os autores ainda relataram que a primeira referência ao
hidróxido de cálcio na Odontologia deve ser atribuída a Nygren que, em 1838, o
utilizou no tratamento de fístulas correlacionadas às infecções dentais; que
Codman, em 1851, utilizou o hidróxido de cálcio na preservação do tecido
pulpar; que Maisto, em 1975, classificou as medicações intracanais contendo
hidróxido de cálcio como Pastas Alcalinas; e que Holland, em 1994, classificou
as pastas alcalinas de acordo com o veículo utilizado em pastas aquosas,
viscosos ou oleosos.
Estrela et al. (1999) aplicaram medicações intracanais contendo hidróxido de cálcio no canal principal por períodos de 0, 48 e 72 horas e 7 dias e estimaram a sua ação contra populações isoladas de "Streptococcus faecalis", "Staphylococcus aureus" "Bacillus subtilis" e "Pseudomonas aeruginosa" e contra a comunidade formada por populações dessas quatro espécies infiltradas em canalículos dentinários de incisivos centrais humanos extraídos. O hidróxido de cálcio veiculado em solução salina em consistência de pasta com pH = 12,6 aplicado por um período de até uma semana não mostrou qualquer efeito antimicrobiano contra populações ou comunidade de bactérias citadas locadas nos túbulo dentinários. Os autores discutiram que, provavelmente, o pH nos túbulos dentinários não atingiu ou se manteve em níveis insuficientes para promover uma desnaturação enzimática microbiana irreversível e, por esse motivo, não houve efeito anti-séptico no período de aplicação máximo avaliado. Eles ainda afirmaram que seriam necessários novos estudos para determinar o período ideal de manutenção do hidróxido de cálcio no canal radicular infectado correlacionado a lesão periapical.
Nelson-Filho et al. (2002) analisaram a capacidade do hidróxido de cálcio em neutralizar endotoxinas (LPS microbiano). Trabalhando em dentes de cães, realizavam a abertura coronária, remoção do tecido pulpar, ampliação do forame apical, aplicação de EDTA a 14,3% e desbridamento foraminal. Em seguida, preencheram o canal radicular com (1) LPS, (2) hidróxido de cálcio em suspensão misturado com LPS, (3) solução fisiológica e (4) amostras do meio bucal. Os dentes eram, então, selados e, após um período de 30 dias, avaliados radiograficamente. Utilizaram-se, como indicadores, a presença de espessamento periodontal, a integridade da lâmina dura, reabsorção radicular e reabsorções ósseas difusas e circunscritas. O LPS puro promoveu extensas lesões ósseas circunscritas com perda da lâmina dura; os dentes contaminados com amostras do meio bucal exibiram lesões difusas. A mistura do LPS com o hidróxido de cálcio promoveu apenas ligeiro espessamento periodontal não gerando lesões ósseas difusas ou circunscritas nem danos na lâmina dura. A solução salina exibiu em apenas um de 10 casos espessamento periodontal. A contaminação ao meio bucal promoveu extensas lesões difusas com destruição da lâmina dura. Os autores concluíram que o hidróxido de cálcio neutraliza eficientemente o LPS bacteriano e deve ser a substância de escolha para utilização como medicação intracanal entre sessões. Ressalta-se que houve contato direto entre o LPS e o hidróxido de cálcio.
Estrela e Holland (2003), imbuídos do espírito científico, realizaram um estudo baseado em evidências científicas no qual se discutiram as principais funções do hidróxido de cálcio na terapêutica odontológica com ênfase na manutenção dos princípios biológicos. Dentre as características terapêuticas do hidróxido de cálcio, destaca-se (1) a capacidade de induzir a formação de pontes mineralizadas de dentina sobre o tecido pulpar o que é conveniente nas proteções pulpares e pulpotomias, uma vez que, a dentina é considerada "o melhor protetor pulpar"; (2) a necessidade de prover tempo para o hidróxido de cálcio manifestar seu potencial antimicrobiano nas infecções endodônticas, pois a manutenção de altas concentrações de hidroxila e assim afetar a atividade enzimática das bactérias promovendo sua inativação; (3) o fato das enzimas afetadas pelo hidróxido de cálcio estarem situadas na membrana citoplasmática dos microrganismos e, por esse motivo, o hidróxido de cálcio apresenta largo espectro de ação, independentemente das capacidades metabólicas dos microrganismos, pois a membrana citoplasmática mantém características similares seja qual for a morfologia, a propriedade corante ou a via respiratória do microrganismo. Desta forma, o hidróxido de cálcio age nas bactérias de maneira similar em cocos, bacilos, filamentosos e espiralados; aeróbios e anaeróbios; Gram positivos e negativos; (4) a medicação intracanal em consistência de pasta contendo hidróxido de cálcio aplicada no período entre sessões age com mais eficiência na recuperação dos tecidos afetados do periodonto apical quando comparada ações terapêuticas aplicadas em uma única sessão. O hidróxido de cálcio também promove modificações no pH interno da bactéria influenciando os seguintes processos: metabolismo celular, alteração na forma, mobilidade, ajuste de transportadores, polimerização de componentes cito-esqueléticos; ativação do crescimento e proliferação celular; transporte através da membrana e volume celular.
Dotto, et al. (2006) empregando a metodologia de difusão de agentes antimicrobianos no ágar, "Enterococcus faecalis" como cepa padrão e quantificação radial de halos de inibição de crescimento bacteriano e de difusão no ágar, estimaram a ação antimicrobiana de algumas medicações intracanais. Somente a medicação intracanal manipulada com 'iodofórmio e propilenoglicol' não gerou halo de difusão. Apenas em duas das medicações testadas, aquelas formuladas com 'hidróxido de cálcio mais PMCC (para-monoclorofenol canforado) veiculados em propilenoglicol' e com 'iodofórmio veiculado em propilenoglicol', formaram-se halos de inibição. As demais medicações testadas foram incapazes de gerar halos de inibição ('hidróxido de cálcio veiculado em propilenoglicol', 'hidróxido de cálcio mais iodofórmio veiculado em propilenoglicol', 'hidróxido de cálcio veiculado em anestésico lidocaína com felipressina', 'Calen®' e 'Calen/PMCC®'). O hidróxido de cálcio como único princípio ativo não gerou halo de inibição. O iodofórmio, por sua vez, como único princípio ativo, gerou halo de inibição, mas perdeu essa capacidade quando misturado ao hidróxido de cálcio. O PMCC aparenta ser o responsável pela ação à distância (halo de inibição) das medicações contendo hidróxido de cálcio, exceto quando misturado ao Calen. Os autores concluíram que o hidróxido de cálcio foi ineficaz contra o "Enterococcus faecalis". Em contraste, o PMCC e o iodofórmio foram eficientes contra a espécie testada, apesar do PMCC não se mostrar efetivo na combinação com o Calen®. Há evidencias de que o hidróxido de cálcio interfira na ação do iodofórmio e que algum componente da pasta Calen® interfira na ação do PMCC.
Siqueira et al. (2007b) coletaram microrganismos de dentes de pacientes com diagnóstico de periodontite apical crônica associada à necrose pulpar (S1) antes e (S2) depois do preparo biomecânico utilizando hipoclorito de sódio a 2,5% como solução irrigante e (S3) após aplicação de medicação intracanal (hidróxido de cálcio em glicerina) entre sessões com 1 semana de intervalo para (1) semeadura em meio de cultura anaeróbia e (2) ampliação ("PCR - Polymerase Chain Reaction Assay"), seqüenciamento e identificação ("16S rRNA gene") taxonômica. Em S1, observou-se uma média de 300 mil CFUs ("Colony-Forming Units"); em S2, 54,5% de culturas negativas com redução de CFUs de 49 a 100%; e em S3, 81,8% das amostras resultaram em culturas negativas com redução de 96 a 100% de CFUs (com diferença estatística não significante entre S2 e S3, em contraste com as demais comparações duas a duas). Os autores concluíram que o protocolo clínico utilizado promoveu colheitas negativas, previamente à obturação, em 82 % dos casos o que sinaliza sua eficiência. No entanto, necessita-se de melhorias para se buscar uma taxa maior ou absoluta de colheitas negativas previamente à obturação endodôntica. Em adição, relata-se que foram encontrados de 1 a 6 espécies por canal em S1 sendo que os mais prevalentes foram os de gênero "Streptococcus" e as espécies "Fusobacterium nucleatum" e "Actinomyces israelii"; em S2, "Streptococcus", "Staphylococcus", "Neisseria sicca" e "Flavobacterium"; e em S3 "Fusobacterium nucleatum" (positivo em S1, mas negativo em S2) e "Lactococcus garvieae" (negativo em S1 e S2).
2.3 Do Digluconato
de Clorexidina
Jaminet et al. (1968), por meio de exames da densidade óptica de soluções, avaliaram a estabilidade da clorexidina a 0,02% frente a dois processos de esterilização em função de diferentes valores de pH, o qual foi manipulado por meio do ácido bórico e do bórax. Os jatos de vapor de água a 100ºC por 1 hora não degradaram nem produziram para-cloroanilina significativamente. A esterilização em autoclave possibilitou a hidrólise da clorexidina gerando para-cloroanilina em quantidade que foi tão maior quão mais elevado o valor do pH da solução (4,7; 6,3; 7,3; 8,4; e 9,0). A esterilização, em autoclave, da clorexidina, em pH original, produz discreta decomposição térmica com pequena produção de para-cloroanilina. Os autores observaram que a hidrólise da clorexidina provoca redução mínima na atividade antimicrobiana da solução e os subprodutos gerados não afetam a sua conservação. Os autores citaram, ainda, que a clorexidina é incompatível com inúmeras substâncias, ressaltando aquelas com caráter aniônico.
Winrow
(1973) estudou as vias metabólicas do digluconato de clorexidina em ratos,
camundongos, cães, sagüis, macacos (rhesus) e humanos por meio da clorexidina
marcada com carbono 14 inserido no anel aromático ou na cadeia alifática. A
leitura do digluconato de clorexidina marcado foi realizada por meio de
cintilação. Quando o digluconato de clorexidina foi administrado oralmente, a
maior parte foi excretada intacta nas fezes (90%), mas, uma pequena parte foi
excretada pela urina (10%). Após a administração de uma dose oral de
clorexidina em cães, os níveis sanguíneos detectados foram muito baixos o que
levou à conclusão de que a clorexidina é uma droga pobremente absorvida pelo organismo
quando ingerida. A pouca quantidade absorvida no trato digestivo é processada
no fígado e nos rins. A clorexidina tem afinidade pela mucosa do trato
digestivo incluindo a da boca, mas essa ligação à superfície da mucosa possui
natureza reversível. A freqüência de segmentação metabólica pela ingestão oral
também é muito baixa e não há evidências de formação de para-cloroanilina. No entanto, após administração intravenosa em
ratos, encontraram-se metabólicos polares da clorexidina e pequenas quantidades
de clorexidina intacta na bile o que sugere segmentação bioquímica do
digluconato de clorexidina. Os autores conseguiram reaver 90% do digluconato de
clorexidina presente no fígado de ratos evidenciando que não há ligações
covalentes estáveis do digluconato de clorexidina com proteínas. Os autores
também comprovaram a capacidade de adsorção do digluconato de clorexidina na
superfície das mucosas com liberação em função do tempo (substantividade).
Komorowski et al. (2000), utilizando meio de cultura líqüido e avaliação espectrofotométrica da turvação pelo desenvolvimento microbiano, avaliaram a substantividade e atividade anti-séptica residual do digluconato de clorexidina a 0,2% aplicada por períodos de 5 minutos e de 7 dias na dentina bovina. O indicador biológico utilizado foi o "Enterococcus faecalis". Os canais dentais foram processados à semelhança do que se pratica no preparo biomecânico com hipoclorito de sódio a 5,25% e EDTA a 17%. Em seguida, removeram-se os resíduos de solução e a dentina foi inundada com meio de cultura (BHI - "Brain Heart Infusion") para que ele penetrasse nos túbulos dentinários com a ajuda de ultra-som. Os canais foram então secos e preenchidos com a medicação a ser testada (solução de digluconato de clorexidina a 0,2%; hipoclorito de sódio a 5,25% e solução salina estéril). Após os períodos de tempo citados acima, os canais eram secos e preenchidos com a suspensão do indicador biológico em meio de cultura e incubados por 21 dias. Finalmente, amostras de dentina eram retiradas do canal e inoculadas em meio de cultura para encubação e análise da turvação. Constatou-se que somente o digluconato de clorexidina a 0,2% aplicado na dentina por sete dias foi eficaz em reduzir significativamente o crescimento do "Enterococcus faecalis" presentes nos túbulos dentinários. O hipoclorito de sódio a 5,25% e a solução salina estéril não exibiram substantividade nem efeito antimicrobiano residual. Os autores concluíram que o digluconato de clorexidina a 0,2% aplicado pelo período de uma semana deveria ser utilizado como medicação intracanal entre sessões. No entanto, os autores não omitiram o fato do digluconato de clorexidina em estado líqüido não se manter no interior dos canais radiculares. Os autores reiteraram que a clorexidina necessita de algo que a mantenha no canal pelo período desejado como, por exemplo, carreadores poliméricos que se dissolvam em contato com o meio líqüido liberando o princípio ativo em função do tempo.
Zamany e Spångberg (2002) avaliaram a capacidade de alguns compostos em inativar a clorexidina para melhorar a confiabilidade dos testes microbiológicos baseados em cultivo de microrganismos. A metodologia foi baseada em culturas microbianas nas quais os microrganismos coletados eram previamente expostos à mistura da clorexidina com o agente com potencial de inativação. O produto mais indicado para inativar a clorexidina foi o manipulado com a mistura de Tween 80 (polyoxyethylenesorbitan monooleate) a 3,0% com L-alfa-lecithin (L-alfa-phosphatidylcholine) a 0,3%. A importância clínica da neutralização da clorexidina encontra-se no fato de que, muitas vezes, coletam-se amostras de microrganismos contaminadas com agentes antimicrobianos de forma que a semeadura pode gera resultados falso-negativos, ou seja, de não crescimento devido à ação do anti-séptico no meio de cultura.
Basrani et al. (2002) examinaram a substantividade do digluconato de clorexidina em dentina humana contra o "Enterococcus faecalis" (indicador biológico). Os autores submeteram cada dente ao preparo biomecânico e, em seguida, à medicação intracanal aplicada por um período de uma semana. Findo esse período, a medicação foi removida e o indicador biológico em meio de cultura líqüido foi introduzido no canal e cultivado por 21 dias. Ao final, amostras de dentina foram retiradas da parede do canal e semeadas em meio de cultura líqüido para posterior análise do turvamento pela avaliação espectrofotométrica da densidade óptica. As medicações testadas foram as seguintes: (1) gel* de clorexidina a 2%, (2) gel de clorexidina a 0,2%, (3) solução aquosa de clorexidina a 2%, (4) gel de hidróxido de cálcio, (5) hidróxido de cálcio veiculado em gel de clorexidina a 0,2% e (6) solução de clorexidina a 2,0% veiculada por carreador polimérico. Os menores valores de turvamento foram exibidos pelas medicações contendo clorexidina a 2,0% sem haver diferença entre elas. Maiores valores de densidade óptica foram gerados pelas medicações contendo clorexidina a 0,2%. Na comparação entre os géis de hidróxido de cálcio com e sem clorexidina a 0,2%, a com clorexidina exibiu menor média de densidade óptica, embora não tenha havido diferença estatística significante entre elas. Os autores discutiram que a clorexidina é capaz de adsorver na superfície dentinária devido à carga positiva de sua molécula apresentando substantividade e efeito residual o que previne a colonização desta superfície por bactérias. A substantividade e o efeito residual antimicrobiano da clorexidina na dentina estão relacionados diretamente com a concentração e volume da medicação em contato com a superfície dentinária. A adição de clorexidina a 0,2% no gel de hidróxido de cálcio eleva, discretamente, a substantividade e o efeito antimicrobiano residual dessa medicação intracanal. Os autores concluíram que a medicação intracanal contendo somente clorexidina a 2,0% em qualquer dos veículos testados (água, gel ou carreador polimérico) aplicada por um período de uma semana pode promover atividade antimicrobiana residual contra "Enterococcus faecalis". Os autores não omitiram o fato de terem utilizado apenas um indicador biológico o que está em contraste com a natureza da infecção endodôntica que é, geralmente, polimicrobial.
Zamany et al., 2003 realizaram um estudo "in vivo" empregando dois protocolos terapêuticos nos quais, após o preparo químico-mecânico utilizando hipoclorito de sódio, utilizava-se uma irrigação final por 30 segundos com 4 mL de (1) solução salina ou de (2) clorexidina a 2,0%. O método de avaliação utilizava meios de cultura, nos quais os indicadores biológicos foram colhidos do próprio canal de dentes com necrose pulpar e lesão periapical visível radiograficamente. O protocolo utilizando clorexidina gerou cultura positiva em 1 de 12 casos apenas, contra 7 de 12 casos com solução salina. A introdução do digluconato de clorexidina a 2,0% na irrigação extra realizada imediatamente após o preparo biomecânico melhorou a eficiência da terapêutica endodôntica no que diz respeito à ação antimicrobiana. A irrigação extra após o preparo biomecânico mostra ter uma relevância clínica importante.
Rosenthal et al. (2004) com o objetivo de avaliar a substantividade da clorexidina no sistema de canais radiculares e quantificar a duração do efeito antimicrobiano residual após a obturação endodôntica, expuseram dentes bovinos à solução aquosa de digluconato de clorexidina a 2,0% por 10 minutos. Em seguida, os dentes foram obturados. Utilizando espectrofotometria, verificou-se a presença de digluconato de clorexidina no estrato de dentina raspado dos segmentos radiculares tratados após a remoção da obturação e armazenagem por períodos de 1 dia, 3, 6 e 12 semanas. Com a utilização de cultivo em meio de cultura, avaliou-se a ação antimicrobiana frente ao "Enterococcus faecalis". Detectou-se, no estrato de dentina, digluconato de clorexidina a 0,0048% (1 dia); 0,0023% (3 semanas); 0,0016% (6 semanas) e 0,0010% (12 semanas) e a ação antimicrobiana foi inversamente proporcional ao período de armazenamento. Os autores relataram que o digluconato de clorexidina permanece na dentina do canal radicular com eficiência antimicrobiana por mais de 12 semanas e, apesar do hipoclorito de sódio ser ainda considerado a solução de escolha, a utilização do digluconato de clorexidina pode ser vantajosa em casos com infecção primária e, ainda mais importante, nos retratamentos. O digluconato de clorexidina pode ser aplicado alternadamente durante o preparo químico-mecânico ou como medicação intracanal (em uma sessão, após o preparo biomecânico ou como princípio ativo da medicação intracanal entre sessões). Ainda foi relatado que o digluconato de clorexidina a 0,0002% ainda apresenta ação antimicrobiana elevada.
Prado et al. (2004) analisaram a retirada da solução hidroalcoólica de timerosal a 0,1% do mercado brasileiro pela Resolução da ANVISA 528 de 17 de abril de 2001 por riscos à saúde humana correlacionados às substâncias organomercuriais. O "Merthiolate" ou Mertiolato, produto de referência do timerosal, continuou no mercado substituindo o timerosal pelo cloreto de benzalcônio (cloreto de alquilbenzildimetilamônio), mas outra empresa utilizou esse nome fantasia com o digluconato de clorexidina a 1,0%. Os autores concluíram que a mudança veio contribuir para a melhoria da qualidade do Merthiolate o qual é extremamente requisitado pela população.
Haapasalo et al. (2005), em uma revisão da literária, destacam que a utilização da clorexidina (digluconato) na faixa de concentração de 0,2 a 2,0% pode dar uma vantagem adicional na luta contra microrganismos resistentes disseminados pelo sistema de canais radiculares mediante suas capacidades em (1) aumentar a permeabilidade das células bacterianas ou parede celular; (2) atacar o interior da membrana citoplasmática dos fungos; (3) causar coagulação de constituintes intracelulares em altas concentrações; (4) ação antimicrobiana residual e substantividade; (5) relativamente baixa toxicidade; (6) apresentar largo espectro de ação; (7) agir contra bactérias Gram positivas e negativas; (8) atuar contra fungos; (9) eficaz contra "Enterococcus faecalis" e "Staphylococcus aureus". Os autores não omitiram que (a) a eficácia é reduzida na presença de matéria orgânica; (b) "Micobacterias", esporos bacterianos e vírus são resistentes; (c) apresenta citotoxicidade principalmente em concentrações elevadas; (d) veiculada em gel é menos efetiva que em líqüido contra "Enterococcus faecalis"; (e) as combinações com clorexidina são tão ou menos efetivas que seus componentes utilizados sozinhos; (f) o contato com a dentina (componentes orgânicos) reduz, mas não neutraliza totalmente, a eficácia da clorexidina; (g) a albumina do plasma bovino neutraliza a ação da clorexidina e (h) não possui ação solvente tecidual.
Tyler et al. (2006) avaliaram a distribuição e o transporte do digluconato de clorexidina e da glicose no biofilme de "Candida albicans" por meio da espectrometria de massas. Os resultados confirmaram a capacidade de difusão do digluconato de clorexidina através do biofilme, no entanto, essa difusão não é uniforme o que sugere que a clorexidina se liga a sítios preferencias nas células microbiais e/ou percorre micro-canais presentes no biofilme. A presença de micro-canais sinaliza que o biofilme possui certa organização ou, pelo menos, uma estrutura complexa, pois os micro-canais poderiam contribuir com a entrada de nutrientes e saída de excretas. Em adição, observou-se que a ação da clorexidina é diretamente proporcional á sua concentração a qual diminui à medida que se aprofunda no biofilme. A glicose também não se difunde uniformemente o que possibilita áreas com escassez desse nutriente.
Clegg et al. (2006) avaliaram a efetividade em desagregar e remover o biofilme polimicrobiano produzido a partir de amostras coletadas em dentes de pacientes diagnosticados com lesão periapical com diâmetro mínimo de 3 milímetros associada à necrose pulpar que não fizeram uso de antibióticos. As amostras foram semeadas em meio de cultura e avaliadas microscopicamente ("SEM - Scanning Electron Micrograph"). A clorexidina a 2% mostrou não afetar o biofilme (SEM) e não elimina as bactérias (SEM), no entanto, gera ausência de crescimento microbiano (meio de cultura). O hipoclorito de sódio a 6% foi a única substância testada que gerou ausência de bactérias (SEM); removeu o biofilme (SEM); e promoveu ausência de crescimento microbiano (meio de cultura).
Zehnder (2006) apresentou uma revisão da literatura sobre soluções irrigantes com ênfase na ação e interação das substâncias utilizadas na terapêutica endodôntica. Com relação à clorexidina, os autores explicam que a clorexidina é uma base forte sendo mais estável na forma do seu sal sendo que, o digluconato de clorexidina, apresenta-se conveniente por ser solúvel em solução aquosa. A clorexidina é o anti-séptico mais potente da sua família química (bisguanidas). Ela tem sido utilizada na concentração de 0,1 a 0,2 no controle da placa bacteriana e até 2,0% na endodontia. É incapaz de dissolver tecido sendo, também, pouco efetiva contra bactérias Gram negativas. No entanto, é eficiente contra Gram positivos o que explica sua ação contra o "Enterococcus faecalis" (bactéria facultativa Gram positiva) e a credencia para ser utilizada nos retratamentos onde essa bactéria é predominante, mas desabona sua aplicação em infecções endodônticas primárias que geralmente são polimicrobiais, com alta prevalência de bactérias anaeróbias Gram negativas. Nesses casos, o gênero "Enterococcus" é raro. Os autores chamam a atenção para o alardeado efeito da clorexidina contra os microrganismos Gram positivos em laboratório. Isso pode gerar uma expectativa que talvez não seja possível de ser contemplada clinicamente. Contra bactérias anaeróbias, a clorexidina apresenta-se menos efetiva que o hipoclorito de sódio, no entanto, essa diferença praticamente desaparece em testes em bactérias facultativas.
Royal et al. (2007), por meio da inspeção visual da turvação do meio de cultura líqüido e da identificação taxonômica pelo método da coloração de Gram, avaliaram a ação desinfetante do hipoclorito de sódio a 5,25%, do MTAD ("doxycycline" mais ácido cítrico e mais Tween 80) e da clorexidina (provavelmente digluconato) a 2% sobre cones de guta-percha e de Resilon ("polyester - polycaprolactone") contaminados com "Enterococcus faecalis". Os resultados indicaram que a submersão por 1 minuto nas soluções testadas foi efetiva.
Edmiston et al. (2007) avaliaram, por meio da contagem do número de "colony-forming units" (CFU) em meio de cultura, ação anti-séptica pré-operatória do digluconato de clorexidina na pele da região inguinal que, geralmente, contém microrganismos do gênero "Staphylococcus", e.g., "Staphylococcus epidermidis" que apresentam inúmeros fatores de resistência e capacidade de organização em biofilme. A relevância odontológica desta pesquisa está relacionada à variação da ação do digluconato de clorexidina em função do protocolo de aplicação (veículo) e da concentração. Veículos poliméricos permitem que concentrações menores atuem de maneira tão ou mais efetiva que concentrações maiores em veículos convencionais.
Holt et al. (2007), enfocando as medicações intracanais na consistência de pasta, investigaram (1) a ação antimicrobiana por meio da avaliação do halo de inibição gerado pelo anti-séptico aplicado, por 24 horas, em cultura de "Enterococcus faecalis" cultivado em ágar e (2) a resistência à compressão em "Instron Testing Machine". Os maiores halos de inibição ocorreram com as amostras que continham digluconato de clorexidina a 2,0% em estado líqüido (Consepsis®) como aglutinante do MTA ("Mineral Trioxide Aggregate"). Em relação à resistência a compressão, a combinação entre digluconato de clorexidina e MTA apresenta-se muito friável, no entanto, o MTA veiculado em água apresenta razoavelmente resistente à compressão. Os autores concluíram que o digluconato de clorexidina a 2,0% em estado líqüido amplia a capacidade antimicrobiana das medicações intracanais que contém MTA.
Faria et al. (2007) avaliaram a citotoxicidade do digluconato de clorexidina por meio da (1) observação (edema/inflamação) de lesões teciduais em patas de ratos complementada com exame histopatológico e (2) da análise da modalidade de morte e estresse celulares em cultura de fibroblastos. Observou-se edema (inflamação) pela exposição ao digluconato de clorexidina em todas as concentrações testadas (0,125; 0,25; 0,5 e 1%). Nas duas concentrações mais baixas, o edema cedeu após 14 dias, sendo que, a 0,125%, apesar de moderada inflamação, não houve necrose tecidual e, a 0,25%, observou-se pequenos focos de necrose tecidual. Nas duas concentrações mais altas, o edema persistiu após 14 dias e observou-se inflamação e maiores áreas de necrose tecidual. Os autores concluíram que o digluconato de clorexidina pode exercer um efeito desfavorável na resolução das periodontites apicais e seus resultados sinalizam para a maior biocompatibilidade em concentrações iguais ou menores que 0,25%. Além disso, menores concentrações caracterizam-se por gerar apoptose celular, mas, em maiores concentrações, provocam estresse e necrose celular.
Paquette et al. (2007), em uma pesquisa "in vivo" em pacientes com imagens radiográficas conclusivas de periodontites apicais, utilizaram três métodos para avaliar a ação antimicrobiana do digluconato de clorexidina a 2,0% em consistência líqüida aplicado após o preparo biomecânico por um período de 7 a 15 dias: (1) contagem de CFUs ("Colony-Forming Units") em meios de cultura encubados em condição aeróbia e (2) anaeróbia, ambas em 37°C por 14 dias e (3) análise microscópica ("epifluorescence microscopy"). Os autores observaram que a medicação intracanal não elevou a proporção de dentes com culturas negativas nem diminuiu, significativamente, a contagem de bactérias nos canais radiculares após o preparo biomecânico. Foi detectado, na segunda sessão, que os canais que haviam sido completamente preenchidos por solução estavam vazios. Argumentou-se que a medicação de digluconato de clorexidina a 2,0% em estado líqüido poderia ter escapado pelo forame apical ou difundido pela dentina comprometendo a funcionalidade da terapêutica medicamentosa entre sessões. Os autores levantam a atenção para a necessidade de se desenvolver um carreador para o digluconato de clorexidina com o objetivo de controlar de maneira mais efetiva a infecção endodôntica ou, até mesmo, buscar alternativas para a medicação intracanal.
Yesilsoy et al. (1995) realizaram uma avaliação da capacidade anti-séptica de algumas soluções irrigantes por meio da mensuração de halo de inibição de crescimento em meios de cultura sólidos. Os indicadores microbiológicos utilizados foram "Streptococcus mutans" (bactéria aeróbia Gram positiva), "Peptostreptococcus micros" (bactéria anaeróbia Gram positiva); "Prevotella intermedius," e "Porphyromonas gingivalis" (bactérias anaeróbias Gram negativas). Os autores também analisaram a toxicidade dos anti-sépticos por meio da inserção subcutânea em "Guinea Pigs" por períodos de 2 horas, 2 dias e 2 semanas e subseqüente avaliação microscópica da biopsia pela contagem de células inflamatórias. O gluconato de clorexidina a 0,12% (Peridex) mostrou efeito anti-séptico próximo ao do hipoclorito de sódio a 5,25%. O hipoclorito de sódio nas concentrações de 2,5 e 5,25% e o gluconato de clorexidina a 0,12% mostraram, de maneira similar, os maiores níveis de toxicidade. Os autores concluem que o digluconato de clorexidina a 0,12% e o hipoclorito de sódio a 5,25% possuem ação antimicrobiana e toxicidade semelhantes e que o gluconato de clorexidina a 0,12% apresenta bom potencial para uso endodôntico como opção alternativa.
Marchesan et al. (2007), por meio da espectrofotometria, investigaram a natureza química do floculato resultante da associação do hipoclorito de sódio (NaOCl) com o digluconato de clorexidina como, também, a susceptibilidade do precipitado a alguns solventes. As misturas foram resultantes da combinação, duas a duas, do hipoclorito de sódio a 0,5; 2,5 e 5,0% com o digluconato de clorexidina a 0,2 e 2,0%. Todas as misturas testadas geraram precipitado. O vinagre comum, único solvente possível de ser aplicado "in vivo" testado pelos autores não foi eficaz em remover a coloração marrom da solução resultante. O exame espectrofotométrico do precipitado revelou a presença de cobre, zinco, ferro, manganês, magnésio e cálcio. Os autores concluíram que a utilização clínica na endodontia da associação entre digluconato de clorexidina e hipoclorito de sódio deve ser evitada com a finalidade de se conservar a coloração dental original uma vez que não se conseguiria remover qualquer pigmentação infiltrada nos canalículos dentinários com solventes biocompatíveis.
2.4 Da Associação
Estrela et al. (2001), manipulando meios de cultura líqüidos (BHI - "Brain Heart Infusion" e "Letheen Broth") e sólidos (BHI ágar), avaliavam o crescimento microbiano por meio, respectivamente, do turvamento e da análise microscópica utilizando "Streptococcus mutans", "Enterococcus faecalis", "Staphylococcus aureus", "Pseudomonas aeruginosa", "Bacillus subtilis" e "Candida albicans" como indicadores biológicos isolados ou combinados em suspensão. Desta maneira, pode-se observar a influência do veículo na eficiência antimicrobiana da medicação intracanal contendo hidróxido de cálcio aplicada por períodos de 1 minuto, 48 e 72 horas e 7 dias. Cones de papel absorvente eram imersos em soluções padronizadas contendo os indicadores biológicos, em seguida, submetidos ao contato das medicações intracanais segundo os períodos de aplicação citados e imersos, novamente, em meios de cultura líqüidos, os quais, por final, tiveram suas amostras semeadas em ágar. Foi constatado que, após 48 horas de aplicação, houve ação antimicrobiana independentemente do veículo utilizado (solução salina, PMCC, digluconato de clorexidina a 1%, lauril sulfato de sódio a 3%, e Otosporin®). Os autores concluíram que os veículos testados não reduziram a ação antimicrobiana do hidróxido de cálcio contido na medicação intracanal. Observa-se que ação antimicrobiana exibida neste experimento ocorreu pelo contato direto.
Evans et al. (2003) prepararam padronizadamente dentes bovinos recentemente extraídos utilizando hipoclorito de sódio a 5,25% e EDTA a 17%. Em seguida, expuseram a parede do canal radicular ao "Enterococcus faecalis" (indicador biológico) suspenso em meio de cultura líqüido e assim os encubaram para que eles penetrassem nos túbulos dentinários. Após o período de incubação, aplicou-se, em cada espécime, medicação intracanal manipulada com hidróxido de cálcio veiculado ora em digluconato de clorexidina a 2,0%, ora em água estéril por um período uma semana. Por final, raspas de dentina do interior do canal radicular foram removidas, postas em suspensão aquosa e semeadas em ágar (BHI). Após o período de incubação, a avaliação da ação antimicrobiana foi realizada pela contagem de CFUs ("Colony-Forming Units"). A medicação intracanal contendo hidróxido de cálcio veiculado em digluconato de clorexidina a 2,0% foi significativamente mais efetiva contra o "Enterococcus faecalis" que a veiculada em água estéril. O estudo demonstrou que quando o hidróxido de cálcio é misturado com o digluconato de clorexidina a 2,0%, a eficiência antimicrobiana da medicação intracanal é significativamente maior que a do hidróxido de cálcio isolado.
Haenni et al. (2003) estudaram a elevação do pH e a capacidade antimicrobiana das pastas e soluções de hidróxido de cálcio manipuladas com digluconato de clorexidina a 0,5%, hipoclorito de sódio a 1,0%, IPI a 5,0% ("Iodine Potassium Iodide") e solução fisiológica a qual foi utilizada como controle. A elevação do pH foi avaliada por meio de eletrodo fixado em cavidades padronizadas na raiz de dentes humanos uni-radiculares extraídos. O efeito antimicrobiano foi avaliado por meio da difusão no ágar contra "Enterococcus faecalis" e "Candida albicans". A habilidade do hidróxido de cálcio em elevar o pH em função do tempo foi mantida. As misturas testadas não mostraram ações antimicrobianas melhores que a pasta de hidróxido de cálcio em solução fisiológica. O digluconato de clorexidina a 0,5% foi mais efetivo utilizado sozinho que quando associado com hidróxido de cálcio, no entanto, quando associado, apesar de precipitar, mantém a ação contra "Candida albicans". Também não houve nenhum sinergismo pela combinação do hidróxido de cálcio com IPI ou com o hipoclorito de sódio.
Basrani et al. (2004) investigaram o pH, a capacidade de umectação, o tempo de trabalho, a radiopacidade, e a viscosidade das seguintes medicações intracanais: (G1) gel de digluconato de clorexidina a 2,0%, (G2) gel de digluconato de clorexidina a 0,2%, (G3) gel de hidróxido de cálcio a 40% misturado com digluconato de clorexidina a 0,2%, (G4) gel de hidróxido de cálcio a 40% e (G5) gel controle. A consistência de gel foi conseguida por meio da utilização de "methylcellulose 400 USP 1 g / 100 mL". Os autores observaram que a medicação intracanal contendo a associação do hidróxido de cálcio com o digluconato de clorexidina a 0,2% manteve os mesmos níveis de pH, tempo de trabalho e radiopacidade do gel de hidróxido de cálcio isolado. Entretanto, a umectação e a viscosidade da mistura foram elevadas. Os autores concluíram que todas as medicações intracanais testadas apresentam propriedades físico-químicas satisfatórias para serem utilizadas na terapêutica endodôntica. Os autores discutiram o significado clínico da elevação da viscosidade como da capacidade de umectação ou molhamento mostrado pela mistura. Medicações intracanais mais viscosas podem oferecer problemas para a introdução no canal radicular via cânulas ou agulhas. Em contraste, a capacidade de umectação elevada permite que o medicamento entre em contato com a superfície dentinária de maneira mais eficaz podendo penetrar em reentrâncias, no sistema de canais radiculares e, até mesmo, nos túbulos dentinários com mais eficiência elevando seu potencial terapêutico.
Yoldas et al. (2004) avaliaram o efeito do número de sessões utilizadas para o retratamento endodôntico na dor pós-operatória. Os autores incluíram, no estudo, 218 dentes com insucesso endodôntico. Retrataram-se, aproximadamente, metade dos dentes em uma única sessão, na qual, os dentes eram submetidos ao preparo biomecânico e, em seguida, à obturação endodôntica com Sealer 26® e guta-percha utilizando condensação lateral. O restante dos dentes recebia, após o preparo biomecânico, curativo de demora com medicação intracanal com 1,2 g de hidróxido de cálcio veiculado em 1 mL de solução aquosa de clorexidina a 0,2% aplicada por um período de uma semana e obturados na segunda sessão à semelhança do primeiro grupo. Findo o período de uma semana, os pesquisadores entrevistaram cada paciente argüindo-os sobre a ocorrência de dor como, também, de outros sinais e sintomas no pós-operatório. Foi oferecido um escore que melhor representasse o que o paciente havia sentido nesse período (ausência de dor, dor pequena, dor moderada e dor severa). Constatou-se que a utilização de medicação intracanal manipulada com hidróxido de cálcio e clorexidina reduziu, significativamente, a freqüência de dor pós-operatória como, também, de "flare-ups". Os autores chamaram a atenção para relatos na literatura que sinalizam para uma maior freqüência de dor aguda com necessidade de atendimento de urgência no pós-operatório dos retratamentos endodônticos. Concluiu-se que o tratamento em duas sessões com aplicação de medicação intracanal manipulada com hidróxido de cálcio e clorexidina reduziu as freqüências de dor pós-operatória e de ocorrência de "flare-ups" justamente em casos com maior freqüência de dor e "flare-ups" no pós-operatório o que denota a importância de sua utilização.
De Rossi et al. (2005) avaliaram radiograficamente a redução da área das lesões periapicais de cães mediante imagens obtidas antes da terapêutica endodôntica e após 30, 75 e 120 dias. Não houve diferença estatística significante entre a instrumentação manual e a rotatório com NiTi. Os casos que foram tratados com medicação intracanal contendo hidróxido de cálcio (Calen®) e digluconato de clorexidina a 1,0% por um período de 15 dias exibiram maior redução das lesões em relação aos casos nos quais não foi utilizada medicação intracanal. A redução das lesões ocorreu de maneira diretamente proporcional ao período de tempo do pós-operatório. Exames histopatológicos complementares evidenciaram, após 120 dias, que os grupos sem medicação caracterizavam-se pelo infiltrado de células inflamatórias enquanto que os grupos com medicação, por evidências de reparação tecidual.
Zerella et al. (2005) realizaram um estudo "in vivo" por meio da coleta de amostras microbianas de dentes com obturação endodôntica fracassada, inoculação em meios de cultura e avaliação do crescimento microbiano. Complementou-se a sistemática com técnicas moleculares utilizando amplificação por PCR ("Polymerase Chain Reaction") seguido de seqüenciamento molecular para a identificação de espécies do gênero "Enterococcus". Observou-se que o preparo químico-mecânico não apresentou eficácia significante no controle da infecção nos retratamentos, mas a medicação intracanal entre sessões foi eficiente nesta tarefa. Os autores relataram que a amostra reduzida gerou comparações com diferença estatística não-significante, no entanto, a performance da medicação intracanal de hidróxido de cálcio veiculado em solução de clorexidina a 2,0% foi notadamente maior que a veiculada em água deionizada estéril, principalmente nos casos com presença de bactérias do gênero "Enterococcus". Foram relatados resultados de experimentos piloto utilizando absorbância de luz ultravioleta mostrando que mais de 99% da clorexidina é precipitada na presença do hidróxido de cálcio. Esse achado foi contraditório à ação anti-séptica da combinação dos dois princípios ativos. Também foi constatado que a dissociação da clorexidina em meio aquoso é menor em pH básico e que, dessa maneira, as moléculas de clorexidina na presença de hidróxido de cálcio, encontram-se, na grande maioria, não-dissociadas. Por final, os autores teorizaram que a clorexidina sofre desprotonação dos grupos guanidina em pH maior que 8 gerado pelo hidróxido de cálcio em meio aquoso e que isso seria responsável pela redução da ação antimicrobiana da clorexidina associada ao hidróxido de cálcio citada na literatura por alguns pesquisadores.
Gomes et al. (2006) investigaram a atividade antimicrobiana das medicações intracanais pela difusão no ágar bem como pelo contato direto. Os indicadores biológicos representativos da infecção endodôntica foram o "Enterococcus faecalis", "Candida albicans", "Staphylococcus aureus", "Porphyromonas endodontalis", "Porphyromonas gingivalis" e "Prevotella intermedia". Os testes de difusão e de contato direto mostraram que o gel de digluconato de clorexidina a 2,0% (Natrosol - "hydroxyethil cellulose" a 1% em pH 7,0) exibiu a maior eficiência; o hidróxido de cálcio em gel de digluconato de clorexidina a 2,0%, eficiência intermediária; e o hidróxido de cálcio veiculado em água esterilizada, a pior, sendo que este sequer produziu halos de inibição. Ressalta-se que houve susceptibilidade tanto do "Enterococcus faecalis" quanto da "Candida albicans" aos medicamentos seguindo a ordenação, quanto à eficiência, citada linhas acima como, também, inatividade do hidróxido de cálcio veiculado em água no teste de difusão no ágar. Os autores explicaram que a incapacidade do hidróxido de cálcio veiculado em água em difundir-se pelo ágar deve-se à baixa solubilidade do hidróxido, ação tampão e coagulação protéica que ocorrem no ágar e são passíveis de ocorrer "in vivo" evitando a penetração nos túbulos dentinários e nas anfractuosidades do canal dental. A ação antimicrobiana do gel de digluconato de clorexidina a 2,0% reduz quando misturado com o hidróxido de cálcio.
Ballal et al. (2007) utilizaram a "Candida albicans" e o "Enterococcus faecalis" como indicadores microbiológicos para analisar a ação anti-séptica por meio da observação de halos de inibição de crescimento microbiano em meio de cultura sólido. Todas as medicações intracanais testadas exibiram halo de inibição. Com 24 horas de ação contra a "Candida albicans", a pasta de hidróxido de cálcio em água foi a mais efetiva e contra o "Enterococcus faecalis", o gel de clorexidina a 2,0 mostrou melhor ação. Com 72 horas de ação, o gel de clorexidina a 2,0% foi o mais eficaz contra "Candida albicans" e "Enterococcus faecalis" e a combinação das duas substâncias mostraram a pior performance contra os dois indicadores biológicos. Os autores concluíram que o gel de clorexidina a 2,0% é mais eficiente que a pasta de hidróxido de cálcio tanto veiculado em água quanto em gel de clorexidina a 2,0%.
Ercan et al. (2007) avaliaram "in vivo" o sucesso clínico do retratamento de dentes com lesões periapicais cujo preparo biomecânico foi realizado com digluconato de clorexidina a 2,0% e medicação intracanal manipulada com Calen® adicionado de digluconato de clorexidina a 1,0%. A observação do pós-operatório foi realizada por um período de até 12 meses. Constatou-se cura total em 64,1% dos casos; cura parcial em 14,1% e insucesso em 21,9% dos tratamentos. Os autores concluíram que a medicação intracanal manipulada com hidróxido de cálcio e digluconato de clorexidina a 1,0% pode ser utilizada, com sucesso, na anti-sepsia dos casos de retratamento de dentes com lesões apicais.
Soares et al. (2007) investigaram o efeito antimicrobiano residual de pastas de hidróxido de cálcio por meio da observação de halos de inibição do crescimento bacteriano em ágar antes e depois do período de aplicação de 21 dias em canais radiculares de dentes de cães com lesões periapicais provocadas. Todas as pastas mostraram, antes e após 21 dias, halos de inibição caracterizando o efeito residual. A adição de solução anestésica e PMCC reduziu o efeito residual da medicação. A clorexidina elevou a ação residual da pasta à base de hidróxido de cálcio. A ordenação crescente das pastas, segundo a eficácia, tanto para a avaliação inicial quanto após o período de 21 dias de aplicação, foi a seguinte: "Ca(OH)2 + anestésico", "Calen® + PMCC", "Calen®" e "Ca(OH)2 + digluconato de clorexidina".
Cook et al. (2007), quando observavam o padrão seqüencial específico da cadeia 16S do RNA ribossômico do "Enterococcus faecalis" em raspas de dentina da parede do canal radicular, caracterizavam sua presença no interior dos túbulos dentinários. Previamente ao seqüenciamento, os autores amplificavam ou replicavam exponencialmente as amostras genéticas contidas na dentina por meio do PCR ("Polymerase Chain Reaction"). Desta forma, pôde-se avaliar a eficiência da terapêutica que consistia do preparo biomecânico; utilização, ou não, de medicação intracanal; obturação com guta-percha e AH-Plus®; cultivo por 21 dias e retirada das raspas de dentina para análise. Evidenciou que a utilização de clorexidina a 2,0% por 10 minutos após o preparo químico-mecânico gerou a maior freqüência de contagens negativas de "Enterococcus faecalis"; os casos medicados com hidróxido de cálcio por 7 dias exibiram freqüências intermediárias e o grupo tratado apenas com o preparo biomecânico apresentou as menores freqüências de contagens negativas.
Manzur et al. (2007) investigaram a efetividade de medicações intracanais em pacientes de clínica escola por meio da observação da turvação de meios de cultura líqüidos e da contagem de CFU ("Colony-Forming Units") em ágar semeados com amostras colhidas (S1) antes e (S2) depois do preparo biomecânico, como, também, (S3) após o período de 7 dias de aplicação da medicação intracanal. O preparo biomecânico reduziu significativamente a quantidade de microrganismos do canal radicular, no entanto, as medicações não foram efetivas em reduzir ainda mais a infecção endodôntica. Ao restringir o foco nas médias dos percentuais de redução de CFUs obtidos por meio das medicações utilizadas, observa-se que o "hidróxido de cálcio em solução salina" reduz o porcentual de CFUs para 75,62%; o "gel de digluconato de clorexidina a 2,0% (Consepsis V)", para 53,67%; e "hidróxido de cálcio com clorexidina líquida a 2,0%" para 1,17% sinalizando para uma maior eficiência da combinação entre o hidróxido de cálcio e a clorexidina a 2,0% em estado líqüido.
Siqueira et al. (2007a), também utilizando seqüenciamento do RNA ribossômico amplificado pela utilização do PCR, como também, crescimento em meio de cultura, estudaram a carga residual de microrganismos após o preparo químico-mecânico seguido, ou não, da aplicação de medicação intracanal no tratamento de dentes com lesão periapical associada à necrose pulpar. Observou-se que, após o preparo químico-mecânico, as bactérias Gram positivas prevaleciam sobre as demais. A irrigação com digluconato de clorexidina a 0,12% durante o preparo químico-mecânico reduziu significativamente a carga de microrganismos do canal radicular, mas apenas metade dos casos apresentou culturas negativas. A aplicação de medicação intracanal (pasta de hidróxido de cálcio em gel - natrosol a 2,0% - de digluconato de clorexidina a 0,12% por 7 dias) reduziu ainda mais a carga bacteriana e produziu um número maior de casos com culturas negativas. Os autores concluíram que a utilização do digluconato de clorexidina é altamente efetiva na redução da carga bacteriana segundo o método utilizado. O impacto redutor na carga microbiana da medicação intracanal é indubitável. Portanto, terapias baseada na utilização de digluconato de clorexidina podem ser bem sucedidas no tratamento das infecções intra-radiculares primárias combinadas com periapicopatias. Ressalta-se que os canais, antes do tratamento, apresentavam comunidades contendo de 2 a 9 espécies. Após o tratamento, a maioria das bactérias eram Gram positivas. O protocolo que inclui irrigação e medicação intracanal com digluconato de clorexidina utilizado neste trabalho gerou apenas 7,7% de casos com culturas positivas.
Yeung et al. (2007) combinaram métodos para analisar as características da clorexidina influenciadas, ou não, pelo hidróxido de cálcio, hidróxido de sódio e peróxido de hidrogênio. Por meio da (1) reação entre "xanthine" com "xanthine oxidase", que gera radicais superóxidos os quais, na presença de "lucigenin", produzem quimiluminescência quantificada com um "luminometer", testou-se o "scavenging effect". (2) Por meio da utilização de "PUC18 plasmid DNA", gel de agarose a 0,8% e eletroforese, avaliou-se o potencial degradativo do DNA. (3) E pelo mesmo método da quimiluminescência, analisou-se a produção de ROS (Reactive Oxygen Species) pela interação da clorexidina com hidróxidos de cálcio e sódio. Constatou-se que a clorexidina (1') nas concentrações de 0,00002 a 0,02% exibiu "scavenging effect"; (2') em concentrações maiores que 0,083, degradou o DNA promovendo rupturas; e (3') induziu a formação maciça de ROS em pH elevado na presença de hidróxidos de cálcio e sódio. (1'') Por meio do "scavenging effect", a clorexidina remove, do meio, radicais livres produzidos por leucócitos no processo inflamatório com ação destrutiva sobre microrganismos, mas, também, células do hospedeiro no sítio inflamado e adjacências. O "scavenging effect" da clorexidina caracteriza um efeito antioxidante e antiinflamatório porque remove ROS do meio. (2'') As concentrações mais elevadas de clorexidina promoveram degradação do DNA, no entanto, os autores consideraram as concentrações iguais ou menores que 0,2% relativamente seguras. No entanto, não omitiram o fato de já ter sido relatado que aberrações cromossômicas (fragmentação do DNA em linfócitos e células epiteliais da boca) foram observadas em pacientes que faziam uso diário de enxaguatório bucal à base de clorexidina a 0,2% por um período de 18 dias; e (3'') a indução da liberação de ROS em pH elevado, como ocorre na associação com o hidróxido de cálcio, provavelmente é responsável pela ação antimicrobiana das medicações intracanais manipuladas com essas duas substâncias como, também, pela ação de neutralização de LPS. A produção de ROS caracteriza ação pró-oxidante e provavelmente destrói a parede celular e a estrutura da membrana plasmática dos microrganismos. O comportamento da clorexidina, ora como antioxidante, ora com pró-oxidante, deve-se ao fato de sua molécula ser alongada mostrando um grupo funcional "chlorophenyl guanidine" em cada uma das suas duas extremidades. Esses dois grupos funcionais são separados por uma longa cadeia alifática nitrogenada próxima aos grupos "chlorophenyl". Portanto, o grupo funcional "chlorophenyl guanidine" manifesta-se de um modo e, a cadeia alifática, de outro.
Al-Nazhan e Al-Obaida (2007), analisando o turvamento do meio de cultura líqüido, observando macroscopicamente as colônias em ágar e utilizando a "Candida albicans" como indicador biológico, apreciaram a efetividade do digluconato de clorexidina a 2,0% em solução aquosa, do hidróxido de cálcio e da medicação intracanal manipulada com a combinação dessas duas substâncias em períodos de aplicação de 1, 24 e 72 horas. Os indicadores biológicos, medicamentos e meio de cultura eram misturados em frascos e, após os períodos citados, alíquotas eram retiradas e semeadas em meios de cultura para avaliação. Constatou que a medicação manipulada somente com hidróxido de cálcio não foi efetiva na primeira hora. Em contraste, o digluconato de clorexidina a 2,0% isolado ou combinado com o hidróxido de cálcio foi efetivo nos três períodos de aplicação. Os autores concluíram que há uma somatória de benefícios na combinação do digluconato de clorexidina com o hidróxido de cálcio no controle da infecção por "Candida albicans". Observa-se que a ação antimicrobiana ilustrada nesse trabalho ocorreu pelo contato direto.
Yücel et al. (2007) estudaram os valores de pH das medicações intracanais contendo hidróxido de cálcio em função do tempo e do veículo utilizado. O valores de pH foram quantificados através de microeletrodo conectado a "pHmeter" nos seguintes instantes de verificação: 0, 10, 20, 30 e 45 minutos; 1, 24 e 48 horas; e 7 dias. Testaram-se (1) a solução fisiológica estéril, (2) glicerina, (3) spray pulpar de xilocaína, (4) Citanest com Octapressina, (5) Ultracaína DS e (6) solução de digluconato de clorexidina a 0,2%. Os maiores valores de pH ocorreram em 7 dias; valores intermediários, em 48 horas e os menores valores foram observados em até 1 hora. O digluconato de clorexidina a 0,2% e o spray pulpar de xilocaína exibiram os níveis mais elevados de pH, enquanto que os mais reduzidos foram observados com a solução fisiológica. Os autores concluíram que a medicação intracanal contendo hidróxido de cálcio exibe elevados níveis de pH com todos os veículos testados, principalmente, após 24 horas. Essas medicações deveriam permanecer no canal radicular pelo período mínimo de uma semana para que níveis mais altos de pH sejam atingidos. Para registro, listam-se os valores pH do veículo e da pasta aglutinada por eles após uma semana: solução fisiológica estéril (7,1 / 11,3), glicerina (7,6 / 12,1), spray pulpar de xilocaína (9,1 / 12,5), Citanest com Octapressina (4,1 / 12,1), Ultracaína DS (3,5 / 12,2) e solução de digluconato de clorexidina a 0,2% (6,3 / 12,4). Pode-se observar o leve caráter ácido do digluconato de clorexidina a 0,2% antes da mistura e o segundo maior valor de pH após a mistura.
2.5 Da
Neutralização do LPS
Buck et al. (2001), avaliaram a capacidade de inativação do LPS ("lipopolysaccharide" ou lipopolissacarídio) bacteriano por soluções irrigantes, medicamentos intracanais e algumas associações. Os autores utilizaram cromatografia gasosa e espectrometria de massas para detectar o "3-HMA" ("3-hydroxytetradecanoic acid" ou "3-hydroxymyristic acid"), produto da degradação do "lipid A", fragmento da molécula de LPS, e observaram que o hidróxido de cálcio (suspensão aquosa) e a medicação manipulada com a mistura de digluconato de clorexidina a 0,12%, hipoclorito de sódio a 2,6% e etanol a 95% (1 v : 1 v : 1 v) foram eficazes em neutralizar o LPS. Em contraste, o hipoclorito de sódio a 2,625%, o gluconato de clorexidina 0,12% (Peridex), o EDTA a 15% (RC-Prep), o etanol, a água destilada e a mistura de digluconato de clorexidina com hipoclorito de sódio mostraram pequena ou inexistente capacidade de degradação do LPS. Os autores não testaram a associação entre o hidróxido de cálcio e o gluconato de clorexidina.
Dias de Oliveira (2007) avaliaram a capacidade de neutralização do LPS bacteriano por meio do "Limulus Amebocyte Lysate Assay". Esse teste utiliza um estrato de células sanguíneas de um artrópode denominado "Limulus polyphemus" que reage com o LPS permitindo tanto sua qualificação quanto quantificação. Os autores verificaram que apenas o hidróxido de cálcio a 0,14% em água e a Polimixina B (10000 unidades por mL) mostraram capacidade de neutralização. O hipoclorito de sódio a 2,5% e 5,25% e o digluconato de clorexidina a 2,0% mostraram pouca ou nenhuma eficiência de neutralização e que essa capacidade é semelhante à da solução salina.
Viana et
al. (2007) utilizaram duas metodologias com a finalidade de conhecer melhor o
efeito de procedimentos endodônticos sobre endotoxinas e patógenos. Os
procedimentos foram realizados "in vivo" em 24 pacientes com lesões
periapicais associadas às necroses pulpares sem sinais e sintomas. (1) O LAL
"Quantitative Chromogenic 'Limulus Amebocyte Lysate' Assay" foi
utilizado para avaliar a capacidade de neutralização do LPS
(lipopolysaccharide) bacteriano e (2) a contagem de CFUs
em culturas microbiológicas encubadas tanto em condições aeróbias quanto
anaeróbias para examinar a capacidade antimicrobiana. Os autores observaram que
o preparo biomecânico utilizando gel de digluconato de clorexidina a 2,0% (gel
de natrosol a 1,0% em
pH = 7) reduziu significativamente a quantidade de bactérias no interior do
canal radicular. No entanto, a quantidade de LPS foi reduzida apenas
parcialmente. Nenhuma das medicações intracanais utilizadas (pasta de hidróxido
de cálcio, gel de clorexidina a 2,0% e hidróxido de cálcio veiculado em gel de
clorexidina a 2,0%) aplicadas por um período de 7 dias foi eficaz em reduzir o
número de microrganismos que sobreviveram ao preparo químico-mecânico.
Concluiu-se que, para os casos de necrose pulpar com ausência de sinais e
sintomas clínicos, a medicação intracanal composta com hidróxido de cálcio e
clorexidina, aplicada por uma semana, não foi eficaz em reduzir a infecção
endodôntica nem a quantidade endotoxinas remanescentes do preparo biomecânico.
Discutiu-se, ainda, que o preparo biomecânico, apesar de mostrar eficiência
anti-séptica, não é eficaz em remover ou neutralizar o LPS bacteriano, o qual
pode desencadear o processo inflamatório no periodonto apical atrapalhando o
processo de reparação dos tecidos afetados.
2.6 Da Toxicologia
Vicente e Toledo (2003) avaliaram a presença de para-cloroanilina em carcaças de frango tratadas com digluconato de clorexidina em função da cocção em forno a gás convencional a 200 ºC, cozimento em panela de pressão por uma hora e fritura em óleo de girassol a 180 ºC por 15 minutos. As análises e identificação foram realizadas por meio da cromatografia gasosa e da espectrometria de massas. Os autores observaram que (1) os dois métodos empregados foram eficientes em identificar a para-cloroanilina e que (2) o processamento térmico do digluconato de clorexidina resulta em sua decomposição formando a para-cloroanilina, sendo que a fritura desencadeia a maior formação de para-cloroanilina. Refletiu-se que a presença da para-cloroanilina em carne de franco, previamente tratada com digluconato de clorexidina, após o cozimento, cocção e fritura, aliada à sua toxicidade e o risco provável de câncer, deveriam ser levados em consideração na avaliação da segurança desse método de sanitização. Reporta-se, ainda, que os testes de espectrometria de massas de identificação da para-cloroanilina rastrearam os íons com valores de m/z = 127 e 129 com ocorrência daquele com valor de m/z = 127.
Usui et al. (2006), utilizando ESI-MS ("electrospray ionization - mass spectrometry") e LC-MS ("liquid chromatography - mass spectrometry"), analisaram um anti-séptico contendo digluconato de clorexidina a 5,0% adicionado de produto surfactante ("NPEOn - nonylphenolethoxylates"). O objetivo do trabalho foi o de testar o método espectrométrico para análise forense do digluconato de clorexidina no sangue hemolisado pela administração endovenosa com finalidade de suicídio, como foi reportado caso verídico pelos autores, de mulher de 22 anos, enfermeira, encontrada morta com indícios de auto-administração que, mais tarde, foi confirmada pelos testes relatados logo acima. Os autores ressaltaram alguns picos de grande importância para a detecção do digluconato de clorexidina como valores de m/z = 504,2; 505,2 e 253,1. Os valores de m/z de 504,2 e 505,2 são característicos da clorexidina. O valor de m/z de 253,1 também é relevante para a sua identificação já que trata-se de um íon da clorexidina duplamente carregado. Os autores propuseram uma via de fragmentação da clorexidina formando subprodutos também úteis para a sua identificação com valores de m/z = 151 e 334,3. Os autores concluíram que o digluconato de clorexidina é eficientemente detectado por ESI-MS e LC-MS.
Basrani et
al. (2007) realizaram uma investigação com o objetivo de determinar a
concentração mínima de hipoclorito de sódio (NaOCl)
que causaria pigmentação e precipitação quando misturado com digluconato de
clorexidina a 2%. Avaliou-se, também, o precipitado resultante qualificando-o
("X-Ray Photoelectron Spectroscopy") e quantificando-o
("Time-Of-Flight - Secondary Ion Mass Spectrometry"). Todas as
diluições de hipoclorito de sódio (NaOCl), quando
misturadas com a digluconato de clorexidina a 2%, mostraram mudança de cor até
mesmo na menor concentração do hipoclorito de sódio (0,023%) e formação de
precipitado até a sua sexta diluição (0,19%). Tanto a pigmentação quanto a
precipitação foram diretamente proporcionais à concentração do hipoclorito de
sódio. Observaram-se formação de subprodutos nas misturas com hipoclorito de
sódio a 3 e 6% com picos de m/z = 111, 127, 153, 170 e 195 amu
("atomic mass unit").
O pico de m/z = 111 amu provavelmente corresponde a molécula C6H4Cl.
Como o pico com m/z = 111 amu não se encontrava
presente no digluconato de clorexidina (picos de m/z = 127, 153, 170 e 195 amu) nem na solução analítica de para-cloroanilina (m/z = 127 amu), ela
provavelmente é um fragmento resultante da hidrólise do digluconato de
clorexidina, ou seja, um subproduto que pode, em teoria, formar outro
subproduto que é o NaC6H4Cl.
A fragmentação ocorre nas ligações entre carbono e nitrogênio (grupo guanidine)
que exigem pequena energia para sua dissociação. O pico com m/z = 153
representa a molécula
Cl(C6H4)CH2N2; o pico de m/z =
170, a molécula Cl(C6H4)CH5N3; e o pico de m/z
= 195, a molécula Cl(C6H4)C2H4N4. A importância
clínica desses achados está no fato do potencial patológico da para-cloroanilina como, também, dos
outros subprodutos originados pela mistura. A para-cloroanilina apresenta potencial carcinogênico e causa
Metahemoglobinemia e cianose. Os outros subprodutos podem possuir ação
patológica relacionada ao próprio caráter molecular como a ação exercida pela
alta reatividade (radicais livres ou ROS - Reactive Oxygen Species).
A Agencia Internacional de Pesquisas sobre o Câncer (IARC - "International Agency for Research on Cancer" - 1977) vem realizando estudos sobre o potencial carcinogênico frente à exposição a agentes isolados bem como de suas misturas com a finalidade de buscar evidências em modelos animais experimentais e dados epidemiológicos enfatizando a toxicidade e efeitos genéticos. Os agentes foram classificados segundo o risco ou potencial carcinogênico para humanos em Grupo 1 - o agente é carcinogênico para humanos; Grupo 2A - O agente é provavelmente carcinogênico para humanos; Grupo 2B - O agente é possivelmente carcinogênico para humanos; Grupo 3 - O agente não é classificável segundo sua carcinogenicidade para humanos; e Grupo 4 - O agente, provavelmente, não é carcinogênico para humanos.
Consta dos
altos da IARC (1997) que a para-cloroanilina possui potencial patogênico em humanos.
Esse agente, o qual é produto da decomposição da clorexidina, foi incluído no Grupo 2B da IARC formado por substâncias que possivelmente
possuem ação carcinogênica em humanos.
O presente estudo tem como objetivo investigar quimicamente, por meio da Espectrometria de Massas e da Cromatografia Líquida, o digluconato de clorexidina combinado ou não ao hidróxido de cálcio.
Com
base no retrospecto da literatura, formularam-se
as seguintes hipóteses:
3.1 O digluconato
de clorexidina isolado é decomposto em função do tempo na temperatura de 36,5
ºC;
3.2 O digluconato de clorexidina é decomposto em
contato com o hidróxido de cálcio;
3.3 Ocorre a formação de
subprodutos em função da decomposição da clorexidina tanto isolada quanto
combinada com o hidróxido de cálcio
3.4 A para-cloroanilina é um dos subprodutos originados da decomposição da clorexidina.
Realizaram-se
análises por meio da Espectrometria de Massas (1) da solução de para-cloroanilina, (2) da solução de
digluconato de clorexidina a 0,2% e (3) da pasta medicamentosa manipulado com o
hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2%.
A análise da pasta medicamentosa foi complementada pela Cromatografia Líquida
de Alta Eficiência com o intuito de confirmar ou não a presença do digluconato
de clorexidina.
O Espectrômetro de Massas utilizado no presente estudo foi gentilmente cedido pela Faculdade de Ciências Farmacêuticas de Ribeirão Preto (FCFRP) e o Cromatógrafo Líqüido de Alta Eficiência, pelo Departamento de Química da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto (FFCLRP), ambas da Universidade de São Paulo.
Todos os procedimentos químicos foram realizados em conjunto com Profa. Dra. Débora Fernandes Costa Guedes, química responsável pela metodologia empregada e análise dos resultados obtidos nesta pesquisa.
4.1 Reagentes Químicos
Os reagentes utilizados na manipulação dos espécimes analisados neste trabalho estão listados a seguir:
=> para-cloroanilina, Riedel de Haën, WGK, Germany.
=> digluconato de clorexidina a 20 %, Sigma-Aldrich, WGK, Germany;
=> hidróxido de cálcio 95 %, Sigma-Aldrich, Steinhein, Germany.
4.2 Preparo das Amostras
O
preparo das amostras para análise foi realizado no Laboratório de Gerenciamento
de Resíduos Odontológicos da Faculdade de Odontologia de Ribeirão Preto da
Universidade de São Paulo.
Os espécimes foram acondicionados em tubos de plástico com tampa de 2,0 mL para o transporte entre os laboratórios. Antes de cada análise, as amostras foram passadas por filtros de fase aquosa para Cromatografia Líquida de Alta Eficiência.
4.2.1 Preparo da Solução de para-cloroanilina
A solução de para-cloroanilina foi preparada utilizando-se 2,5 mg (1,96 . 10-5 mol) de para-cloroanilina dissolvidos em 1,0 mL de água deionizada obtendo-se, assim, uma solução de concentração de 2,5 mg . mL-1 (1,96 . 10-2 mol . L-1).
4.2.2 Preparo da Solução de Digluconato de
Clorexidina a 0,2 %
A solução de digluconato de clorexidina a 0,2 % foi preparada através da diluição de 20 μL da solução de digluconato de clorexidina a 20 % para 2,0 mL de solução utilizando água deionizada.
4.2.3 Preparo da Pasta Medicamentosa
A pasta medicamentosa foi preparada
com hidróxido de cálcio (116 mg) veiculado em solução de digluconato de
clorexidina 0,2 % (150 μL). A relação pó/líqüido utilizada foi a que
proporcionou a consistência de dentifrício à medicação intracanal (ESTRELA et
al., 1999; FAVA; SAUNDERS, 1999).
4.3 Espectrometria de Massas
O Espectrômetro de Massas utilizado foi o ESI-TOF-MS ultrOTOFQ fabricado pela Bruker Daltonics, Billerica, MA, EUA.
O Espectrômetro de Massas empregado no presente estudo utiliza a técnica ESI ("electrospray ionization") para ionizar as moléculas das substâncias presentes na amostra. Esta técnica é apropriada para produzir macromoléculas ionizadas (quasimoléculas) superando a propensão de fragmentação apresentada por elas no momento da ionização (SILVERSTEIN et al. 1979; SILVERSTEIN et al. 2007).
As moléculas de uma determinada substância
ionizada por um "electrospray" encontram-se
em um estado quasimolecular onde o valor de m/z da quasimolécula é geralmente
uma unidade maior ou menor que o valor da massa molecular do composto
não-ionizado na dependência do "set up" do Espectrômetro. A massa de
um íon de hidrogênio [H+] é equivalente a uma unidade de m/z. Adicioná-lo
(protonação) provê carga positiva à quasimolécula enquanto retirá-lo
(desprotonação), carga negativa.
As moléculas, uma vez ionizados,
deslocam-se em direção do analisador de massa que registra o tempo que cada íon
consome para atingir o detector. Esse tempo de vôo ou tempo de descarga
("Time-of-Flight") depende de dois fatores: (1) da massa molecular do
composto "m" e (2) da carga "z" da quasimolécula. Quanto
maior a massa, mais lenta será a viagem e maior será esse tempo; por outro
lado, quanto maior a carga, mais rápido será o deslocamento e menor será esse
tempo. A análise do "Time-of-Flight" da quasimolécula é realizada
considerando os dois fatores ao mesmo tempo por meio da utilização da relação
entre a massa e a carga ("mass-to-charge ratio") com valores notados
em "m/z" (SILVERSTEIN et al. 1979; SILVERSTEIN et al. 2007).
O
desenvolvimento da técnica ESI e a sua importância na análise de macromoléculas
biológicas acabou sendo motivo da indicação do Prêmio Nobel de Química
concedido a John Bennett Fenn em 2002.
A
expressão dos resultados da Espectrometria de Massas se dá por intermédio de um
gráfico chamado de Espectro. O eixo horizontal (das abscissas) exibe valores de
massa/carga (m/z). O eixo vertical (das ordenadas) relatada a "Abundância
Relativa das Quasimoléculas" ou, simplesmente, "Abundância
Relativa". Portanto, um pico representa, graficamente, um par ordenado,
onde "x" é o valor de m/z e "y" a Abundância Relativa. Cada
valor "m/z" está relacionado com uma quasimolécula específica com
resolução podendo chegar a mais de um milésimo. A ionização positiva ou
protonação é devida ao "set up" determinado previamente às análises.
No modo positivo, o valor do tempo de descarga de cada quasimolécula (pico)
pode ser expresso por [M+H+]+ notado
em m/z, onde M é a massa molecular do composto (somatória das massas atômicas
dos elementos que a compõe), H+ (íon hidrogênio) é o próton adicionado
nessa molécula pelo "electrospray", e a carga resultante é positiva
(+). Portanto, em uma análise, no modo positivo, se um produto apresentar,
e.g., uma quasimolécula (pico) com m/z = 52, a massa molecular desse composto
deve ser 51 uma (unidades de massa atômica) ou 51 Da (Dalton).
Vários valores de m/z já foram correlacionados com a identidade química dos compostos e fazem parte da memória científica da sociedade humana. Quando se obtém um espectro de massa de um composto já cadastrado basta, para identificá-lo, realizar uma busca computadorizada em uma biblioteca de correspondência entre valores de m/z e estrutura molecular. A coincidência dos espectros de massas é uma evidência convincente da identificação que é, muitas vezes, aceita em procedimentos legais (SILVERSTEIN et al. 1979; SILVERSTEIN et al. 2007). Quando se observa em um espectro um pico com valor de m/z ainda não cadastrado, é necessário propor a sua estrutura molecular baseada nos reagentes e condições de sua obtenção.
4.3.1 Condições das Análises no Espectrômetro de
Massas
As análises foram realizadas segundo as seguintes condições experimentais:
=> bomba de Infusão com fluxo de 130 µL / h;
=> utilização da água (H2O 100%) como fase móvel de solubilização;
=> emprego do modo de detecção positivo para todas as amostras analisadas.
4.3.1.1 Condições Operacionais do Espectrômetro de Massas
As condições operacionais do espectrômetro de massas foram as seguintes:
=> "End Plate": 4000 Volts;
=> "Capillary": 4500 Volts;
=> "Capillary Exit": 300 Volts;
=> "Skimmer": 1/55 Volts;
=> "Skimmer" 2: 25 Volts.
Devido ao fato do espectrômetro de massas possuir alta resolução, houve a necessidade de calibração interna e externa antes da realização das análises. Utilizou-se, tanto para a calibração interna quanto para a externa, a solução de NaTFA a 10 mg / mL (a sigla NaTFA representa "sodium trifluoroacetate").
Salienta-se que a análise do "Time-of-Flight" por meio de "Electrospray Ionization" apresenta altíssima resolução, ou seja, elevada capacidade de determinação de compostos separando íons em função de variações mínimas na relação entre a massa e a carga (m/z).
4.3.2 Extração das Amostras
Para analisar a medicação intracanal, foi necessário fluidificá-la e filtrá-la para se evitar o entupimento dos ductos do Espectrômetro de Massas. Portanto, extraíram-se amostras analisáveis das pastas pelo seguinte processo.
Foram adicionados 300 μL de água deionizada à pasta. Após esta adição, a amostra sofreu agitação durante 2 minutos o que a tornou menos viscosa. O líqüido resultante foi então passado por um filtro para Cromatografia Líquida de Alta Eficiência para soluções aquosas. A amostra fluidificada e filtrada pôde, então, ser injetada no Espectrômetro de Massas.
4.3.3 Cronologia das Espectrometrias de Massas
As
análises no Espectrômetro de Massas da solução de digluconato de clorexidina a
0,2% isolada e da pasta medicamentosa preparada com hidróxido de cálcio
veiculado em solução de digluconato de clorexidina a 0,2% foram realizadas (S1)
imediatamente; (S2) após sete e (S3) catorze dias do preparo.
4.3.4 Armazenamento das Amostras
Durante os períodos de espera de 7 e 14 dias, os espécimes foram acondicionados em recipientes de plástico com tampa e armazenados em estufa (Digital-Plus, 3M) a 36,5 ºC com 95% de umidade relativa.
4.4 Cromatografia Líquida de Alta Eficiência
Utilizou-se um Cromatógrafo Líqüido de Alta Eficiência ("Shimadzu Scientific Instruments") contendo os seguintes componentes integrados:
=> duas bombas de solvente (LC-10AS);
=> um detector ("diode array") espectrofotométrico UV / Vis (SPD-M 10A VP);
=> um forno para coluna (CTO-10A VP); e
=> um sistema de controle (SCL-10A VP).
Na Cromatografia Líquida de Alta Eficiência, a amostra a ser analisada é forçada por bombeamento através de uma coluna (tubo ou cilindro) repleto de pequenas partículas esféricas cuja superfície possui determinada substância química (fase estacionária). A amostra é bombeada em meio a um líqüido (fase móvel) sob alta pressão através da coluna. Mais precisamente, uma pequena quantidade da amostra é inserida no fluxo da fase móvel e sua passagem pelo tubo é retardada pela fase estacionária por interação física ou química durante a travessia. O retardo depende da natureza da amostra e da composição das fases estacionária e móvel. O tempo que a amostra leva para sair da coluna (tempo de eluição) é chamado de tempo de retenção e é considerado, na Cromatografia, como sendo a "impressão digital" de uma substância (SILVERSTEIN et al. 1979; SILVERSTEIN et al. 2007).
Com relação à fase móvel, a sua composição pode permanecer constante durante o procedimento (fluxo isocrático) ou variar em função do tempo de eluição (gradiente de eluição).
Basicamente, o Espectrofotômetro possui uma fonte de luz (lâmpada
incandescente ou lâmpada de gás deutério), um filtro de luz e um detector
(foto-dioto ou CCD "charge-coupled device"). O
espectrofotômetro UV / Vis quantifica a intensidade da luz visível de
comprimento de onda adjacente ao da luz ultravioleta que passou através da
amostra (I) e a compara com a intensidade da luz antes de ter passado pela
amostra (Io). A relação I / Io é denominada de transmitância e é usualmente
expressa em porcentagem (%T). A absorbância (A) é baseada na transmitância onde
A = − log(%T).
A Cromatografia Líquida de Alta Eficiência do presente estudo utilizou as seguintes substâncias:
=> ACN ("acetonitrile"), HPLC Grade, Mallinckrodt;
=> TFA ("trifluoroacetic acid"), Fluka, Darmstadt, Germany;
=> água Milli-Q, purificada por um aparelho "Millipore System".
Com o objetivo de aumentar a clareza, vem-se
utilizando a nomenclatura de aparelhos e substâncias na língua inglesa.
Acetonitrila é a designação na língua portuguesa para "acetonitrile"
e ácido trifluoroacético, para "trifluoroacetic acid".
A sigla HPLC representa, na língua inglesa,
"High-Performance Liquid Chromatography" e possui, como equivalente
na língua portuguesa, a sigla CLAE que representa Cromatografia Líquida de Alta
Eficiência.
4.4.1 Método de Separação
O método utilizado para a separação do digluconato de clorexidina dos subprodutos originados da sua mistura com o hidróxido de cálcio foi desenvolvido utilizando-se uma coluna analítica para Cromatografia Líquida de Alta Eficiência (Lichrospher 100RP, C18) com partículas de 5 µm de tamanho (250 mm x 4,5 mm) adquirida da Merck. Utilizou-se uma pré-coluna (Lichrospher, 4 mm x 4 mm) para proteção da coluna analítica.
A fase móvel constituía-se da mistura de (1) ACN ("acetonitrile") com (2) solução de TFA ("trifluoroacetic acid") a 0,2 %. A proporção ACN/TFA foi de 65/35 em volume (v/v) com pH 3,2 em fluxo constante de 0,2 mL por minuto. A detecção foi realizada a 239 nm. O sistema foi isocrático e mantido a temperatura ambiente. O tempo total para análise cromatográfica foi menor que 20 minutos.
5 Resultados
![]()
5.1 Resultados da Espectrometria de Massas
Os
resultados das Espectrometrias de Massas estão expressos graficamente nos
espectros de massas a seguir.
5.1.1
Espectro de Massas da para-Cloroanilina
A análise espectrométrica da para-cloroanilina teve o objetivo de se registrar valores de m/z que serão, mais tarde, utilizados como indicadores da presença dessa substância nos espetros do digluconato de clorexidina isolado ou combinado com o hidróxido de cálcio gerados logo após a manipulação das amostras como, também, 7 e 14 depois de prepará-las. O Espectro de Massas da solução de para-cloroanilina logo após sua preparação encontra-se ilustrado na Figura 3.

Figura
3. Espectro de
massas obtido da solução de para-cloroanilina
isolada avaliada logo após a sua preparação. O eixo horizontal (abscissas) representa
a relação entre a massa e a carga (m/z) das moléculas ionizadas presentes na
amostra. O eixo vertical (ordenadas) representa a abundância relativa dessas
substâncias.
O espectro de massas experimental da para-cloroanilina isolada logo após sua preparação apresentou dois picos, sendo um com valor m/z = 149 e outro, com m/z = 167. Esses dois valores de m/z bem como os valores de m/z = 127 e m/z = 129 observados na literatura para a para-cloroanilina (BASRANI, et al., 2007; VICENTE; TOLEDO et al., 2003; MUSTEATA; PAWLISZYN, 2005) serão utilizados como indicadores da presença dessa substância na análise dos espectros das soluções de digluconato de clorexidina a 0,2% isolada ou associada ao hidróxido de cálcio. Musteata e Pawliszyn (2005) e Vicente e Toledo (2003) ilustraram a estrutura molecular da para-cloroanilina a qual pode ser vista na Figura 4.
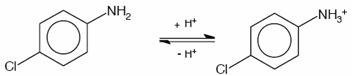
Figura 4. Ilustração da estrutura molecular da para-cloroanilina segundo Musteata e Pawliszyn (2005) e Vicente e
Toledo (2003). À esquerda, o estado não-ionizado e, à direita, a quasimolécula.
5.1.2
Espectros de Massas da Clorexidina
A clorexidina foi analisada logo em seguida ao preparo da amostra e após os períodos de 7 e 14 dias de armazenamento à temperatura de 36,5 ºC.
5.1.2.1 Espectro de Massas da Clorexidina Logo Após sua Preparação
O Espectro de Massas da solução de digluconato de clorexidina a 0,2% isolada analisada imediatamente após sua preparação está listado na Figura 5.
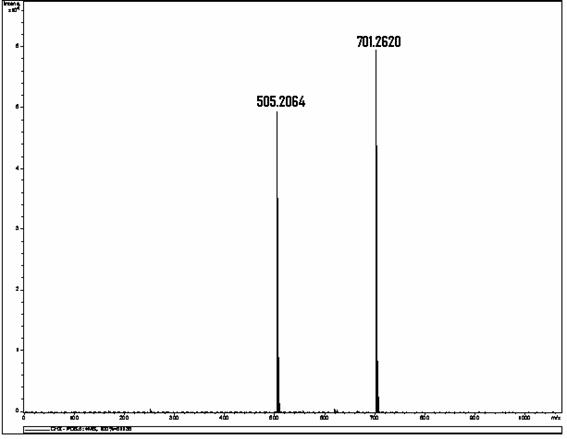
Figura
5. Espectro de
massas obtido da solução de digluconato de clorexidina a 0,2% isolada analisada
logo após o seu preparo. O eixo horizontal (abscissas) representa a relação
entre a massa e a carga (m/z) das moléculas ionizadas presentes na amostra. O
eixo vertical (ordenadas) representa a abundância relativa dessas
quasimoléculas.
Observa-se na Figura 5 que o digluconato de clorexidina a 0,2%, logo após seu preparo, possui apenas dois picos sendo um com m/z = 505 e outro com m/z = 701. A existência de apenas dois picos na amostra indica o alto grau de pureza desse espécime. Além disso, não se observa nenhum pico com valor de massa/carga que indicasse a presença de para-cloroanilina.
O pico com m/z = 505 corresponde à clorexidina (USUI et al., 2006). Aqui, clorexidina designa o íon positivo dissociado do gluconato de clorexidina a 0,2% em solução aquosa (USUI et al., 2006; PUBCHEM, 2008; IUPAC, 2008). A estrutura molecular correspondente ao pico com valores de m/z = 505 está ilustrada nas Figuras 6.

Figura
6. Estrutura
molecular com m/z = 505 correspondente ao íon protonado clorexidina encontrada
no espectro de massas da solução de digluconato de clorexidina a 0,2 % logo
após sua preparação.
O pico com m/z = 701 refere-se ao gluconato de clorexidina. Nos materiais da PUBCHEM (2007), o gluconato de clorexidina está correlacionado ao peso molecular 701,6019 g/mol, massa nominal 700 Da (Dalton) e massa monoisotópica 700,2615 Da.
A
nomenclatura IUPAC para o gluconato de clorexidina é "(1Z)-2-[6-[[amino-[[amino-[(4-chlorophenyl)
amino]methylidene] amino]methylidene]amino]
hexyl]-1-[amino-[(4-chlorophenyl)
amino]methylidene]guanidine; 2,3,4,5,6-pentahydroxyhexanoic acid"
com fórmula molecular "C28H42Cl2N10O7".
O íon negativo do gluconato de clorexidina é o gluconato originado do ácido glucônico. O ácido glucônico ("gluconic acid") também é denominado de ácido D-glucônico ("D-gluconic acid") e recebe a denominação IUPAC "2,3,4,5,6-pentahydroxyhexanoic acid", massa molecular 196,155280 g/mol e fórmula molecular "C6H12O7".
Esta afirmado nos materiais da IUPAC (2008) que a designação "ácido glucônico" é ultrapassada sendo mais atual ácido aldônico ("aldonic acid") o que seria mais apropriada, no entanto, optar-se-á em utilizar, neste trabalho, a nomenclatura obsoleta por estar alinhada à nomenclatura comercial.
O
ácido glucônico origina-se da D-glicose ("D-glucose") pela oxidação
do grupo aldeído convertendo-o em um grupo carboxílico. O carbono do grupo
aldeído apresenta (a) uma ligação simples com a cadeia carbônica, (b) uma
ligação dupla com o oxigênio e (c) uma ligação simples com um hidrogênio. A
oxidação para o grupo carboxílico está na conversão da ligação simples (c') de
um hidrogênio para uma hidroxila.
A
glicose é um monossacarídeo ou açúcar simples e seu nome vem do grego (glykys)
que significa doce e o sufíxo "ose" que denota açúcar. Dois
estéreo-isômeros dos açúcares do grupo das aldohexoses são conhecidos como
glicose. Apenas um deles é biologicamente ativo: a
D-glicose. A D-glicose também é conhecida por "dextrose monohydrate"
ou simplesmente por dextrose. A terminologia dextrose vem de
"dextrorotatory glucose" que significa glicose rotacionada no sentido
direito ou horário. A imagem espelhada da D-glicose chama-se L-glicose
"levorotatory glucose" que designa glicose rotacionada no sentido
esquerdo ou anti-horário e não pode ser metabolizada pelas células pelo
processo bioquímico conhecido como Glicólise.
Portanto,
o íon negativo gluconato é o íon do ácido glucônico originado da D-glicose.
O prefixo "di" que designa duplo não deve ser confundido com
"D-" que denota "dextrorotatory glucose". A Figura 7
ilustra as estruturas moleculares da D-glicose e do ácido D-glucônico ou,
simplesmente, ácido glucônico.
(A) (B) (C) (D)
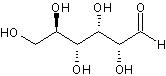
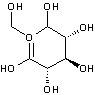
Figura 7. Estruturas
moleculares da D-glicose e do ácido glucônico. Em (A) tense a D-glicose; em (B)
uma estrutura cíclica da D-glicose; e em (C) o ácido D-glucônico ou,
simplesmente, ácido glucônico e em (D) uma estrutura cíclica do ácido
D-glucônico relatada nos documentos da CHEMSPIDER (2008).
O
reagente utilizado para a preparação da solução de digluconato de clorexidina a
0,2% recebe o nome comercial de digluconato de clorexidina a 20 %
(Sigma-Aldrich, WGK, "Germany"). Observou-se, no espectro da solução
de digluconato de clorexidina a 0,2%, logo após a sua preparação, um pico com
m/z = 701 relativo ao gluconato de clorexidina e não ao digluconato
de clorexidina como relata a nomenclatura comercial do produto a 20,0%.
O
valor de m/z = 701 equivale a somatória do m/z = 505
da clorexidina com o m/z = 196 de uma molécula de ácido glucônico.
A
estrutura molecular correspondente ao pico com valor de m/z = 701 observado no
espectro do digluconato de clorexidina a 0,2% isolado examinado logo após a sua
preparação está ilustrada na Figura 8.
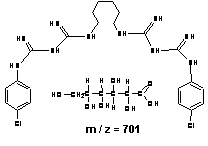
Figura
8. Estrutura
molecular com m/z = 701 correspondente ao gluconato de clorexidina
encontrada no espectro de massas da solução de gluconato de clorexidina a 0,2 %
logo após sua preparação.
5.1.2.2 Espectro de Massas da Clorexidina Armazenada por Sete Dias
O Espectro de Massas da solução de digluconato de clorexidina a 0,2% isolada analisada 07 dias após sua preparação está listado na Figura 9.
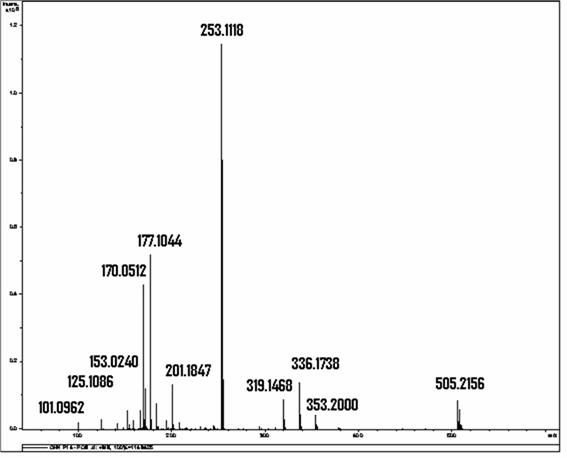
Figura
9. Espectro
de massas da solução de digluconato de clorexidina a 0,2 % isolada analisada
após 7 dias de armazenamento à temperatura constante de 36,5 °C. O eixo horizontal (abscissas)
representa a relação entre a massa e a carga (m/z) das substâncias ionizadas
presentes na amostra. O eixo vertical (ordenadas) representa a abundância
relativa dessas substâncias.
Após 7 dias de armazenamento a temperatura de 36,5 ºC, foi possível observar (Figura 9) a decomposição da solução de digluconato de clorexidina a 0,2% em, aproximadamente, dez subprodutos com diferentes valores de m/z. Nota-se a presença do pico m/z = 505 correspondente à clorexidina, que reapareceu na amostra após 7 dias, mas com a abundância relativa reduzida.
Os fragmentos com m/z = 153, 170, 177, 253, e 336 originados da decomposição do digluconato de clorexidina já haviam sido observados por USUI et al., em 2006. Na análise deste espectro, não houve indícios de para-cloroanilina.
A Figura 10 ilustra as estruturas moleculares propostas por Usui et al., (2006) para os compostos encontradas tanto por esses autores quanto no espectro da solução de digluconato de clorexidina a 0,2% isolada após 7 dias de armazenamento a 36,5ºC obtido no presente estudo.
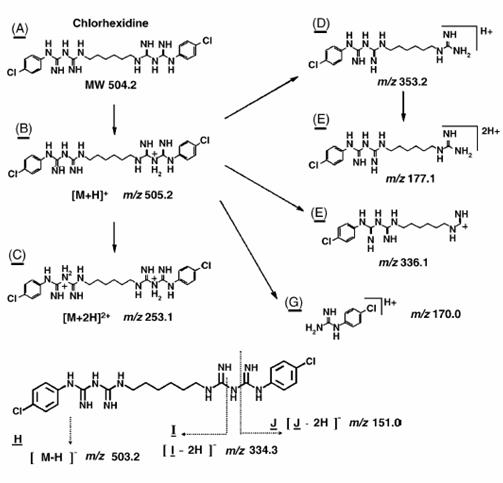
Figura
10. Estruturas
moleculares propostas por Usui et al., (2006) originadas da decomposição do
digluconato de clorexidina. Nota-se em (A) a fórmula da clorexidina com massa
molecular de 504,2; em (B), a clorexidina em modo iônico positivo com 505,2
m/z; em (C) o íon molecular da clorexidina duplamente carregado com 253 m/z; em
(D), fragmento da clorexidina com 353 m/z; em (E), fragmento da clorexidina com
177 m/z; em (F), fragmento da clorexidina com 336 m/z; em (G), fragmento da
clorexidina com 170 m/z; em (H), molécula ionizada da clorexidina em modo
iônico negativo com 503 m/z ("set up" de ionização negativa do
espectrômetro de massas); em (I), fragmento da clorexidina com 334 m/z (modo
negativo); e em (J), fragmento da clorexidina com 151 m/z (modo negativo).
Com a observação cruzada dos conteúdos das Figuras 9 e 10, listaram-se os subprodutos que se fizeram presentes tanto nos achados de Usui et al., (2006) quanto no presente estudo, são eles: m/z = 153, 170, 177, 253, 336, 353, e 505.
Propô-se para o pico com m/z = 201 a estrutura molecular da Figura 11 que teria sua origem na interação entre subprodutos.
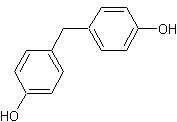
Figura 11. Estrutura molecular proposta para o subproduto referente ao pico
com m/z = 201 constante no espectro de massas obtido da solução de digluconato
de clorexidina a 0,2 % isolada examinada após 7 dias de armazenamento à
temperatura constante de 36,5 °C.
5.1.2.3 Espectro de Massas da Clorexidina Armazenada por Catorze Dias
A Figura 12 ilustra o espectro de massas da solução de digluconato de clorexidina a 0,2 % isolada analisada após 14 dias de armazenamento em temperatura de 36,5 ºC.
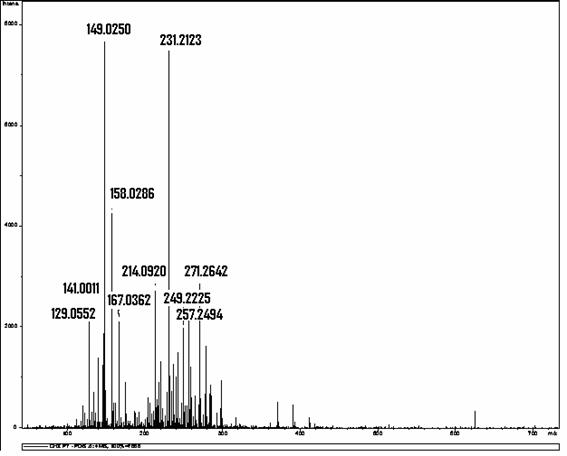
Figura
12. Espectro de
massas obtido da solução de digluconato de clorexidina a 0,2 % isolada
examinada após 14 dias de armazenamento à temperatura constante de 36,5 °C. O eixo horizontal (abscissas)
representa a relação entre a massa e a carga (m/z) das substâncias ionizadas
presentes na amostra. O eixo vertical (ordenadas) representa a abundância
relativa dessas substâncias.
Após 14 dias de armazenagem à 36,5 ºC, os picos com m/z = 505 e 701 que estavam presentes no espectro de massas inicial da clorexidina estão ausentes nesse espectro indicando a degradação total do digluconato de clorexidina.
Nota-se, na Figura 12, a decomposição da solução de digluconato de clorexidina a 0,2% em cerca de 20 subprodutos os quais não estavam presentes no espectro de massas inicial do digluconato de clorexidina isolado, são eles: m/z = 129, 141, 149, 167, 214, 231, 249, 257 e 271.
Chama-se a atenção para o fato do espectro da Figura 12 exibir os picos com os valores de m/z = 129 (indicador da literatura), 149 e 167 (indicador experimental) apontando para a presença da para-cloroanilina na solução de digluconato de clorexidina a 0,2% após 14 dias de armazenagem à temperatura de 36,5ºC.
A Figura 13 exibe as estruturas moleculares da clorexidina e da para-cloroanilina indicando o local de fragmentação e um segundo subproduto, possivelmente originados dela.
Figura
13. Estruturas
moleculares da clorexidina, da para-cloroanilina e de um segundo subproduto. Na
estrutura superior, pode-se observar o ponto de ruptura; na zona inferior, os
fragmentos formados sendo que, na parte inferior esquerda, tem-se a estrutura
molecular da para-cloroanilina
equivalente ao pico com m/z = 129 e na área inferior direita, a estrutura
molecular do subproduto equivalente ao pico com m/z = 353 já proposta por USUI
et al., (2006).
Para o pico com valor de m/z = a 257 do espectro da solução de digluconato de clorexidina a 0,2% armazenada por 14 dias, propõe-se a estrutura molecular ilustrada na Figura 14.
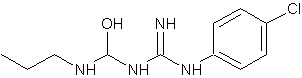
Figura
14. Estrutura
molecular proposta para o subproduto referente ao o pico com m/z = 257
constante no espectro de massas obtido da solução de digluconato de clorexidina
a 0,2 % isolada examinada após 14 dias de armazenamento à temperatura constante
de 36,5 °C.
5.1.3 Espectros de Massas da Pasta Medicamentosa
A pasta medicamentosa foi analisada logo em seguida ao preparo das amostras e após os períodos de 7 e 14 dias de armazenamento à temperatura de 36,5 ºC
5.1.3.1 Espectro de Massas da Pasta Medicamentosa Logo Após sua Preparação
A Figura 15 ilustra o espectro de massas da pasta medicamentosa manipulada com hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2% examinada logo após sua preparação.
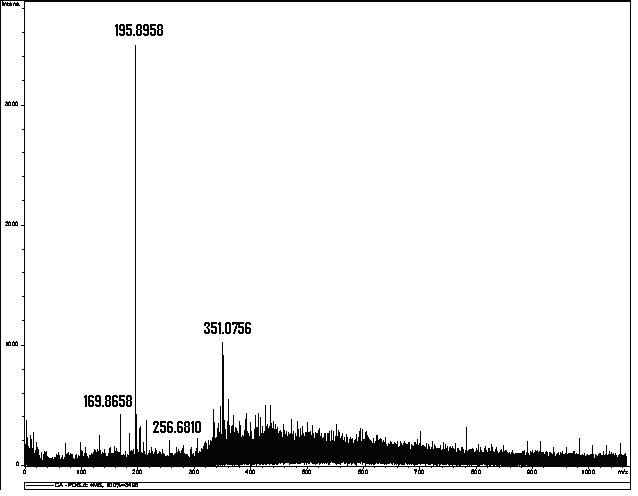
Figura
15. Espectro de
massas obtido da pasta medicamentosa manipulada com hidróxido de cálcio
veiculada em solução de digluconato de clorexidina da 0,2% examinada imediatamente
após sua preparação. O eixo horizontal (abscissas) representa a relação entre a
massa e a carga (m/z) das substâncias ionizadas presentes na amostra. O eixo
vertical (ordenadas) representa a abundância relativa dessas substâncias.
Observa-se na Figura 15 que os picos de m/z = 505 e 701 não ocorrem distintamente neste espectro sinalizando para a degradação total do digluconato de clorexidina na presença do hidróxido de cálcio. Notam-se cinco picos distintos que se destacam e uma formação de substâncias por todo o espectro com abundância relativa não-significativa. Os picos que se destacaram são aqueles com m/z = 169, 195, 256, e 351 m/z. Os picos com m/z = 256 e 351 não foram relatados nas observações de Usui et al., (2006).
O pico com m/z = 169 corresponde à clorofenil guanidina o que indica a capacidade do hidróxido de cálcio em romper a molécula de clorexidina nas posições contendo grupamentos NHn como relatou (YEUNG et al., 2007). A estrutura molecular da clorofenil guanidina pode ser observada na Figura 16.
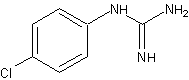
Figura
16. Estrutura
molecular da clorofenil guanidina para o subproduto referente ao o pico com m/z
= 169 constante no Espectro de massas obtido da pasta medicamentosa manipulada com
hidróxido de cálcio veiculada em solução de digluconato de clorexidina da 0,2%
examinada imediatamente após sua preparação.
O pico com m/z = 195 provavelmente vem da geração de compostos reativos, e.g., íon hidroxila, conhecidos como ROS que podem atacar a molécula de clorexidina formando a substância com fórmula química "Cl(C6H4)C2H4N4" proposta por Basrani et al. (2007) para m/z = 195 na análise da degradação do digluconato de clorexidina em pH básico gerado pelo hipoclorito de sódio.
Os indicadores da para-cloroanilina não estão presentes na medicação intracanal manipulada com hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2% imediatamente após sua preparação indicando a ausência dessa substância. Entretanto, deve-se ressaltar a necessidade de novas análises utilizando uma maior concentração de digluconato de clorexidina no intuito de confirmar a não formação deste composto uma vez que se conhece a ação das bases fortes frente à clorexidina rompendo ligações NHn.
5.1.3.2 Espectro de Massas da Pasta Medicamentosa Armazenada por Sete Dias
A Figura 17 exibe o espectro de massas obtido da medicação intracanal manipulada com o hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2% examinada após 7 dias de armazenamento em 36,5 ºC.
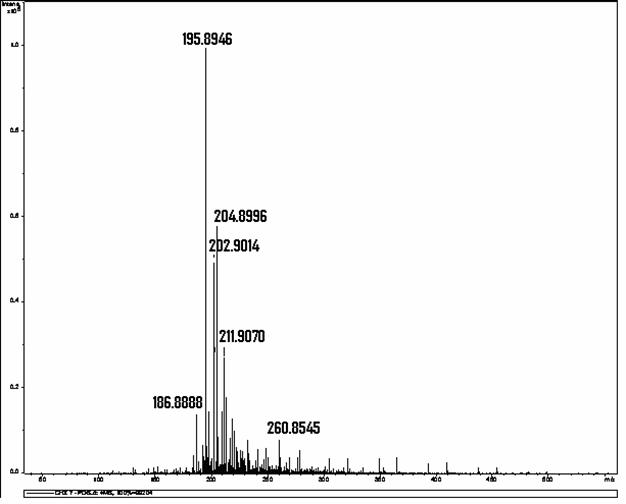
Figura
17 Espectro de massas
obtido da pasta medicamentosa manipulada com hidróxido de cálcio veiculado em
solução de digluconato de clorexidina a 0,2% examinada após 7 dias de
armazenado a temperatura de 36,5 ºC. O eixo horizontal (abscissas) representa a
relação entre a massa e a carga (m/z) das substâncias ionizadas presentes na
amostra. O eixo vertical (ordenadas) representa a abundância relativa dessas
substâncias.
É
possível constatar na Figura 17 a ausência dos picos com valores de m/z = 505 e
701 o que indica a degradação total do digluconato de clorexidina. Não se
observa nenhum dos picos indicadores da para-cloroanilina
o que indica a ausência desta substância após um período de 7 dias.
Observa-se a formação de aproximadamente 6 subprodutos listados com valores de m/z = 168, 195, 202, 204, 211 e 260. Exceto pelo pico m/z = 195, os demais picos não ocorrem nos outros espectros deste estudo nem foram listados por Usui et al. (2003). O pico de m/z = 195 ocorreu no espectro da pasta logo após sua formulação e é o mesmo que foi relatado por Basrani et al. (2007). A Figura 18 ilustra a estrutura referente o pico de m/z = 211 citada por Leveque et al., 2006 com o nome de "1-(4-chlorophenyl)biguanide".
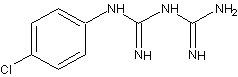
Figura
18. Estrutura
química da "1-(4-chlorophenyl)biguanide" (LEVEQUE et al., 2006)
referente ao pico com m/z = 211 do espectro de massas obtido da medicação
intracanal manipulada com hidróxido de cálcio veiculado em digluconato de clorexidina
a 0,2% analisada após 7 dias de armazenamento em temperatura de 36,5 ºC.
5.1.3.3 Espectro de Massas da Pasta Medicamentosa Armazenada por Catorze Dias
A Figura 19 expressa o espectro de massas da medicação intracanal manipulada com hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2% examinada após 14 dias de armazenagem em temperatura de 36,5 ºC.
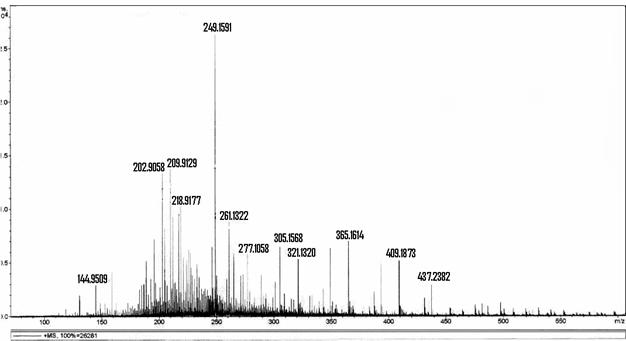
Figura
19. Espectro de
massas obtido da medicação intracanal manipulada com hidróxido de cálcio
veiculado em digluconato de clorexidina a 0,2% analisada após 14 dias de
armazenamento em temperatura de 36,5 ºC. O eixo horizontal (abscissas)
representa a relação entre a massa e a carga (m/z) das substâncias ionizadas
presentes na amostra. O eixo vertical (ordenadas) representa a abundância
relativa dessas substâncias.
A observação da Figura 19 possibilita constatar a ausência dos picos com valores de 505 e 701 m/z indicando a degradação total do digluconato de clorexidina.
Observa-se a formação de mais de 10 subprodutos sendo que os mais distintos estão listados a seguir com m/z = 144, 202, 209, 218, 249, 261, 277, 305, 321, 365, 409, e 437. Esses picos não ocorrem nas outras análises nem foram listados por Usui et al. (2006).
Não se observa nenhum dos picos indicadores da para-cloroanilina o que sinaliza para a ausência desta substância após um período de 14 dias de armazenamento a 36,5 ºC.
A figura 20 ilustra a proposta de estrutura molecular equivalente ao pico com m/z = 209.
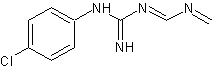
Figura
20. Estrutura
química proposta para o pico com m/z = 209 do espectro de massas obtido da
medicação intracanal manipulada com hidróxido de cálcio veiculado em
digluconato de clorexidina a 0,2% analisada após 14 dias de
armazenamento em temperatura de 36,5 ºC.
5.2 Resultados da Cromatografia Líquida de Alta Eficiência
Os resultados da análise cromatográfica são expressos graficamente por meio dos cromatogramas onde o eixo horizontal (abscissa) ilustra o tempo de retenção das substâncias presentes na amostra e o eixo vertical (ordenada) expressa a absorbância ou absorção dessas substâncias.
Embora a absorbância não tenha uma unidade verdadeira, ela é geralmente relatada em AU ou Au ("Absorbance Units"), ou seja, unidades de absorbância, correlacionada ou não com um múltiplo de unidade.
O cromatograma da solução padrão de digluconato de clorexidina a 0,2% isolada está exposto na Figura 21.

Figura
21. Cromatograma
da solução de digluconato de clorexidina 0,2 % isolada imediatamente logo após
sua preparação. O eixo horizontal (abscissas) representa o tempo de retenção em
minutos. O eixo vertical (ordenadas) representa a absorção ou absorbância em mAu ("Absorbance units").![]()
Observa-se no cromatograma da Figura 21 originado da amostra padrão de digluconato de clorexidina a 0,2% em solução aquosa logo após sua preparação que o tempo de retenção dessa substância é de 6,689 minutos. Portanto, o pico com 6,689 minutos será utilizado para a determinação da presença de digluconato de clorexidina na amostra da pasta medicamentosa manipulada com hidróxido de cálcio veiculado na solução de digluconato de clorexidina a 0,2%.
O cromatograma da medicação intracanal manipulada com hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2% logo após sua preparação pode ser visto na Figura 22.

Figura
22. Cromatograma
da medicação intracanal manipulada com hidróxido de cálcio veiculado em solução
de digluconato de clorexidina a 0,2% logo após sua preparação. O eixo
horizontal (abscissas) representa o tempo de retenção em minutos. O eixo
vertical (ordenadas) representa a absorção ou absorbância em mAu
("Absorbance units").![]()
Nota-se na Figura 22 que o pico com 6,689 minutos de retenção referente ao digluconato de clorexidina não se encontra presente no cromatograma da medicação intracanal manipulada com hidróxido de cálcio veiculado em solução de digluconato de clorexidina a 0,2%. Isso confirma a degradação total do digluconato de clorexidina provocada pelo mistura com o hidróxido de cálcio logo após a sua preparação.
A metodologia empregada no presente estudo não utilizou, em nenhuma etapa, órgãos, tecidos ou células humanos ou animais. Foram empregadas, apenas, substâncias químicas manipuladas em laboratórios com suporte técnico e organizacional que garantiram a segurança biológica dos operadores. Portanto, não houve a necessidade de submeter o projeto dessa investigação ao comitê de ética em pesquisa.
O volume dos reagentes analisados foi reduzido ao mínimo necessário com o objetivo de gerar o menor impacto ambiental possível. O descarte dos restos não utilizados foi executado no Laboratório de Gerenciamento de Resíduos Odontológicos da Faculdade de Odontologia de Ribeirão Preto da Universidade de São Paulo (FORP-USP).
6.1 Da Opção pela Solução de Digluconato de Clorexidina a 0,2%
O digluconato de clorexidina vem sendo utilizado na terapêutica endodôntica com maior freqüência nas concentrações de 0,2 a 2,0% (ZEHNDER, 2006) embora Buck et al., 2001, tenha testado, com enfoque endodôntico, a clorexidina a 0,12%. Agerbaek et al., em 1975, relatou que o digluconato de clorexidina continua mostrando ação antimicrobiana em concentrações reduzidas de até 0,006%, embora sua efetividade minore com a diminuição da concentração. Não há, portanto, unanimidade quanto à escolha da concentração da solução de digluconato de clorexidina a ser empregada na terapêutica endodôntica seja como solução irrigante ou como princípio ativo, isolado ou não, das medicações intracanais. Komorowski et al., em 2000, evidenciou a eficiência antimicrobiana do digluconato de clorexidina a 0,2%.
Deve-se considerar que uma medicação intracanal encontrará real efetividade por meio do balanceamento de três fatores: (1) citotoxicidade, (2) ação antimicrobiana e (3) necessidades específicas (SPÅNGBERG et al., 1973). A medicação intracanal mais desejável deveria ser aquele que combinasse máxima ação antimicrobiana e mínima toxicidade (FARIA et al., 2007). Verificou-se que o digluconato de clorexidina, em concentrações maiores que 0,25%, caracterizou-se pela promoção de necrose tecidual e citotoxicidade (FARIA et al., 2007). Além disso, o digluconato de clorexidina a 2,0% pode causar irritação na pele o que caracteriza seu potencial agressivo (PRADO et al., 2004; ZEHNDER 2006).
Baseado na premissa de que os
tecidos afetados pela infecção endodôntico e reação inflamatória do hospedeiro
recuperar-se-ão de maneira mais provável por meio do balanceamento entre ação
antimicrobiana e biocompatibilidade do anti-séptico empregado, optou por
avaliar quimicamente o digluconato de clorexidina a 0,2% isolado ou misturado
ao hidróxido de cálcio.
6.2 Aspectos Químicos do Digluconato de Clorexidina
Clorexidina é o nome de uma base forte instável. Ela possui um caráter iônico positivo diametralmente oposto ao hipoclorito de sódio o qual apresenta os íons hipoclorito e hipocloroso resultantes do seu equilíbrio químico em solução aquosa com cargas negativas, sendo o sódio seu íon de carga positiva (BARBIN, 1999; SPANÓ, 1999, SANTOS, 1999 e ESTRELA et al., 2002).
A clorexidina, hoje em dia, é usada com mais freqüência na forma de seu sal solúvel em água, o digluconato de clorexidina, que apresenta maior estabilidade. No entanto, digluconato é o íon negativo e a clorexidina, o íon positivo de caráter dicatiónico. Portanto, o digluconato de clorexidina dissocia-se em solução aquosa em clorexidina (cátion) e gluconato (ânion). O digluconato de clorexidina possui leve caráter ácido com pH variando de 5,5 a 6,0 possuindo a habilidade de doar prótons (ZEHNDER et al., 2006; BASRANI et al., 2007).
A ação antimicrobiana do digluconato de clorexidina está relacionada à ligação eletrostática entre as moléculas catiônicas do anti-séptico (cátion clorexidina) e a carga negativa da parede celular bacteriana. A clorexidina adsorve-se sobre a parede celular microbiana causando alterações no equilíbrio osmótico e perda de componentes intracelulares (DELANY et al., 1982; GOMES et al., 2006).
A solução de digluconato de clorexidina é líqüida a
temperatura ambiente. A consistência gel é conseguida por meio da adição de
geleificantes como Natrosol ("hydroxyethil cellulose") a 1 ou 2% ou
"Methylcellulose 4000 USP" (SIQUEIRA et al., 2007a; BASRANI et al.,
2004). O digluconato de clorexidina tem sido utilizado isoladamente como
medicação intracanal ou combinado ao hidróxido de cálcio acumulando, muitas
vezes, a função de veículo e princípio ativo.
6.3 Da Espectrometria de Massas
A Espectrometria de Massas mostrou-se eficaz na identificação do digluconato de clorexidina isolada ou misturada ao hidróxido de cálcio. Além disso, a tarefa de detalhar os picos derivados da sua segmentação foi muito bem executada por esse método em concordância com Usui et al., 2006 que também obteve bons resultados com esse equipamento. Tais virtudes caracterizaram a metodologia com sendo oportuna para contemplar os objetivos do presente trabalho.
É fundamental, na Espectrometria de Massas, carregar as moléculas da amostra durante a análise. O "set up" utilizado no aparelho provocou a protonação, ou seja, a ionização das moléculas da amostra com carga positiva pela adição do íon hidrogênio. A técnica de ionização utilizada foi a ESI ("electrospray ionization"). Ela ioniza os espécimes de alto peso molecular (macromoléculas) sem causar fragmentação. Portanto, os subprodutos encontrados nos espectros são originados da decomposição do digluconato de clorexidina em função do tempo, da temperatura e do contato com o hidróxido de cálcio e não em função da técnica de ionização (SILVERSTEIN et al. 1979; SILVERSTEIN et al. 2007).
No processo de ionização em modo positivo, as moléculas da amostra, uma vez expostas ao "electrospray", vão para um estado quasimolecular gerado pela adição de um íon (próton) de hidrogênio (H+), neste caso, a notação utilizada para a quasimolécula pode ser a seguinte: [M+H+]+. A ionização das moléculas em modo negativo remove íons hidrogênio das moléculas deixando-as com carga negativa, neste caso, a notação da quasimolécula negativa seria [M-H+]-. Íons carregados multiplamente podem ser observados nos dois modos de ionização e poderiam ser exibidos com as notações a seguir [M+2H+]2+ e [M-3H+]3-. Para uma mesma macromolécula, pode haver vários estados de carga ocorrendo com diferentes freqüências e a carga pode ser tão grande quanto a exibida na seguinte notação: [M+25H+]25+. Esse fenômeno dificulta a correlação dos picos encontrados com suas respectivas estruturas moleculares.
6.3.1
O Espectro da para-Cloroanilina
Os dois
picos observados no espectro de massas experimental da para-cloroanilina
(m/z = 149 e 167) não estão de acordo com os picos de
m/z = 127, 128 ou 129 observados na literatura para essa substância (BASRANI,
et al., 2007; VICENTE; TOLEDO et al., 2003; MUSTEATA; PAWLISZYN, 2005).
O "set up" do Espectrômetro de Massas com os seguintes parâmetros "End Plate" = 4000 Volts, "Capillary" = 4500 Volts, "Capillary Exit" = 300 Volts, "Skimmer" = 1/55 Volts e "Skimmer" 2 = 25 Volts pode ter sido responsável pelo desacordo entre o espectro experimental e os da literatura para a para-cloroanilina.
Apesar
deste desacordo, optou-se por utilizar os dois picos detectados experimentalmente
como indicadores da presença da para-cloroanilina
em virtude da procedência do reagente utilizado na preparação das amostras de para-cloroanilina (Riedel de Haën, WGK,
Germany).
Os picos
com m/z = 127, 128 e 129 não foram descartados como indicadores devido ao rigor
científico das pesquisas nas quais foram citados (BASRANI, et al., 2007;
VICENTE; TOLEDO et al., 2003; MUSTEATA; PAWLISZYN, 2005).
De
qualquer forma, não houve maiores problemas uma vez que os picos experimentais
e da literatura ocorreram no mesmo espectro.
6.3.2
Espectros das Soluções de Digluconato de Clorexidina
A análise do digluconato de clorexidina a 0,2% isolado logo após sua preparação proveu duas oportunidades: a de avaliar a pureza da solução e a de identificar os picos presentes nessa solução sem a influência da temperatura e do pH em função do tempo. Esses picos foram utilizados como indicadores da clorexidina nas amostras testadas.
A presença de apenas dois picos na solução de digluconato de clorexidina a 0,2%, logo após seu preparo, indica a pureza da amostra e o rigor dos procedimentos químicos de preparação dos espécimes. Constatou-se que a presença da clorexidina pode ser indicada pelos picos 505 e 701 m/z.
Neste espectro, não foi observado nenhum pico com valor de massa/carga que indicasse a presença de para-cloroanilina.
Após 7 dias de armazenamento a 36,5 ºC, observou-se que, apesar de haver pequena quantidade de clorexidina, a maior parte dela foi fragmentada em subprodutos sendo que, a maioria deles, já havia sido identificada por Usui et al. (2006). A ação antimicrobiana residual do digluconato de clorexidina, após 7 dias, evidenciada por Basrani et al. (2002) deve-se, provavelmente, a pequena quantidade de clorexidina que é efetiva em concentrações reduzidas (AGERBAEK et al., 1975) e a uma grande quantidade de subprodutos com ação antimicrobiana devido à capacidade pró-oxidante (YEUNG et al., 2007). Enfatiza-se que não houve formação de para-cloroanilina após 7 dias de armazenamento a 36,5 ºC.
Após 14 dias de armazenamento a 36,5 ºC, observou-se que toda a clorexidina foi fragmentada em subprodutos, sendo que, a maioria necessita de identificação molecular em pesquisas subseqüentes voltadas para esse fim.
A ação antimicrobiana residual do digluconato de clorexidina que pode chegar a 21 dias, como evidenciada por Soares et al. (2007), deve-se, provavelmente, a uma grande quantidade de subprodutos com ação antimicrobiana devido à capacidade pró-oxidante (YEUNG et al., 2007) e não mais a clorexidina propriamente devido à sua ausência.
O surgimento da para-cloroanilina após 14 dias de armazenamento é um agravo clínico uma vez que (1) a temperatura de 36,5 ºC equivale à do corpo humano; (2) a para-cloroanilina está catalogada no Grupo 2B (substâncias que possivelmente possuem ação carcinogênica em humanos) pela IARC; (3) a para-cloroanilina está associada com a metahemoglobinemia a qual promove cianose que possui alta gravidade, principalmente, na vida fetal e neonatal (JAMINET et al., 1968; BASRANI et al., 2007) e (4) a clorexidina apresenta substantividade (ROSENTHAL et al., 2004) e, por isso, se manteria no corpo humano anexada à hidroxiapatita e proteínas dentinária por períodos maiores que 14 dias (ROSENTHAL et al., 2004) o que daria tempo suficiente para a sua degradação em para-cloroanilina à temperatura de 36,5º C mesmo se aplicada por apenas 10 minutos após o preparo biomecânico como proposto por Rosenthal et al. (2004) e Cook et al. (2007).
A formação da para-cloroanilina parece ser catalisada pela temperatura corpórea o que está de acordo com Usui et al. (2006) que enfatiza a necessidade de se armazenar o digluconato de clorexidina a 4 ºC para evitar a degradação em função da temperatura.
Parece lícito concluir que o digluconato de clorexidina oferece risco significativo quando aplicado isoladamente na endodontia quer seja como solução irrigante ou medicação intracanal. Portanto, sua utilização isolada deveria ser racionalizada.
6.3.3 Espectros da Clorexidina Misturada ao
Hidróxido de Cálcio
Com a finalidade de avaliar a influência do hidróxido de cálcio por meio dos seus íons dissociados em solução aquosa promovendo elevados níveis de pH sobre a fragmentação do digluconato de clorexidina, essa mistura foi submetida à Espectrometria de Massas.
Ao observar-se a mistura do digluconato de clorexidina a 0,2% com o hidróxido de cálcio, não se encontra a clorexidina tanto na análise inicial quanto nas realizadas com 7 e 14 dias, indicando sua total segmentação desde o início da preparação e perdurando até a análise realizada com 14 dias. Esses resultados estão de acordo com Zerella et al. (2005) que constataram mais de 99% de precipitação da clorexidina quando misturada ao hidróxido de cálcio.
A ausência de digluconato de clorexidina nesta medicação confirma as convicções de Haenni et al. (2003), Jaminet et al. (1968) e Zerella et al. (2005) que sugeriram que os altos níveis de pH do hidróxido de cálcio promoveriam a precipitação do digluconato de clorexidina.
Portanto, parece plausível considerar que o efeito antimicrobiano das medicações que combinam o hidróxido de cálcio com a clorexidina, observado por Haenni et al. (2003), Ercan et al. (2007), Evans et al. (2003) e Zerella et al. (2005), não se deve à clorexidina, mas sim pela ação dos diferentes subprodutos de sua fragmentação o que está de acordo com Yeung et al. (2007) que teorizaram que os subprodutos da clorexidina gerados em pH elevado possuem efeito antimicrobiano por ação pró-oxidante.
A degradação do digluconato de clorexidina na presença do hidróxido de cálcio ocorre por vias diferentes daquelas que ocorrem na solução de digluconato de clorexidina 0,2% isolada. Esta via degradativa na presença de pH elevado não gera para-cloroanilina ou, se gerar, sua destruição deve ser imediata.
A eficiência antimicrobiana da mistura de clorexidina com hidróxido de cálcio apresenta-se menor que aquela exibida pela clorexidina isolada como foi constatado por Jaminet et al. (1968), Haenni et al. (2003) e Evans et al. (2003). Considerando esses achados e os resultados do presente estudo, pode-se concluir que a ação antimicrobiana pró-oxidante dos subprodutos deve ser menos efetiva que a ação anti-séptica da clorexidina intacta ou que os subprodutos da via degradativa isolada são mais anti-sépticos que os da via degradativa na presença de hidróxido de cálcio.
Yeung et al. (2007) observaram que a medicação intracanal de hidróxido de cálcio veiculado em solução de digluconato de clorexidina em concentrações de 0,00002 a 0,02% exibia "scavenging effect". Através desse efeito, a clorexidina removeria, do meio, radicais livres produzidos por leucócitos no processo inflamatório com finalidade destrutiva sobre microrganismos. Os achados do presente estudo sugerem que há subprodutos na mistura da clorexidina ao hidróxido de cálcio "à disposição" para reagirem com os radicais livres produzidos pelas células inflamatórias do hospedeiro. Esse potencial reativo pode ser observado na diferença entre os subprodutos dos espetros da pasta medicamentosa em função do tempo, evidenciando dinamismo e reatividade. Assim, seriam os subprodutos da clorexidina os responsáveis pelo "scavenging effect" e, portanto, pelo efeito antioxidante e antiinflamatório conseguido pela remoção de ROS ("Reactive Oxygen Species") gerados por leucócitos nos sítios inflamados.
A grande formação de subprodutos reativos observada no presente trabalho corrobora os achados de Yeung et al. (2007) que evidenciaram que o digluconato de clorexidina em concentrações mais elevadas e na presença de altos níveis de pH, induz a liberação de ROS ("Reactive Oxygen Species"). Os autores teorizam que o ROS, provavelmente, é responsável pela ação antimicrobiana como, também, pela ação de neutralização de LPS.
A maior parte dos subprodutos da degradação da clorexidina na presença do hidróxido de cálcio observados no presente estudo necessita de identificação, portanto, novas pesquisas com esse foco serão necessárias.
6.4 A Cromatografia Líquida de Alta Eficiência
O digluconato de clorexidina a 0,2% foi submetido à analise cromatográfica para a determinação do tempo de retenção que indicaria sua presença e observou-se o pico representativo do digluconato de clorexidina a 0,2% com o tempo de retenção de 6,689 minutos.
O cromatograma da clorexidina misturada ao hidróxido de cálcio revelou a presença de subprodutos e a ausência da clorexidina confirmado o que foi determinado pela Espectrometria de Massas.
6.5 Riscos Biológicos da Clorexidina
Os riscos biológicos da utilização da clorexidina misturada ou não ao hidróxido de cálcio na terapia endodôntica devem-se à possibilidade dessa substância e de seus subprodutos, cuja formação foi confirmada no presente estudo, chegarem aos tecidos periapicais e, posteriormente, ao sistema linfático, sistema sangüíneo, fígado, trato digestivo, rins e trato urinário do paciente. A via metabólica de excreção da clorexidina envolvendo os órgãos citados foi relatada por Winrow em 1973 e a remoção de substâncias dos tecidos via sistemas linfático e sangüíneo, por Guyton (1998).
As células do hospedeiro estarão sujeitas à ação deletéria potencial da (1) clorexidina e (2) dos seus subprodutos os quais podem agir (I) como radicais livres ou ROS "Reactive Oxygen Species" ou (II) devido à ação própria à identidade molecular de cada subproduto como, por exemplo, a para-cloroanilina que é um possível agente carcinogênico (IARC, 1997).
Yeung et al. (2007) reportaram o fato de já terem sido relatadas aberrações cromossômicas decorrentes da ruptura e fragmentação do DNA em linfócitos e células epiteliais da boca de pacientes que faziam uso diário de enxaguatório bucal à base de digluconato de clorexidina a 0,2% por um período de 18 dias.
A degradação da clorexidina em inúmeros subprodutos reativos e em para-cloroanilina; a substantividade e o efeito residual que manterão a clorexidina ou seus subprodutos degradativos nos tecidos do hospedeiro por amplo período de tempo são efeitos que se combinam para elevar o potencial de risco dessa substância.
Yeung et al. (2007) afirmam que os subprodutos da clorexidina misturada ao hidróxido de cálcio ao entrarem em contato com outras substâncias podem oxidá-las o que caracteriza o efeito pró-oxidante. A diferença nos subprodutos encontrada nos espectros em função do período de armazenamento de uma mesma amostra pode se dever a reações entre esses subprodutos confirmando a afirmação desses autores. A reatividade desses subprodutos pode (1) destruir a parede celular e a estrutura da membrana plasmática dos microrganismos, mas também pode danificar as células do hospedeiro.
Apesar de não se ter observado, no presente estudo, a formação de para-cloroanilina na mistura do hidróxido de cálcio com o gluconato de clorexidina, deve-se considerar, em alto grau, os achados de YEUNG et al. (2007) os quais observaram que a combinação do hidróxido de cálcio contendo digluconato de clorexidina em concentrações maiores que 0,083% degradaram o DNA promovendo rupturas pela ação dos radicais livres.
6.6 Extrapolações Clínicas Baseadas nos
Achados Experimentais e da Literatura
Raenni, et al., 2003, observaram que, ao se elevar o pH do digluconato de clorexidina a 0,5% com hidróxido de sódio de 6 para 12, houve precipitação. No entanto, a ação antimicrobiana contra "Candida albicans" manteve-se eficaz e o digluconato de clorexidina continuou tendo efeito semelhante aquele no pH original. No presente estudo, constatou-se que com a elevação do pH pelo hidróxido de cálcio houve degradação total da clorexidina. A reflexão sobre esses achados sugere que a mistura continua com caráter anti-séptico, mas devido aos subprodutos da clorexidina por meio de um efeito pró-oxidante como relata YEUNG et al., 2007.
Schirrmeister et al. (2007) afirmaram que o preparo químico-mecânico com irrigação copiosa de hipoclorito de sódio a 2,5% associado ao EDTA a 17% foi suficiente para erradicar microrganismos cultiváveis ou passíveis de identificação por PCR ("polymerase chain reaction"). A irrigação com digluconato de clorexidina e a aplicação de medicação intracanal contendo hidróxido de cálcio não seria necessária para se obter a recuperação dos tecidos afetados do hospedeiro pela infecção endodôntica e que o intervalo entre as consultas poderia, inclusive, recontaminar o canal radicular já tratado.
No entanto, Nair et al. (2005) exibe imagens microscópicas que não deixam dúvida da disseminação da infecção endodôntica pelas estruturas anatômicas irregulares do sistema de canais radiculares apicais como istmos entre canais mesiais dos molares inferiores. O autor exibe imagens nítidas da infecção remanescente do preparo biomecânico tanto manual (instrumentos de aço) quanto rotatório (instrumentos de Ni-Ti).
Yeung et al. (2007) destacaram que as infecções endodônticas e periodontais exibem comunidade microbiológica similar e ambas parecem estar ligadas à elevação do risco de doenças cardiovasculares. Portanto, de uma forma ou de outra, a infecção endodôntica persistente ao preparo biomecânico evidenciada por Nair et al. (2005) necessita ser controlada uma vez que a sua manutenção pode evoluir para doenças cardiovasculares.
O preparo químico-mecânico age com alta eficiência no canal principal, mas, algumas vezes, não promove limpeza e anti-sepsia eficaz no sistema de canais radiculares e túbulos dentinários (NAIR et al., 2005). O hidróxido de cálcio apresenta ótima ação biológica; ação anti-séptica pelo pH elevado e inibição enzimática microbiana; de neutralização de LPS bacteriano; e promove a reparação tecidual por meio da ativação enzimática do hospedeiro. No entanto, não é eficiente à distância também não agindo com bom rendimento contra "Enterococcus faecalis" e "Cândida albicans". O digluconato de clorexidina possui ações complementares ao do hidróxido de cálcio, mesmo que pelo efeito dos produtos da sua decomposição frente ao hidróxido de cálcio. Ela age à distância, mostra efeito antimicrobiano residual, substantividade, efeito contra "Enterococcus faecalis" e "Cândida albicans", porém, não possui grande performance contra bactérias anaeróbias Gram negativas e conta "Pseudomonas aeruginosa", bactéria Gram negativa aeróbia (ESTRELA et al.,2001; WALTINO et al., 1999; NAZHAN; AL-OBAIDA 2007; SIQUEIRA et al., 2007b; PAQUETTE et al, 2007).
Zehnder (2006) relata que a eficácia do digluconato de clorexidina contra bactérias Gram positivas em experimentos de laboratório pode estar causando uma superestimação da utilidade clínica desse agente antimicrobiano. O emprego isolado da clorexidina fica ainda mais comprometido pelas constatações do presente estudo que a caracteriza como fonte de para-cloroanilina com provável ação carcinogênica e causadora da metahemoglobinemia que está ligada à cianose e é mais grave na vida fetal e neonatal (JAMINET et al., 1968; BASRANI et al., 2007; IARC, 1997).
Talvez o melhor entendimento que se possa fazer do que está disposto até o presente momento, esteja na administração precisa e estabelecimento criterioso de vínculos diagnóstico-terapêuticos que modulem a eficiência quimioterápica e o risco sistêmico de acordo com a necessidade do quadro clínico (SPÅNGBERG et al., 1973).
Pacientes com pulpites irreversíveis e necroses pulpares incipientes desassociadas a periodontites apicais com reabsorções ósseas, casos, nos quais, a infecção endodôntica não se encontra disseminada, mas sim, contida ao canal principal, não deveriam ser expostos a substâncias com riscos toxicológicos sistêmicos. Esses casos deveriam ser tratados por meio do preparo biomecânico realizado em cadeia asséptica com esmero e inteligência e, caso a obturação seja inviável na primeira sessão, um curativo com hidróxido de cálcio em veículo inerte seria a opção mais equilibrada no que diz respeito à prevenção da re-infecção.
Por
outro lado, pacientes com periodontites apicais crônicas persistentes com
reabsorções ósseas correlacionadas às gangrenas pulpares ou obturações
endodônticas fracassadas, talvez não tenham outra opção a não ser se submeterem
ao tratamento em duas ou mais sessões com a utilização de medicação intracanal
contendo hidróxido de cálcio veiculado em digluconato de clorexidina em
concentrações menores que 0,25%. Nesses casos, o preparo biomecânico e o uso
isolado dessas substâncias geralmente não são suficientemente para controlar a
infecção e debelar o processo inflamatório, no entanto, o preparo biomecânico
complementado pela aplicação, entre sessões, da medicação intracanal manipulada
com clorexidina mistura e hidróxido de cálcio faz com que as virtudes de cada um compensem as deficiências dos outros gerando resultados
favoráveis (EVANS et al., 2003; ZERELLA, et al., 2005; YOLDAS et al., 2004; DE
ROSSI et al. 2005; ERCAN et al. 2007; MANZUR et al.;2007; SIQUEIRA et al.
2007a; AL-NAZHAN; AL-OBAIDA 2007; BUCK et al., 2001; DIAS DE OLIVEIRA, 2007).
O
fato da para-cloroanilina ter sido
encontrada na degradação da clorexidina em pH elevado gerado pelo hipoclorito
de sódio (BASRANI et al., 2007) faz com que a análise dos achados do presente
estudo seja realizada com prudência e estimula a realização de novas pesquisas
para elucidar melhor as conseqüências da exposição da clorexidina à substâncias fortemente alcalinas.
Deve-se manter em mente que uma terapêutica é justificável quando seus riscos potenciais são menores que os da doença. Portanto, é imperativo buscar novas estratégias ou medicações que colaborem mais efetivamente com os objetivos do tratamento endodôntico aumentando sua previsibilidade com a completa ausência de riscos sistêmicos para os pacientes.
Salienta-se que toda vez que se cria ou elabora uma mistura de substancias para uso clínico, o produto resultante deveria ser analisado por métodos químicos, pois, desta forma, verificar-se-ia previamente os efeitos úteis e deletérios da mistura.
Com
base na metodologia empregada e nos resultados obtidos, é lícito concluir o que
segue:
7.1 O
digluconato de clorexidina isolado foi decomposto em função do tempo quando
armazenado a temperatura de 36,5 ºC em um período de observação de 14 dias;
7.1.1 Ocorre
a formação de diferentes subprodutos pela decomposição
da clorexidina;
7.1.2 A para-cloroanilina foi formada pela
decomposição da clorexidina isolada após o período de 14 dias de armazenamento
a temperatura de 36,5 ºC.
7.2 A decomposição da clorexidina é total em contato com o hidróxido de
cálcio;
7.2.1 Ocorre a formação de diferentes
subprodutos da decomposição da clorexidina pela ação do hidróxido de cálcio;
7.2.2 Não se observou a formação de para-cloroanilina na pasta medicamentosa
manipulada com hidróxido de cálcio veiculado em solução de digluconato de clorexidina
a 0,2% no período de observação de 14 dias a temperatura de 36,5º C.
7.3 Frente ao grande número de compostos formados pela decomposição da
clorexidina e as evidências de ruptura na sua molécula nos grupamentos NHn, novas investigações serão necessárias
para confirmar a ausência da para-cloroanilina
nas pastas medicamentosas manipuladas com hidróxido de cálcio veiculado em
solução de digluconato de clorexidina, principalmente, nas concentrações mais
elevadas como a 1 e 2 % e períodos de observação maiores que 14 dias.
7.3.1 Não
se deve edificar, baseado nos resultados deste trabalho, uma falsa noção de que
a inexistência de para-cloroanilina
nas pastas medicamentosas manipuladas com hidróxido de cálcio e clorexidina
confere ausência de riscos sistêmicos durante sua aplicação terapêutica.
7.3.2 O grande número de subprodutos e o dinamismo com o qual eles surgem
e desaparecem em função do tempo de armazenagem em temperatura de 36,5 ºC são
evidências de grande reatividade, característica peculiar dos radicais livres,
os quais podem oferecer riscos à integridade genética das células do hospedeiro
afetadas pela medicação intracanal.
7.4 A utilização, como medicação intracanal, da solução de digluconato
de clorexidina a 0,2% isolada oferece potencial de risco sistêmico pela
formação de vários subprodutos reativos e para-cloroanilina.
7.5 É imperativo estabelecer vínculos diagnóstico-terapêuticos precisos
por meio do desenvolvimento de protocolos clínicos que restrinjam o uso das
medicações intracanais com potencial de risco sistêmico a quadros clínicos com
infecção disseminada pelo sistema de canais radiculares, túbulos dentinários e
superfície radicular apical externa associada às periodontites apicais
persistentes com reabsorções ósseas.
7.6 É evidente a necessidade do desenvolvimento de novas estratégias
terapêuticas por meio de técnicas mais eficientes, substâncias e medicações
intracanais sistemicamente inócuas para que se contemplem os objetivos do
tratamento dos canais radiculares com previsibilidade e segurança.
![]()
8 Referências Bibliográficas
AGERBAEK, N.; MELSEN,
B.; ROLLA, G. Application of chlorhexidine by oral irrigation systems. Scand. J. Dent. Res., v. 83, p. 284-287, 1975.
BALLAL, V.; KUNDABALA, M.; ACHARYA, S.; BALLAL, M. Antimicrobial action of calcium hydroxide, chlorhexidine and their combination on endodontic pathogens. Aust Dent J, v. 52, n. 2, p. 118-121, 2007.
BARBIN, E. L. Estudo “in vitro” do efeito da adição de lauril dietileno glicol éter sulfato de sódio nas soluções hipoclorito de sódio sobre suas propriedades físico-químicas anteriores e posteriores à dissolução do tecido pulpar bovino. 1999. 108p. Dissertação (Mestrado em Odontologia Restauradora, Subárea Endodontia) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 1995. Disponível em <http://www.forp.usp.br/restauradora/Teses/Barbin/mestrado_barbin.html>.
BASRANI,
B.; GHANEM, A.; TJADERHANE,
L. Physical and chemical properties of chlorhexidine and calcium hydroxide-containing
medications. J Endod,
v. 30, p. 413-7. 2004.
BASRANI, B.; SANTOS, J. M.; TJÄDERHANE, L.; GRAD, H.; GORDUYSUS, O.; HUANG, J.; LAWRENCE, H. P.; FRIEDMAN, S. Substantive antimicrobial activity in chlorhexidine-treated human root dentin. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 94, 240-5, 2002.
BRASIL. Agência Nacional de Vigilância Sanitária. Proíbe o uso de compostos mercuriais nos medicamentos e dá outras providências. Resolução nº 528, 17 de abril de 2001. Lex: Diário Oficial da União; Poder Executivo. Republicado por ter saído com incorreção, no original, publicado no Diário Oficial da União nº 75-E, seção 1, página 147, de 18 de abril de 2001.
BUCK,
R. A.; CAI, J.; ELEAZER, P.
D.; STAAT, R. H.; HURST, H. E. Detoxification of endotoxin by endodontic irrigants
and calcium hydroxide. J
Endod, v. 27, n. 5, 2001.
BYSTRÖM,
A.; CLAESSON, R.; SUNDQVIST, G. The antibacterial
effect of camphorated paramonochlorophenol,
camphorated phenol and calcium hydroxide in the treatment of infected root
canals. Dent Traumatol,
v. 1, n. 5, p. 170–175, October 1985. "doi:10.1111/j.1600-9657.1985.tb00652.x"
CERVONE,
F.; TRONSTAD, L.; HAMMOND, B. F. Antimicrobial
effects of chlorhexidine in a controlled release delivery system. Endod Dent Traumatol,
v. 6, p. 33–36, n. 1, 1990.
CHEMSPIDER.
Building a Chemical Structure Centric
Community for Chemists. 2008 Disponível em <http://www.chemspider.com/>.
Acessado em jan. 2008.
CLEGG,
M. S.;VERTUCCI, F. J.;
WALKER, C.; BELANGER, M.; BRITTO, L. R. The effect of
exposure to irrigant solutions on apical dentin biofilms in vitro. J
Endod, v. 32, n. 5, May 2006. "doi:10.1016/j.joen.2005.07.002"
COOK, J.; NANDAKUMAR, R.; FOUAD, A. F. Molecular- and culture-based comparison of the
effects of antimicrobial agents on bacterial survival in infected dentinal
tubules. J Endod,
v. 33, p. 690-692, 2007. "doi:10.1016/j.joen.2007.01.022"
DELANY,
G. M.; PATTERSON, S. S.; MILLER, C. H.; NEWTON, C. W. The effect of
chlorhexidine gluconate irrigation on the root canal
flora of freshly extracted necrotic teeth. Oral
Surgery, Oral Medicine, Oral Pathology, v. 53, n. 5, p. 518-523, May 1982.
"doi:10.1016/0030-4220(82)90469-8"
DIAS
DE OLIVEIRA, L.; JORGE, A. O. C.; CARVALHO, C. A. T.;
KOGA-ITO, C. Y.; VALERA, M. C. In vitro effects of endodontic
irrigants on endotoxins in
root canals. Oral Surg
Oral Med Oral Pathol Oral Radiol
Endod, v. 104, n. 1, July 2007. "doi:10.1016/j.tripleo.2006.11.037"
EMILSON,
C. G. Susceptibility of various microorganisms to chlorhexidine. Scand J Dent Res,
v. 85, p. 255– 65, 1977.
ERCAN,
E.; DALLI, M.; DÜLGERGIL,
T.; YAMAN, F. Effect of Intracanal Medication with
Calcium Hydroxide and 1% Chlorhexidine in Endodontic Retreatment
Cases with Periapical Lesions: An In Vivo Study. J Formos Med Assoc, v. 106, n. 3, p.
217-224, 2007.
ESTRELA, C.; BAMMANN, L. L.;
PIMENTA, F. C.; PÉCORA J. D. Control of
microorganisms in vitro by calcium hydroxide pastes. Int Endod J, v. 34, p. 341–345, 2001.
ESTRELA, C.; ESTRELA, C. R.
A.; BARBIN, E. L.; SPANÓ, J. C. E.; MARCHESAN, M. A.; PÉCORA, J. D. Mechanism
of action of sodium hypochlorite. Braz Dent J; v.
13, p. 113–17, 2002.
ESTRELA, C.; HOLLAND, R. Calcium hydroxide: study
based on scientific evidences. J Appl Oral Sci, v. 11, n. 4,
p. 269-82, 2003.
ESTRELA, C.; PIMENTA, F. C.;
ITO, I. Y.; BAMMANN, L. L. Antimicrobial evaluation
of calcium hydroxide in infected dentinal tubules. J Endod, v. 25, n. 6, June 1999.
ESTRELA, C.; PIMENTA, F. C.;
ITO, I. Y.; BAMMANN, L. L. In vitro determination of
direct antimicrobial effect of calcium hydroxide. J Endod, v. 24, p. 15-17, 1998.
ESTRELA, C.; SYDNEY, G. B.; BAMMANN,
L. L.; FELIPPE JÚNIOR, O.
Mechanism of action of calcium and hydroxyl ions of calcium hydroxide on tissue
and bacteria. Braz Dent J, v. 6, n. 2, p. 85-90, 1995.
ESTRELA, C.; SYDNEY, G. B.; BAMMANN,
L. L.; FELLIPE-JR, O. Study of the biological effect
of pH on the enzimatic activity of anaerobic
bacteria. Rev. Fac.
Odontol. Bauru, v. 2,
n. 4, p. 31-8, out.-dez. 1994.
EVANS,
M. D.; BAUMGARTNER, J. C.; KHEMALEELAKUL, S.; XIA, T. Efficacy of Calcium Hydroxide: Chlorhexidine Paste
as an Intracanal Medication in Bovine Dentin. J Endod, v. 29, n. 5, May 2003.
FAVA, L. R. G.; SAUNDERS, W. P. Calcium hydroxide
pastes: classification and clinical indications. Int Endod J, v. 32, p. 257-282, 1999.
GOMES,
B. P. F. A.; VIANNA, M. E.; SENA,
N. T.; ZAIA, A. A.; FERRAZ,
C. C. R.; SOUZA FILHO, F. J. In vitro evaluation of
the antimicrobial activity of calcium hydroxide combined with chlorhexidine gel
used as intracanal medicament. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 102, n. 4,
October 2006. "doi:10.1016/j.tripleo.2006.04.010"
GUYTON, A. C. Fisiologia Humana. 6. ed. Rio de Janeiro: Guanabara Koogan, 1988.
HAAPASALO,
M.; ENDAL, U.; ZANDI, H.; COIL,
J. M. Eradication of endodontic infection by instrumentation and irrigation
solutions. Endodontic
Topics, v. 10, p. 77-102, 2005.
HAENNI
S, SCHMIDLIN PR, MUELLER B, SENER
B, ZEHNDER M. Chemical and antimicrobial properties of calcium hydroxide mixed with
irrigating solutions. Int Endod J, 36,
100-105, 2003.
HAUSMANN, E.; LUDERITZ,
O.; KNOX, K.; WEINFELD, N. Structural requirements
for bone resorption by endotoxin
and lipoteichoic acid. J Dent Res, v. 54, p. B94–B99, 1975. apud
VIANNA, M. E.; HORZ, H. P.;
CONRADS, G.; ZAIA, A. A.;
SOUZA-FILHO, F. J.; GOMES, B. P. F. A. Effect of root
canal procedures on endotoxins and endodontic
pathogens. Oral Microbiol
Immunol, v. 22, p. 411–418, 2007.
HEITHERSAY,
G. S. Calcium hydroxide in the treatment of pulpless
teeth with associated pathology. J Brit Endod Soc, 8: 74-93, 1975 apud
ESTRELA, C.; SYDNEY, G. B.; BAMMANN,
L. L.; FELIPPE JÚNIOR, O.
Mechanism of action of calcium and hydroxyl ions of calcium hydroxide on tissue
and bacteria. Braz Dent J, v. 6, n, 2, p. 85-90, 1995.
HENNESSEY,
T. D. Some antibacterial properties of chlorhexidine. J Periodontal Res, v. 8, n. s12, p.
61-67, December 1973. "doi:
10.1111/j.1600-0765.1973.tb02166.x"
HERMANN,
B. W. Calciumhydroxyd als mittel zurn behandel und füllen vonxahnwurzelkanälen.
[Thesis] Würzburg; 1920. 50p. apud
ESTRELA C, HOLLAND R. Calcium hydroxide: study based
on scientific evidences. J Appl Oral Sci, v. 11, n. 4,
p. 269-82, 2003.
IARC.
IARC monographs on the evaluation of carcinogenic risks to humans: preamble. Lyon, France, 1977a. Disponível em <http://monographs.iarc.fr/ENG/Preamble/CurrentPreamble.pdf>.
Acessado em jan. 2008.
IARC.
The evaluation of carcinogenic risks to humans. IARC Monographs, v. 57, p. 43, 1997b. Disponível
em <http://monographs.iarc.fr/ENG/Monographs/vol57/volume57.pdf>.
Acessado em jan. 2008.
IUPAC. Compendium of Chemical Terminology. Electronic Version, 2007. Disponível em <http://goldbook.iupac.org/Q05000.html>. Acessado em jan. 2008.
IUPAC.
International Union of Pure and Applied Chemistry. Gold
Book. 2007. Disponível em <http://goldbook.iupac.org/A00496.html>.
Acessado em jan. 2008.
KAKEHASHI,
S.; STANLEY, H. R.; FITZGERALD, R. J. The effects of surgical exposures of
dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral
Med Oral Path, v. 20, p. 340-9, 1965. apud
ZAMANY, A.; SAFAVI, K.; SPÅNGBERG, L. S. W. The effect of chlorhexidine as an
endodontic disinfectant. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 96, p.
578-81, 2003. "doi:10.1016/S1079-2104(03)00168-9"
KOMOROWSKI, R.; GRAD, H.; WU, X. Y.; FRIEDMAN, S. Antimicrobial Substantivity of Chlorhexidine-Treated Bovine Root Dentin. J Endod, v. 26, n. 6, June 2000.
LEONARDO, M. R. Endodontia: tratamento de canais radiculares: princípios técnicos e biológicos. v. 1. São Paulo: Artes Médicas, 2005.
LEONARDO, M. R.; ROSSI, M. A.; SILVA, L. A. B.;
ITO, I. Y.; BONIFÁCIO, K. C. EM Evaluation of Bacterial Biofilm and Microorganisms on the Apical External Root Surface
of Human Teeth. J Endod, v. 28, n. 12, Dec. 2002.
LEVEQUE,
N. L.; CHARMAN, W. N.; CHIU, F. C. K. Sensitive
method for the quantitative determination of proguanil
and its metabolites in rat blood and plasma by liquid chromatography–mass
spectrometry. J Chromatogr
B, v. 830, n. 2, p. 314–321, 2006.
"doi:10.1016/j.jchromb.2005.11.004"
MARCHESAN,
M. A.; JÚNIOR, B. P.; AFONSO,
M. M. F.; SOUSA-NETO, M. D.; PASCHOALATO,
C. Chemical analysis of the flocculate formed by the association of sodium
hypochlorite and chlorhexidine. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod, v. 103, p. e103-e105, 2007. "doi:10.1016/j.tripleo.2006.11.008"
MOLANDER,
A.; REIT, C.; DAHLE´N, G.; KVIST, T. Microbiological status of root-filled teeth with
apical periodontitis. Int J Endod, v.
31, p. 1-7, 1998.
MUSTEATA,
F. M.; PAWLISZYN, J. Assay of stability, free and total concentration of
chlorhexidine in saliva by solid phase microextraction.
J Pharm Biomed Anal, v. 37, p. 1015–1024, 2005.
NAIR,
P. N. R.; HENRY, S.; CANO, V.; VERA, J. Microbial status of apical root canal
system of human mandibular first molars with primary
apical periodontitis after ‘‘one-visit’’ endodontic treatment. Oral Surg Oral
Med Oral Pathol Oral Radiol
Endod, v. 99, n. 2, p. 231-52, Feb. 2005. "doi:10.1016/j.tripleo.2004.10.005"
NELSON-FILHO, P.; LEONARDO, M. R.; SILVA, L. A. B.; ASSED, S. Radiographic Evaluation of the Effect of Endotoxin (LPS) Plus Calcium Hydroxide on Apical and Periapical Tissues of Dogs. J Endod, v. 28, n. 10, October 2002.
PEAKMAN, M.; VERGANI, D. Imunologia básica e clínica. Rio de Janeiro: Guanabara Koogan, 1999.
PODBIELSKI, A.; BOECKH, C.; HALLER, B. Growth inhibitory activity of gutta-percha points containing root canal medications on common endodontic bacterial pathogens as determined by an optimized quantitative in vitro assay. J Endod, v. 26, n. 7, p. 398-403, 2000.
PRADO, M. J. V.; OLIVEIRA, R. C.; FERREIRA, R. S. F.; VIEIRA, R. C. P. A.; PINHO, J. J. R. G. A retirada do timerosal do mercado farmacêutico e sua substituição pelos derivados de amônio quaternário: avaliação do risco/benefício. Lecta, v. 22, n. 1/2, p. 37-47, jan./dez. 2004.
PUBCHEM. Pubchem substance database. 2008. "http://pubchem.ncbi.nlm.nih.gov/"
QUILLIN, B. T.; DABIRSIAGHI,
C. L.; KRYWOLAP, G. N.; DUMSHA,
T. C. Antimicrobial effect of Ca(OH)2
supplemented with metronidazole and chlorhexidine as intracanal medicaments. J Endod, v. 18, n. 4, p. 187, 1992.
RÖLLA, G.; LÖE, H.; SCHIØTT, C. R. The affinity of chlorhexidine for hydroxyapatite and salivary mucins. J Periodontal Res, v. 5, n. 2, p. 90–95, 1970. "doi:10.1111/j.1600-0765.1970.tb00698.x"
SANTOS, T. C.
Estudo “in vitro” do efeito do aumento da temperatura
nas
soluções de hipoclorito de sódio sobre suas propriedades físico-químicas
anteriores e posteriores à dissolução do tecido pulpar bovino. 1999. 108p. Dissertação(Mestrado em
Odontologia Restauradora, Subárea Endodontia) - Faculdade de Odontologia de
Ribeirão Preto, Universidade de São Paulo, Riberião
Preto, 1999. Disponível em
<http://www.forp.usp.br/restauradora/Teses/Tanit/tanit_mestrado.html>.
SILVERSTEIN, R. M.; Bassler, G. C.; Morrill, T. C. Identificação espectrométrica de compostos orgânicos. 3. ed. Guanabara Dois. Rio de Janeiro, 1979. 299 p.
SILVERSTEIN, R. M.; Webster,
F. X.; Kiemle, D. J. Identificação espectrométrica de compostos orgânicos. 7. ed. LTC.
Rio de Janeiro, 2007. 490 p.
SIQUEIRA, J. F.; GUIMARÃES-PINTO,
T.; RÔÇAS, I. N. Effects of chemomechanical
preparation with 2.5% sodium hypochlorite and intracanal medication with
calcium hydroxide on cultivable bacteria in infected root canals. J Endod, v
33, n 7, p. 800–805, July 2007 b. "doi:10.1016/j.joen.2006.11.023"
SIQUEIRA, J. F.; UZEDA, M. Influence of different
vehicles on the antibacterial effects of calcium hydroxide. J Endod, v.
24, p. 663-5, 1998 b.
SIQUEIRA, J. F.; UZEDA, M. Intracanal medicaments:
evaluation of the antibacterial effects of chlorhexidine, metronidazole,
and calcium hydroxide associated with three vehicles. J Endod, v. 23, n. 3, p. 167-169, 1997.
SJÖGREN,
U.; FIGDOR, D.; SPÅNGBERG, L.; SUNDQVIST, G. The
antimicrobial effect of calcium hydroxide as a short-term intracanal dressing. Int Endod J, v.
24, n. 3, p. 119-125, May 1991. "doi:10.1111/j.1365-2591.1991.tb00117.x"
SOARES, J. A.; LEONARDO, M. R.; TANOMARU FILHO, M.; SILVA, L. A. B.; ITO, I. Y. Residual antibacterial activity of chlorhexidine digluconate and
camphorated P-monochlorophenol in calcium
hydroxide-based root canal dressings. Braz Dent J, v.
18, n. 1, 2007.
SPÅNGBERG,
L.; ENGSTROM, B.; LANGELAND,
K. Biologic effects of dental materials: 3. toxicity and antimicrobial effect
of endodontic antiseptics in vitro. Oral
Surg Oral Med Oral Pathol,
v. 36, n. 6, p. 856-71, 1973.
SPANÓ,
J. C. E.; BARBIN, E. L.; SANTOS, T. C.; GUIMARÃES, L.
F.; PÉCORA, J. D. Solvent action of sodium hypochlorite on bovine pulp and physico-chemical properties of resulting liquid. Braz Dent J, v. 12, p. 154-157, 2001.
STUART,
C. H.; SCHWARTZ, S. A.; BEESON, T. J.; OWATZ, C. B.
Enterococcus faecalis: its role in root canal treatment failure and current
concepts in retreatment. J Endod, v. 32, n. 2,
p. 93–98, February 2006. "doi:10.1016/j.joen.2005.10.049"
SVENSÄTER,
G.; BERGENHOLTZ, G. Biofilms in endodontic
infections. Endodontic Topics,
v. 9, p. 27-36, 2004.
TANOMARU,
J. M. G.; LEONARDO, M. R.; TANOMARU FILHO, M.; BONETTI FILHO, I.; SILVA, L. A.
B. Effect of different irrigation solutions and calcium hydroxide on bacterial
LPS. Int Endod J, v. 36, n. 11, p. 733-739, November 2003.
"doi:10.1046/j.1365-2591.2003.00717.x"
THYLSTRUP, A.; FEJERSKOV, O. Cariologia Clínica. 2. ed. São Paulo: Santos, 1995. 421p.
TRABULSI, L. R. Microbiologia. 3. ed. São Paulo: Atheneu,
1999.
TRONSTAD, L.; KRESHTOOL, D.;
BARNETT, F. Microbiological monitoring and results of treatment of extraradicular endodontic infection. Dent Traumatol. v .
6, n. 3, p. 129-136, June 1990. "doi:10.1111/j.1600-9657.1990.tb00407.x"
TROPE,
M.; DELANO, E. O.; ØRSTAVIK, D. Endodontic treatment of teeth with apical periodontits: Single versus multivisit
treatment. J Endod,
v. 25, p. 345-50, 1999.
TYLER,
B. J.; RANGARANJAN, S.; MÜLLER,
J.; BEUMER, A.; ARLINGHAUS,
H. F. TOF-SIMS imaging of chlorhexidine-digluconate
transport in frozen hydrated biofilms of the fungus
Candida albicans. Applied Surface
Science, v. 252, p. 6712–6715, 2006. "doi:10.1016/j.apsusc.2006.02.278"
USUI,
K.; HISHINUMA, T.; YAMAGUCHI, H.; TACHIIRI,
N.; GOTO, J. Determination of chlorhexidine (CHD) and nonylphenolethoxylates (NPEOn) using LC-ESI-MS
method and application to hemolyzed blood. J Chromatogr B,
v. 831, p. 105–109, 2006. "doi:10.1016/j.jchromb.2005.11.051"
VIANNA, M. E.; HORZ, H. P.; CONRADS, G.; ZAIA, A. A.; SOUZA-FILHO, F.J.; GOMES, B.P.F.A. Effect of root canal procedures on endotoxins and endodontic pathogens. Oral Microbiol Immunol, v. 22, p. 411–418, 2007.
VICENTE, E.; TOLEDO, M. C. F. Desenvolvimento de metodologia para determinação de 4-cloroanilina em frangos por cromatografia gasosa – espectrometria de massas. Análise em tecidos tratados com digluconato de clorexidina após o processamento térmico. Ciênc. Tecnol. Aliment., v. 23, p. 71-78, dez. 2003.
WALTIMO, T. M. T.; HAAPASALO, M.; ZEHNDER, M.;
MEYER, J. R. G. Clinical aspects
related to endodontic yeast
infections. Endodontic Topics, v. 9, p. 66–78, 2004.
WALTIMO,
T. M. T.; SEN, B. H.; MEURMAN,
J. H.; ØRSTAVIK, D.; HAAPASALO, M. P. P. Yeasts in apical periodontitis. Crit Rev Oral Biol
Med, v. 14, n. 2, 128-137, 2003.
WALTIMO,
T. M.; ØRSTAVIK, D.; SIRÉN, E. K.; HAAPASALO, M. P.
In vitro susceptibility of Candida albicans to four disinfectants and their
combinations. Int Endod J, v.
32, p. 421–9, 1999.
WISHART, D. S.; KNOX, C.; GUO, A. C.; CHE, D. Drugbank: a knowledgebase for drugs, drug actions and drug targets. Nucleic Acids Res, v. 36, n. database, p. D901–D906, 2008. "doi:10.1093/nar/gkm958"
YOLDAS,
O.; TOPUZ, A.; ISÇI, A. S.;
OZTUNC, H. Postoperative pain after endodontic retreatment: Single- versus two-visit treatment. Oral Surg Oral
Med Oral Pathol Oral Radiol
Endod, Vol. 98, No. 4, 483-7, October 2004.
YÜCEL,
A. Ç.; AKSOY, A.; ERTAS,
E.; GÜVENÇ, D. The pH changes of calcium hydroxide
mixed with six different vehicles. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 103, p.
712-7, 2007.
ZAMANY,
A.; SAFAVI, K.; SPÅNGBERG, L. S. W. The effect of chlorhexidine as an
endodontic disinfectant. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 96, n.5, p.
578-81, 2003. "doi:10.1016/S1079-2104(03)00168-9"
ZEHNDER M. Root Canal Irrigants. J Endod, v.
32, n. 5, p. 389-398, 2006. "doi:10.1016/j.joen.2005.09.014".
ZERELLA, J. A.; FOUAD, A. F.; SPANGBERG, L. S. W. Effectiveness of a calcium hydroxide and chlorhexidine digluconate mixture as disinfectant during retreatment of failed endodontic cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 100, n. 6, p. 756-61, 2005. "doi:10.1016/j.tripleo.2005.05.072"